
- •2.Анализ свариваемости металлов на основе диаграмм состояния сплавов
- •3.Диффузионные процессы при сварке плавлением и сварке давлением
- •4. Особенности образования неразъемных соединений пластмасс
- •5. Формирование неразъемных соединений в процессах пайки
- •6. Образование неразъемных соединений посредством склеивания
- •6.1. Механизм адгезии
- •6.2. Выбор клея
- •6.3. Подготовка поверхности склеиваемых материалов
- •6.4. Образование соединения
- •6.5. Факторы, влияющие на прочность соединения
- •6.7. Склеивание пластических масс
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Национальный минерально-сырьевой университет «Горный»
А.С.Тарасов
Физические основы соединения конструкционных материалов
Учебное пособие
САНКТ-ПЕТЕРБУРГ
2013
УДК 621. 79 :669.017
ББК 34.64
Рассмотрены основные факторы, влияющие на свариваемость различных металлов, основные механизмы образование неразъемных соединений в процессах пайки и склеивания. Изложены методы оценки свариваемости на основе диаграмм состояния,
Предназначено для студентов специальностей: 150202.65 «Оборудование и технология сварочного производства» и для студентов по направлению подготовки бакалавриата 150700.62 «Машиностроение».
Научный редактор проф. В.В. Максаров
Рецензенты:
Тарасов А.С.
Т 825 Физические основы соединения конструкционных материалов: Учебное пособие /; Национальный минерально-сырьевой университет «Горный». СПб, 2013, 90 с.
УДК 621. 79 : 669.017
ББК 34.64
© Национальный минерально-сырьевой
университет «Горный», 2013 г.
Роль атомно-кристаллического и молекулярного строения материалов в формировании неразъемных соединений
Свойства атома, и в том числе энергетические показатели связи между электронами и ядром, а также связь между собой атомов одних и тех же элементов и атомов различных элементов (что важно для соединения их сваркой) зависят от общего числа электронов в атоме, расположения их по электронным уровням, от степени заполнения того или иного электронного уровня или подуровня, общего числа электронных уровней, от состояния последнего внешнего электронного уровня, от того, являются ли спины соседних электронов данного подуровнявзаимно уравновешивающими или нет.
Число внешних электронов атома, т. е. электронов, находящихся на внешней оболочке (наивысшем энергетическом уровне) может быть от 1 до 8. Внешние электроны наименее прочно связаны с ядром, поэтому они легче всего отделяются или отдаляются от атома. Именно эти электроны в основном ответственны за создание межатомной связи, которая определяется стремлением атома к получению завершенной электронной оболочки. Поэтому по числу внешних электронов атома определяется его валентность и по степени достроенности внешней оболочки — его активность или способность вступать в соединение с другими атомами. Там, где внешняя оболочка полностью достроена (у гелия — это два электрона, у остальных элементов — не менее восьми электронов), атом вещества оказывается практически пассивным к образованию связей. К таким элементам относятся инертные газы. Валентность элемента (максимальная) в периодической системе определяется группой, в которой находится элемент, что соответствует числу электронов на внешнем уровне.
Соединение отдельных атомов между собой и образование атомных комплексов обусловливает создание молекул химических соединений, образование атомных агрегатов металлов и других веществ. Способность атомов одного и того же вещества или различных веществ соединяться друг с другом в прочный агрегат — образовывать неразъемное соединение является важнейшим фактором при сварке металлов, и в особенности при сварке давлением в твердом состоянии. При сварке давлением свариваемые поверхности сжимаются до сближения на расстояние, на котором могут проявиться силы атомного взаимодействия между свариваемыми поверхностями. Установление атомной связи между этими поверхностями — необходимое условие получения сварного соединения.
В настоящее, время между собой сваривают металлы одни и те же (сталь—сталь, медь—медь и т. д.) и различные (сталь-никель, медь—никель и др.). Сваривают и металлы с неметаллами — керамиками. Номенклатура материалов, свариваемых между собой, непрерывно расширяется.
Рассмотрение природы связи между атомами имеет первостепенное значение как для понимания условий образования различных соединений, и в том числе сварных, так и для разработки новых процессов и новых видов сварных соединений.
Атомы различных элементов отличаются между собой числом электронных оболочек— энергетических уровней, на которых
расположены электроны. При этом, если рассматривать какой-либо данный атом, то чем выше энергетический уровень (чем больше главное квантовое число) электронной оболочки, тем дальше электроны находятся от ядра, тем выше свободная энергия электронов, тем менее прочно они связаны с ядром.
Имеет значение не только увеличение расстояния этих электронов от ядра и уменьшение силы взаимодействия между электроном и ядром, но и экранирующее влияние промежуточных электронных оболочек. Поэтому электроны внешних оболочек в атоме слабее связаны с атомом, чем все остальные электроны. Они могут при соответствующих условиях отдаляться от атома, могут вообще его покидать, переходя, например, к другому атому, у которого внешняя оболочка имеет более низкий энергетический уровень и свободное место (недостроена). Таким образом, одним из факторов, определяющих соединение атомов, является энергетическое состояние электронов на внешней оболочке — валентных электронов: чем слабее они связаны с атомом, тем легче они переходят к образованию связи с другим атомом.
Прочность связи внешних электронов с атомом определяется помимо перечисленных и другими факторами. Большое значение имеет степень заполненности внешней оболочки. Максимальное число электронов на внешней оболочке — восемь. Пример с инертными газами, имеющими полностью застроенные внешние оболочки и не образующими соединений с атомами других веществ, свидетельствует о том, что чем полнее застроена внешняя оболочка, тем прочнее закреплены на ней электроны. Поэтому атомы с одним электроном на внешней оболочке легче всего его отдают.
Сила, с которой удерживается электрон у своего атома, определяется ионизационным потенциалом— напряжением, которое необходимо приложить, чтобы оторвать электрон и сделать атом положительно заряженным ионом. У атома может быть несколько ионизационных потенциалов в соответствии с тем, сколько у него электронов на внешней оболочке и какой по счету электрон отрывается.
Значения первых ионизационных потенциалов различных элементов (отрыв первого электрона с внешней орбиты) — важный показатель способности атомов к установлению межатомных связей — приведены в табл. 1.1. Из таблицы видна периодичность изменения данной характеристики. Наиболее высокие потенциалы ионизации имеют элементы с полностью застроенной внешней оболочкой (инертные газы). По мере уменьшения степени заполнении внешнего уровня потенциал, как правило, падает. Наинизшие потенциалы имеют элементы с наименее заполненными оболочками. По мере увеличения атомного номера элемента сказывается экранирующее влияние внутренних электронных уровней.
Таблица 1.1

Вторые и последующие, потенциалы ионизации, как правило, сохраняют ту же периодичность в изменении.
Ионизационные потенциалы в определенной степени, по-видимому, могут служить энергетическим показателем способности к соединению отдельных частей тех или иных металлов. При условии, что произошло сближение соединяемых частей на расстояния сил атомного взаимодействия и соединяемые поверхности чисты, для установления соответствующей атомной связи нужна какая-то энергия для активации атомов соединяемых частей. Чем ниже потенциал ионизации атома, тем легче его сделать активным для установления связи. С этой точки зрения среди используемых на практике металлов легче всего должен свариваться в твердом состоянии между собой алюминий (ионизационный потенциал 5,98 эВ), несколько труднее — титан (6,82 эВ), затем — ниобий (6,88 эВ), молибден (7,1 эВ), свинец (7,42 эВ), серебро (7,57 эВ), никель (7,63 эВ), магний (7,64 эВ), медь (7,72 эВ), железо (7,8 эВ), вольфрам (7,98 эВ). Конечно, не только потенциал ионизации имеет значение для сварки давлением (в твердом состоянии). Важны и некоторые другие характеристики, в частности, возможность сближения при деформации.
Для прочности межатомной связи большое значение имеет ее тип, т. е. способ и принцип соединения атомов между собой.
Основой межатомной связи и, следовательно, образования неразъемных соединений является взаимодействие электронов, а движущей силой этого взаимодействия — стремление атомов к получению завершенных электронных оболочек и достижению наиболее устойчивого распределения электронов по уровням и подуровням. В результате различных взаимодействий между атомами может образовываться несколько типов наиболее устойчивых электронных структур. Ими оказываются структуры инертных газов и структуры, имеющие во внешней оболочке 18 электронов. Таким образом, при взаимодействии между собой атомов различных веществ каждый из них путем отдачи или захвата электронов стремится приобрести ближайшее ему устойчивое электронное строение. Схематическое изображение склонности атомов различных элементов к переходу в наиболее устойчивые электронные конфигурации по Косселю—Некрасову представлено на рис. 1.1. Атомы металлов стремятся к достижению устойчивой электронной конфигурации, как правило, путем отдачи электронов.

Рис. 1.1. Схема перехода в наиболее устойчивые электронные конфигурации.
Возможность отдачи электронов одними атомами и присоединение их другими создает положительно и отрицательно заряженные ионы, которые, притягиваясь друг к другу, обусловливают наличие прочной атомной связи. По типу образования такая связь между атомами называется ионной (рис. 1.2-а) и естественно возможна только между атомами элементов, обладающих различной способностью к отдаче и присоединению электронов. Ионную связь часто называют еще гетерополярной в связи с тем, что она возникает

Рис. 1.2. Различные виды связи между атомами:
а — ионная: 6 — ковалентная; 9 — полярная; г — металлическая
между различно заряженными атомами. Примером такого ионного соединения может быть поваренная соль. В ней атом натрия отдает электрон и становится положительным ионом, а атом хлора приобретает электрон и становится отрицательным ионом.
Другим видом связи атомов в твердых телах является ковалентная или гомеополярная, иногда ее называют атомной связью (рис. 1.2-б). Для этого типа связи характерно объединение электронов двух соседних атомов (по-видимому, объединяться должны электроны с антипараллельными — противоположными спинами). Такое объединение электронов создает для них общую орбиту с двумя ядрами внутри и может носить непрерывный характер за счет того, что разные электроны внешней оболочки спариваются с соответствующими электронами разных атомов. В результате образуется твердая частица размером, зависящим от количества данного вещества. Такую связь могут образовывать не только различные по своей природе атомы, как это было в случае ионной связи, но и атомы одного и того же элемента. Характерным примером вещества с такими связями может быть алмаз, в котором каждый атом углерода ковалентно связан с четырьмя другими. Этот тип связи весьма прочен. Вещества с такой связью имеют поэтому высокую температуру плавления и твердость.
Молекулярная связь (связь Ван-дер-Ваальса) характерна для атомов с относительно легко деформируемыми электронными оболочками и для объединившихся в молекулы атомов, также способных к деформации внешних объединенных оболочек.
Взаимовлияние магнитных полей большого числа атомов или молекул приводит к тому, что в некоторыхиз них возникает заметно выраженная поляризация — облако отрицательно заряженных электронов смещается в одну сторону, а положительно заряженные ядра — в другую. Образующиеся таким образом диполи способствуют поляризации соседних атомов или молекул, в результате чего вся дипольная система ориентируется таким образом, что друг с другом контактируют противоположные заряды, между которыми действуют силы притяжения, определяющие связь (рис. 1.2-в). Эта связь менее прочна, чем рассмотренные выше, и вещества с молекулярной связью имеют более низкие температуры плавления и сублимации.
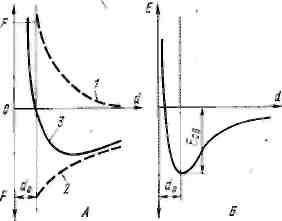
Рис. 1.3. Схема сил притяжения и отталкивания (F) и энергии связи (E):
1 — отталкивание; 2 — притяжение; 3 — результирующее взаимодействие
Прочность молекулярной связи определяется действием двух сил. С одной стороны, между двумя частицами действуют силы притяжения, обусловленные поляризацией зарядов, с другой — при сильном приближении друг к другу частиц начинают действовать силы отталкивания, обусловленные взаимодействием внешних электронных слоев (рис. 1.3-а). С увеличением расстояния между частицами силы отталкивания уменьшаются гораздо резче, чем силы притяжения. Это обусловливает при определенном расстоянии установление равновесия. Расстояние d0 между частицами (центрами частиц), отвечающее такому равновесию сил, определяет устойчивое состояние, характерное для строения данного вещества, при этом d0 энергия связи Eсв максимальна.
Металлы имеют особый тип связи между атомами, названный поэтому металлической связью. Особенность металлической связи обусловлена некоторыми характерными признаками строения внешних оболочек металлических атомов. Как правило, у атомов этих элементов на внешней оболочке имеется только один или два электрона. Это определяет то, что связь электронов с атомом оказывается не сильной и электроны сравнительно легко могут отделяться от атома. Об этом свидетельствуют невысокие потенциалы ионизации атомов металлов В связи с особенностями строения металлических атомов — слабой связью внешнего электрона, металлические свойства оказываются ярче всего выраженными у элементов, находящихся в левой (первые группы с малым числом валентных электронов) нижней (большее число экранирующих электронных оболочек) части периодической таблицы.
Слабая связь внешнего электрона приводит к тому, что в атомном агрегате эти электроны отрываются и беспорядочно блуждают между образовавшимися (оставшимися) положительными ионами (рис. 1.2- г). Конечно, отрыв электронов происходит не одновременно у всех атомов, некоторые из них, по-видимому, могут оставаться неионизированными. Со временем могут оторваться внешние электроны и от них. В то же время, к какому-нибудь из ионизированных атомов может присоединиться электрон из блуждающих в электронном газе. Такимобразом, в каждый данный момент атомный агрегат металла имеет положительно заряженные ионы, какое-то число нейтральных атомов и отрицательно заряженный электронный газ с беспорядочным движением электронов. При наложении внешней разности потенциалов к такому металлу создается упорядоченное, направленное движение оторвавшихся от атомов электронов от минуса к плюсу. В металле возникает ток. Поэтому оторванные от атомов электроны в металле называют электронами проводимости.
Связь между отдельными атомами в таком атомном металлическом агрегате обусловлена взаимодействием каркаса из положительных ионов и отрицательно заряженным электронным газом. Определенное значение для связи имеют и те обмены, которые происходят между электронным газом и нейтральными атомами. Металлическая связь в целом достаточно прочна и эластична в связи с наличием первичного электронного газа как несущего элемента этой связи.
Природа металлической связи слишком сложна, чтобы можно было четко перечислить все факторы и характер их влияния на прочность связи между атомами в металлах и на значение их при сварке. Об относительной прочности этих связей у разных металлов можно судить по косвенным признакам — теплоте плавления и теплоте испарения, поскольку и в том и в другом случае тепловая энергия затрачивается на преодоление, разрушение атомных связей. При плавлении, по-видимому, происходит первая стадия разрушения кристаллического комплекса металлов. Однако отдельные агрегаты кристаллитов могут сохраняться у металлов и в расплавленном состоянии. Полное разрушение кристаллов и нарушение связей происходит при испарении. Поэтому по скрытой теплоте испарения, а еще лучше по сумме теплоты испарения и теплоты плавления, можно приближенно судить о сравнительной прочности атомной связи у различных металлов и соответственно о прочности соединения, в том числе и сварного.
Табл. 1.2 позволяет считать, что при достаточном сближении и активации чистых металлических поверхностей прочность связи в образующемся сварном соединении должна возрастать от магния к вольфраму.
Таблица 1.2
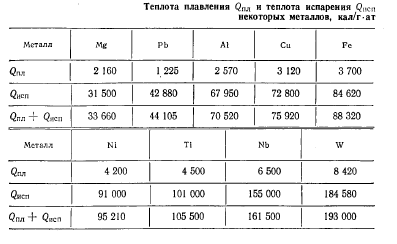
Если сопоставить данные табл. 1.2 с величинами потенциалов ионизации (табл.1.1.), то можно полагать, что на основании учета только этих двух факторов лучше всего в твердом состоянии должны свариваться титан и ниобий (при достаточной деформации и сближении), так как у них при низких потенциалах ионизации и соответственной низкой энергии активации атомов оказывается наиболее прочной связь в образующемся соединении. Хуже всего, по тем же признакам, должен свариваться магний (высокий потенциал ионизации и невысокая прочность связи). Неплохо должен свариваться алюминий. Медь и железо по рассматриваемым принципам, должны свариваться приблизительно одинаково. Рассмотренные два фактора не являются единственными, имеющими значение для сварки. В дальнейшем будут рассмотрены также и другие.
Для соединения двух металлов, помимо прочего, должно иметь значение соответствие их кристаллического строения и размеров атомов. Лучшие условия для совмещения атомов и установления общности кристаллического строения соединяемых металлов, т. е. для их сварки, будут в том случае, если у них будут одинаковыми кристаллические решетки, близкими параметры однотипных решеток и размеры атомов.
Таблица 1.3
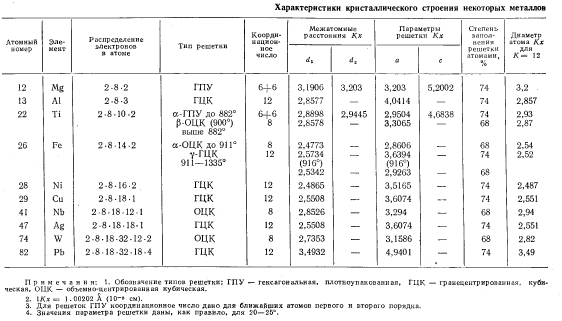
Высказанное соображение позволяет из приведенных в табл. 1.3 металлов выделить три группы с одинаковыми по типу кристаллическими решетками (табл. 4). Из табл. 4 видно, что очень близки друг к другу по типу решетки, ее параметру и межатомному расстоянию никель, медь и серебро, а при температуре выше полиморфного превращения и железо. Никель, медь и серебро должны поэтому хорошо соединяться между собой методами сварки давлением в твердом состоянии. При температуре выше α-γ превращения к указанным элементам добавляется и железо. При том же типе кубической гранецентрированной решетки алюминий несколько отличается от перечисленных элементов параметром и диаметром атома. Это отличие составляет —12%, и, по-видимому, алюминий соединить с никелем, медью и серебром труднее. Еще труднее по этому признаку должен привариваться к перечисленным элементам свинец.
Таблица 1.4

Из объемно-центрированных металлов неплохо должны соединяться между собой титан и ниобий, выше температуры 900° С также и вольфрам. Соединение с железом должно происходить труднее из-за большей разницы в характеристиках кристаллической решетки.
Однако еще раз необходимо подчеркнуть, что имеются и другие факторы, определяющие свариваемость различных металлов.
Рассмотренное выше идеальное строение кристаллической решетки металлов в реальных кристаллах практически не имеет места. Только при идеальных условиях кристаллизации и роста в так называемых нитевидных кристаллах толщиной всего в несколько микрометров удается получить кристаллическое строение, близкое к тому, о котором шла речь.
В реальных кристаллах четкая закономерность построения кристаллической решетки нарушается наличием несовершенств. Роль несовершенств кристаллического строения огромна. Они определяют основные механические свойства металлов, их способность сопротивляться воздействию внешних сил, способность к деформации при нагружении, склонность к хрупкости, а также поведение при сварке, особенно давлением в твердом состоянии и при сварке плавлением. Имеются три основных вида несовершенств: точечные, линейные и плоские.
Представление о дислокациях и впоследствии их экспериментальное обнаружение и изучение сыграло огромную роль в развитии науки о металлах. Прежде всего, только благодаря дислокациям удалось объяснить разницу между теоретическими и реальными механическими свойствами металлов. Теоретический подсчет сопротивления сдвигу исходит из жесткого (синхронного) сдвига одновременно всего атомного ряда по отношению к другому — соседнему атомному ряду. Естественно, что в этом случае необходимо преодолеть очень большую суммарную силу межатомного взаимодействия. При сдвиге за счет перемещения дислокаций происходит не одновременное перемещение всего атомного ряда, а смещение отдельных атомов, и усилие, необходимое для этого, оказывается во много раз меньше. Такое движение дислокации под влиянием внешних сил связано с тем, что она является энергетически неуравновешенным атомным комплексом, в котором в связи с отсутствием уравновешенных атомных связей будет повышенная свободная энергия, характеризуемая вектором Бюргерса. Под влиянием внешнего силового (энергетического) воздействия этот энергетически неуравновешенный участок начинает стремиться (двигаться) к положению с наименьшей свободой энергией (стабильному состоянию), которым является завершающая стадия движения дислокации — выход ее на поверхность или сдвиг (рис. 1.4).
В этой связи важно отметить три обстоятельства: 1) энергетически неустойчивое состояние в отдельных участках атомной решетки кристаллического вещества — дислокация может возникнуть под влиянием внешних сил, вызывающих остаточную (пластическую) деформацию металла — сдвиг; 2) при пластической деформации возрастает количество дислокаций — плотность дислокаций,

Рис. 1.4. Образование и перемещение краевых дислокаций под действием внешней силы:
а — образование дислокации 1; б и в — перемещение дислокации 1и образование дислокации 2: е — выход дислокации 1на поверхность (сдвиг), перемещение дислокации 2 и появление новой дислокации 3 под влиянием продолжающей действовать силы
общая их протяженность в 1 см3 металла (размерность см/см3 или см-2); 3) в процессе возникновения и движения дислокаций, в процессе пластической деформации они перемещаются к поверхности, в результате чего на поверхности увеличивается плотность участков с повышенной активностью.свободной энергией, повышенной активностью.
Большое значение имеют дислокации для строения и свойств сварных соединений. При сварке плавлением условия кристаллизации сварочной ванны в связи с термическим циклом сварки во многом отличны от условий кристаллизации слитков и отливок. Это оказывает характерное влияние на кристаллическое строение сварного шва и несовершенства кристаллического строения, плотность которых в швах часто превышает плотность их в крупных литых изделиях. Большое значение при этом имеют процессы полигонизации, происходящие часто в металле шва после завершения его кристаллизации.
На дислокационное строение в участках зоны теплового влияния оказывают воздействие процессы, связанные с термодеформационным циклом сварки.
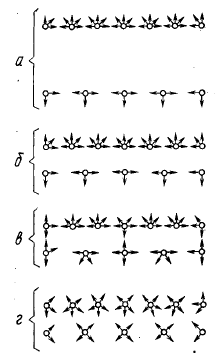
Рис. 1.5. Схема образования соединения при сварке давлением в твердом состоянии: векторы — направление связей атомов;
а — связи поверхностных атомов соединяемых металлов (различных) до сближения; 6 — то же, после сближения на расстояние, близкое к параметру кристаллической решетки одного из металлов, до активации отдельных атомов; в — то- же после активации отдельных атомов; г — то же, после завершении сварки
Особенно большое значение дефекты кристаллического строения .имеют при сварке металлов давлением в твердом состоянии. Согласно последним представлениям, сварка давлением в твердом состоянии предусматривает два необходимых условия. Первое — это сближение свариваемых соединяемых поверхностей на оптимальное расстояние, при котором могут реализоваться силы атомного взаимодействия. Однако такого сближения еще недостаточно, чтобы произошло соединение сближенных поверхностей в неразъемное соединение. Поскольку поверхностные атомы на сближенных независимых поверхностях не активны, их силовые поля уравновешены полями соседних и внутренних атомов в каждой из свариваемых частей (рис. 1.5-а, б). Правда, поскольку поверхностные атомы находятся в условиях, отличных от внутренних атомов в связи с тем, что их внутренние связи оказываются пересыщенными, они имеют бесспорную тенденцию к переходу в равновесное состояние за счет установления нормальных связей с атомами приближенной поверхности с переходом в этом случае в состояние нормального внутреннего атома.
Однако для установления таких связей с атомами приближенной поверхности следует разорвать пересыщенные связи поверхностных атомов. Для этого необходимо второе условие — затрата определенной энергии для их активации. Такая активация участков на соединяемых поверхностях достигается при пластической деформации их в процессе сдавливания за счет выхода на поверхность дислокаций с повышенной свободной энергией. При этом условии может совершиться электронный обмен между атомами соединяемых поверхностей и установление прочной ковалентной или металлической связи с образованием за счет этого неразъемного сварного соединения (рис. 1.5-в, г).
Без активации поверхностных атомов и электронного обмена связь между поверхностями может быть в лучшем случае только гомеополярной (Ван-дер-Ваальса), непрочной, и такое соединение не будет надежным сварным.
Можно предполагать, что активация атомов на поверхности и электронный обмен между атомами соединяемых поверхностей могут быть достигнуты и другими средствами, например нагревом, а может быть даже за счет создания между ними определенной разности потенциалов. Однако и то и другое не исключают надлежащего влияния выхода на поверхность дефектных участков кристаллической решетки с повышенной свободной энергией.
2.Анализ свариваемости металлов на основе диаграмм состояния сплавов
Как правило, элементы, образующие металлический сплав, в жидком состоянии полностью взаиморастворимы, т. е. образуют однородный материал с равномерно распределенными в объеме атомами элементов. Однако имеется ряд металлов, не смешивающихся друг с другом даже в жидком состоянии . Такие элементы, естественно, не могут образовывать сплавов, свариваемых методами сварки плавлением, а их сварка давлением в твердом состоянии — сложная задача. При переходе жидкого однородного сплава в твердое состояние в нем могут происходить различные изменения, связанные с полиморфными превращениями основы сплава, с взаимодействием элементов, составляющих сплав.
Это взаимодействие можно объяснить тем, что элементы добавки и в твердом состоянии полностью или частично растворяются в металле—основе, предел насыщения раствора может быть ограниченным и изменяться с изменением температуры. В ряде случаев составляющие сплава образуют механические смеси либо самих компонентов сплава, либо ограниченных по концентрации твердых растворов. Составляющие сплава могут образовывать химические соединения, которые, в свою очередь, могут оставаться свободными, а могут взаимодействовать с основой, в частности растворяться в ней. Могут быть и другие формы взаимодействия составляющих сплава в твердом состоянии. Важно то, что каждая из них по-своему влияет на свойства сплава и особенно на его поведение при соединении сваркой, а после образования сварного соединения — на его свойства.
Сплав двух или нескольких элементов после перехода из жидкого состояния в твердое может быть в виде твердых растворов, в виде механической смеси фаз и в виде химических соединений. Кроме того, могут существовать и промежуточные состояния, а также сочетания указанных состояний. Характер взаимодействия элементов, образующих сплав (см. табл. 2.1), имеет большое значение для сварки. Лучше всего должны свариваться элементы, дающие непрерывный ряд твердых растворов, хуже —дающие ограниченные твердые растворы, еще хуже — дающие химические соединения и невзаимодействующие.
Таблица 2.1

То или иное состояние затвердевающего сплава зависит от взаимодействия между атомами составляющих его компонентов. Стремление к энергетически более устойчивому состоянию системы обусловливает форму взаимодействия. Твердый раствор имеет определенные отличия от металла растворителя и растворенного элемента.
Пример неограниченной взаимной растворимости в жидком и твердом состояниях двух металлов А и Б представлен на рис. 2. 1. Выше линии плавления (ликвидуса) существует однородная жидкость (одна фаза), между линиями ликвидуса и солидуса — жидкость и кристаллы твердого раствора (две фазы), ниже линии солидуса остается твердый раствор (одна фаза) (рис. 2.1- I). Кристаллизация чистого металла происходит при постоянной температуре, а кристаллизация сплава — в интервале температур между ликвидусом и солидусом (рис. 2.1-II ). Между линиями ликвидуса и солидуса наряду с жидким расплавом существуют кристаллы твердого сплава. На диаграмме состояния линии, ограничивающие области существования различных фазовых систем, характеризуют условия (температуру, концентрацию) равновесия между фазами.
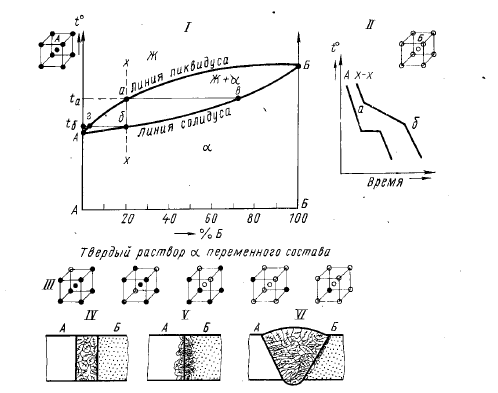
Рис. 2. 1. Диаграмма состояния сплавов металла А с металлом Б при их неограниченной растворимости в жидком и твердом состояниях
В точке А на рис. 2. 1 чистый металл кристаллизуется при постоянной температуре. Для сплава, состоящего из 80% А и 20 % Б, точка а — начало кристаллизации, точка б — конец. На рис. 2. 1- III показано, что в рассматриваемом твердом растворе переход от раствора Б в А к раствору А в Б происходит при постепенной замене в решетке А атомов А атомами Б без определенного порядка мест замещения.
Такого рода взаимодействие возможно для металлов с аналогичными типами кристаллических решеток и атомами близких размеров (см. табл. 2.1). Металлы, дающие сплавы такого типа c неограниченной растворимостью, должны хорошо соединяться различными видами сварки. При сварке плавлением, будь то сварка без присадочного материала (рис. 2. 1- IV) или дуговая сварка плавящимся электродом (рис. 2. 1- VI), зоны плавления и смешивания свариваемых металлов А и Б в жидком состоянии представляют собой достаточно однородный раствор, может быть, с несколько большей концентрацией оплавляемого металла у кромки. После кристаллизации сварной шов представляет собой непрерывный ряд твердых растворов переменного состава. Различие в составе первых выпадающих кристаллов и последних кристаллизующихся порций металла, т. е. микрохимическая неоднородность, увеличивается с уменьшением разницы между температурами плавления свариваемых металлов и увеличением температурного интервала кристаллизации (расстояния между линиями ликвидуса и солидуса). Иным будет строение шва при сварке давлением (рис. 2. 1- V).
При кристаллизации сплава состава Х- Х (см. рис. 2. 1) состав первых кристаллов, выпадающих из расплава при охлаждении его до температурыta, соответствует проекции точки в на горизонтальную ось. Состав кристаллов, образующихся в конце кристаллизации при температуре tbиз последних порций жидкого расплава, соответствует проекции точки г на эту ось. Таким образом, химическая неоднородность сплава определяется отрезком между проекциями точек в и б на горизонтальную ось. На рис. 2. 2 видно, что чем больше разница между температурами плавления компонентов (tг- tв>tг - tб>tг - tа) тем меньше различие составов первых и последних порций кристаллизующегося сплава (рис. 2.2- I отрезки 3, 2, 1), Точно так же неоднородность по составу уменьшается с сужением интервала кристаллизации сплавов (рис. 2. 2-II отрезки 4, 5).
В сварных швах влияние рассмотренных факторов на химическую неоднородность тем больше, чем больше размер сварочной ванны и чем меньше скорость кристаллизации. При сварке давлением в твердом состоянии (см. рис. 2. 1- V) металлы, имеющие неограниченную взаимную растворимость, при наличии даже самых небольших элементов взаимодиффузии должны обеспечивать получение однородных твердых растворов в участках, примыкающих к сварному стыку. В таких соединениях металл должен быть однофазным, что обеспечивает высокие свойства, хотя в соответствии с правилом Н. С. Курнакова при непрерывном ряде твердых
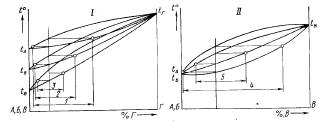
Рис. 2. 2. Влияние разницы температур плавления свариваемых металлов (I) и температурного интервала кристаллизации их сплавов (II) при непрерывном ряде твердых растворов на химическую неоднородность сварных швов
растворов свойства сплавов должны отличаться от свойств образующих их металлов (рис. 2.3). Для непрерывного ряда твердых растворов изменение свойств должно происходить плавно (рис. 2. 3-I) по выпуклой или вогнутой кривой, без скачков. При образовании эвтектик — плавно по прямой (рис. 2. 3-II ), Это важно для сварных соединений, так как постепенное, нескачкообразное изменение свойств благоприятнее влияет на работоспособность сварного соединения, чем скачкообразное, имеющее место в случае образования в сплавах химического соединения (рис. 2. 3-III).
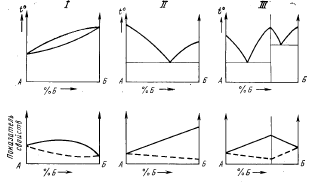
Рис. 2. 3. Характер возможного изменения свойств сплавов элементов с разными типами диаграмм состояния
Неблагоприятно для сварных соединений металлов с рассматриваемым типом диаграммы состояния отсутствие аллотропических превращений в твердом состоянии. Отсутствие вторичной перекристаллизации в твердом состоянии приводит к сохранению крупных кристаллитов, образующихся при первичной кристаллизации; в то время как перекристаллизация в связи с полиморфным превращением в твердом состоянии могла бы привести к измельчению зерна и улучшению свойств.
Большое практическое значение имеют сплавы элементов, образующих равновесные механические смеси — эвтектики (см. табл. 2. 1) при кристаллизации из жидкого состояния, и эвтектоиды — при вторичной кристаллизации. При образовании таких смесей для формирования сварных соединений важно, образуют ли элементы (компоненты) смеси без ограниченных твердых растворов (рис. 2. 4) или же имеют ограниченную взаимную растворимость в твердом состоянии (рис. 2. 5). При отсутствии у компонентов ограниченной растворимости сварное соединение, полученное сваркой плавлением (см. рис. 2. 4, III—V), имеет вполне равномерную микроструктуру с постепенным переходом от одного фазового состояния (кристаллы металла А) к другому (кристаллы металла Б).
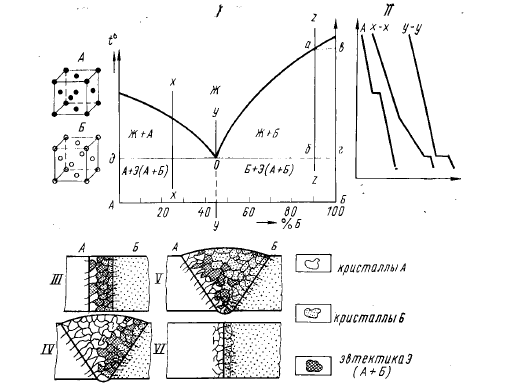
Рис. 2. 4. Диаграмма состояния сплавов металлов А и Б, дающих в твердом состоянии эвтектические смеси:
I— диаграмма состояния; II — кривые охлаждения; III — кристаллическое строение сварного соединения при сварке плавлением без присадочного материала; IV — то же, с присадкой металла А; V — то же, с присадкой металла Б; VI - сварное соединение, полученное сваркой давлением
В жидкой сварочной ванне находится равномерный твердый раствор компонентов А и Б, однако непрерывное контактирование жидкого раствора на одной кромке с компонентом А делает расплав вблизи этой кромки обогащенным компонентом А, а у другой кромки — компонентом Б. Поэтому кристаллизация металла у кромок соответствует сечениям X—X у кромки А и 2—2 у кромки Б (см, рис. 2. 4-I). При охлаждении сплава Z до температуры ликвидуса (рис. 2. 4 -I точка а) начнется выпадение кристаллов Б, которое будет продолжаться до температуры солидуса, которой будет температура эвтектического превращения (точка г). При этой температуре остаток жидкого расплава превратится в равномерную механическую смесь кристаллов Б и А (эвтектику), имеющую состав, соответствующий проекции точки О на горизонтальную ось. Аналогично пройдет кристаллизация сплавов у кромки металла А с той лишь разницей, что первыми начнут выпадать кристаллы металла А.
Таким образом, при сварке плавлением микроструктура и фазовое состояние металла будут постепенно переходить от кристаллов одного металла с малым количеством эвтектики к кристаллам другого металла также с малым количеством эвтектики (см. рис. 2. 4-V), Между этими зонами количество эвтектики будет постепенно увеличиваться, и где-то на промежуточных участках должна находиться чисто эвтектическая зона. Поскольку в участках сварного шва, примыкающих к кромкам каждого из свариваемых металлов, кристаллизуется металл с подавляющим количеством кристаллов данного свариваемого металла, обеспечиваются хорошие условия для сплавления основного металла и металла шва, а постепенное изменение структуры и фазового состояния в пределах металла шва обеспечивает плавный переход свойств одного металла к свойствам другого (рис. 2. 3-II).
При данном типе диаграммы состояния свариваемых металлов хорошее сплавление металла шва с основными свариваемыми металлами обусловливается тем, что на кромках каждого металла из расплава надстраиваются зерна того же металла, т. е. имеет место полное соответствие атомно-кристаллического строения, а в связи с этим и создание надлежащей связи. Для работоспособности сварного соединения имеет положительное значение и плавное изменение свойств в пределах сварного соединения. Образование химической неоднородности в таком сварном соединении неизбежно в связи с разной химической природой металлов А и Б. Градиент химической неоднородности (различие в составе соседних участков) тем больше, чем больше величина концентрационного интервала между эвтектической точкой О и чистыми металлами (см. рис. 3. 4, отрезки Од и Ог).
При сварке давлением в твердом состоянии образование соединения связано с определенными ограничениями. Отсутствие жидкого раствора и кристаллизации с выделением на кромках однотипных кристаллов, а также отсутствие взаимной, хотя бы ограниченной растворимости свариваемых металлов в твердом состоянии исключают протекание диффузионных процессов на границе раздела. Возможность получения сварного соединения в этом случае целиком зависит от получения надлежащего контакта чистых свариваемых поверхностей, создания максимального количества активных центров и соответствия атомно-кристаллического строения.
Для металлов, образующих эвтектические смеси, но имеющих взаимную ограниченную растворимость, механизм образования сварного соединения заметно изменяется (см. рис.2. 5). При сварке плавлением в сварочной ванне на кромках свариваемых металлов из жидкого расплава кристаллизуются не чистые металлы, а твердые растворы на основе соответствующих металлов. На кромке свариваемого металла А будут кристаллизоваться кристаллы твердого α - раствора (Б в А), а на кромках металла Б- кристаллы β - раствора (А в Б).

Рис. 2. 5. Диаграмма состояния сплавов металлов А и Б, дающих в твердом состоянии эвтектические смеси и ограниченные твердые растворы: I — диаграмма состояния; II — элементарные ячейки α - и β - растворов; III — кристаллическое строение сварного соединения при сварке плавлением без присадки; IV — сварное соединение, полученное сваркой давлением; V — то же, c присадкой металла А
Растворимость металла В в А ограничена и изменяется с изменением температуры по линии а—в. Для эвтектической температуры растворимость максимальна и определяется проекцией точки а на горизонтальную ось, а для нормальной температуры определяется концентрацией, соответствующей точке в. Растворимость А в Б также ограничена (линия б—г), но от температуры в рассматриваемом случае не зависит. Предельная концентрация твердого раствора А в Б определяется точкой г.
Эвтектическая смесь в такой системе состоит не из чистых металлов А и Б, а из граничных фаз α- и β-растворов. Для растворов типа α, где предельная растворимость элемента Б в элементе А изменяется с температурой, характерно появление в кристаллах α-частиц β-фазы, которая выделяется при охлаждении в интервале температур от максимальной растворимости Б в А до минимальной (интервал между проекциями точек а и в на вертикальную ось). Эти избыточные кристаллы β-фазы образуются не из жидкого расплава, а выделяются в твердом состоянии в результате уменьшения растворимости при понижении температуры и в отличие от (β-кристаллов, выделяющихся из жидкого расплава, называют вторичными β-кристаллами (βвт).
Эти кристаллы имеют и ту особенность, что, образуясь при более низкой температуре, чем первичные β-кристаллы, они гораздо мельче. Поскольку укрупнение их может происходить только при длительном пребывании при повышенной температуре, когда они могут расти за счет диффузионного поступления к ним атомов образующих компонентов, их размер тем меньше, чем меньше время пребывания при повышенной температуре, т. е., чем больше скорость охлаждения. Правда, при очень большой скорости охлаждения можно переохладить до нормальной температуры твердый α-раствор с максимальной концентрацией растворимых атомов Б. Но такой перенасыщенный твердый раствор неустойчив и может разлагаться со временем с выделением очень мелких дисперсных частиц βвт-фазы. При таком старении сплава выделяющиеся дисперсные частички вторичной фазы препятствуют движению дислокации, что может способствовать его упрочнению, а также повышению хрупкости.
Таким образом, при сварке плавлением на кромках свариваемых металлов А и Б кристаллизуются твердые α - и β - растворы. Атомное и кристаллическое соответствие твердых растворов свариваемым металлам создает хорошие условия для связи металла шва со свариваемым металлом.
По мере удаления от кромок появляется и увеличивается количество эвтектики (α + β) вплоть до чисто эвтектической зоны где-то в промежуточной области. Однако на стороне α - кристаллов могут встречаться отдельные зерна α - раствора c выделениями вторичной βвт - фазы.
Такие кристаллы в определенных условиях обладают повышенными хрупкостью и твердостью. Эти условия — быстрое охлаждение и старение или быстрое охлаждение и небольшой нагрев, облегчающий выделение вторичной фазы.
Для металлов с рассматриваемым типом диаграммы состояния характерно также появление диффузионных зон на границе соединения. Образование диффузионных зон связано с тем, что в металл А в соответствии с наличием определенной растворимости проникает (диффундирует) некоторое количество атомов Б: либо из α - раствора при сварке плавлением, либо непосредственно из металла Б при сварке давлением в твердом состоянии. Точно так же в металл Б будет диффундировать некоторое количество атомов А (см. рис. 2. 5- V). Одновременно может происходить и перемещение других атомов в обратном направлении — атомов А в α -раствор или атомов Б — в β - раствор при сварке плавлением и А в Б и Б в А при сварке давлением.
Наличие таких зон взаимодиффузии улучшает связь в сварном соединении, так как при этом происходит более плавное изменение свойств.
Возможность даже ограниченной взаимодиффузии особенно важна при сварке давлением в твердом состоянии, когда она может стать дополнительным фактором улучшения свойств сварных соединений. Неблагоприятен в сварных соединениях рассмотренного типа эффект старения в отдельных участках как сварного шва, так и примыкающей к шву зоне, где могли образоваться кристаллы перенасыщенного твердого раствора.
Элементы А и Б, которые при кристаллизации образуют химическое соединение АmБn, условно обозначенное как новое вещество С, дают диаграммы состояния типа представленных на рис. 2. 6—2. 8. Различие между указанными системами заключается в том, что в случае, представленном на рис. 2. 6, новое химическое вещество С образует с металлами А и Б эвтектические смеси без какого-либо растворения одного из веществ в другом. На рис. 2. 7 представлен случай, когда новое вещество образует ограниченные твердые растворы с исходными компонентами: твердый α - раствор С в A и твердый β-раствор С в Б. Могут существовать случаи, когда образуются ограниченные твердые растворы A в С и Б в С (штриховые линии на рис. 2. 7) и когда химическое соединение С неустойчиво и при нагреве выше температуры tx распадается (рис. 2. 8). Однако ниже этой температуры вещество вполне устойчиво.

Рис. 2. 6. Диаграмма состояния сплавов металлов А и Б, дающих в твердом состоянии химическое соединение АmБn—С и эвтектические смеси без ограниченных твердых растворов:
I — диаграмма состояния; II — кристаллическое строение сварного соединения при сварке плавлением без присадки; III — то же, с присадкой металла A; IV – сварное соединение, полученное сваркой давлением
Химическое соединение, всегда состоящее из m атомов металла A и n атомов металла Б, с вполне определенными местами этих атомов в кристаллической решетке, имеет свой тип кристаллической
решетки в отличие от упорядоченного твердого раствора с типом решетки элемента А или Б. Поэтому свойства нового вещества радикально отличаются от свойств металлов А и Б (см. рис. 2. 3-III). Очень часто химические соединения двух мягких, пластичных и вязких металлов оказываются твердыми и хрупкими (например, соединения железа с алюминием), В связи с этим особенно важно учитывать возможность образования химических соединений в сварных соединениях.

Рис. 2. 7. Диаграмма состояния сплавов металлов А и Б, дающих в твердом состоянии химическое соединение Аm Бn—С, эвтектические смеси и ограниченные твердые растворы

Рис. 2. 8. Диаграмма состояния сплавов металлов А и Б, дающих в твердом состоянии химическое соединение Аm Бn—С, неустойчивое при высокой температуре
Среди систем, дающих химические соединения, для сварки наиболее благоприятны подобные изображенной на рис. 2. 7 с ограниченными твердыми растворами, как обеспечивающие получение на границе соединения переходных зон твердых растворов.
Для всех типов диаграмм состояния с образованием химического соединения характер строения металла шва очень схожий, с той лишь разницей, что у кромок в случае отсутствия взаимной растворимости будут находиться кристаллы металлов А и Б (см. рис. 2. 4), а в случае ограниченных растворов — соответственно α-кристаллы (раствор С в A) и β-кристаллы (раствор С в Б). Вдали от кромок (вблизи химического соединения) могут также появиться кристаллы растворов А в С и Б в С (пунктирные линии на рис. 2. 7).
Основное влияние на свойства сварного шва, особенно при сварке давлением (см. рис. 2. 6-V), оказывает зона кристаллов химического соединения, подчас со свойствами, резко отличающимися от свойств близлежащих кристаллов, представляющих твердые растворы или эвтектические смеси. Такая неоднородность свойств может отрицательно сказаться на работоспособности тем более, что граница между зоной химического соединения и свариваемыми металлами при отсутствии признаков ограниченной растворимости должна быть резкой. Если же при образовании химического соединения имеется какая-либо ограниченная раствоpимость, то на границе шва появляется соответствующая зона взаимодиффузии, приводящая к образованию ограниченных твердых растворов между швом и кромками основного металла. Это обстоятельство особенно важно при сварке давлением, так как при этом улучшается переход от зоны химического соединения к свариваемым металлам.
Строение металла шва может существенно измениться, если образующиеся в сварочной ванне сплавы металлов А и Б претерпевают полиморфные превращения. Существуют различные виды диаграмм с полиморфными превращениями сплавов в твердом состоянии. В принципе, это сочетание некоторых ранее приведенных диаграмм перехода из жидкого состояния в твердое с последующей перекристаллизацией в твердом состоянии по диаграммам различного типа.
На рис. 2. 9-I показана дальнейшая перекристаллизация в твердом состоянии в результате полиморфного превращения β→α только одного компонента А. Это обусловило получение в определенном интервале концентраций и температур двухфазной твердой области β+α и области α ограниченных твердых растворов Б в А.
На рис. 2. 9-II компоненты при переходе из жидкого состояния в твердое дают неограниченные твердые γ -растворы, а при дальнейшем охлаждении компонент А претерпевает полиморфное превращение γ →α, а компонент Б — превращение γ → β.
Новые аллотропические формы элементов дают эвтектоидЭт-механическую смесь, образующуюся при вторичной кристаллизации, и ограниченные твердые α -растворы (Б в А) и (β -растворы (А в Б). При сварке плавлением у кромок как со стороны шва, так и со стороны металлов А и Б будут располагаться соответственно кристаллы твердых α - и β -растворов, при удалении от кромки А зона α -кристаллов с третичными выделениями β -фазы, а со стороны кромки металла Б — β -кристаллы с третичными вы-
делениями α -фазы. Между этими зонами будет находиться зона кристаллов эвтектоида (рис. 3. 9-III).
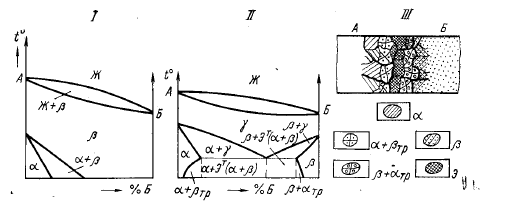
Рис. 2. 9 Диаграммы состояния сплавов с полиморфным превращением в твердом состоянии
Отличительная особенность сварного соединения металлов с полиморфным превращением в твердом состоянии – получение вторичных мелких зерен в пределах крупных первичных кристаллитов, образовавшихся при переходе из жидкого состояния в твердое. Свойства (прочность и вязкость) благодаря этому улучшаются, происходит плавное изменение свойств металла шва (см. рис. 2. 3- I, II) в соответствии с характером образовавшихся фаз.
На практике часто приходится иметь дело со сваркой не только чистых металлов, но и сплавов. Рассмотрение диаграмм состояния при сплавлении трех и более компонентов более сложное в связи с необходимостью использования многомерного принципа их построения. Однако в сварных соединениях сплавов также могут существовать твердые растворы нескольких компонентов, эвтектические или эвтектоидные смеси и химические соединения. Характер кристаллизации и изменения свойств при сварке сплавов близок характеру кристаллизации и изменения свойств чистых металлов.
