
Химия учеб посрбие
.pdf
+ 7 |
|
|
|
+ 7 |
+ 2 |
|
Mn + 5e = Mn+2 (восстановление Mn äî Mn ) |
|
|||||
Здесь ион MnO − |
является окислителем, а ион SO − 2 |
— |
||||
|
|
4 |
|
3 |
|
|
восстановителем. |
|
|
|
|||
− |
|
|
+ 5 |
0 |
|
|
|
|
|
||||
5H Cl + HCl O3 = 3 Cl 2 + 3H2O |
|
|
||||
хлорноватая
кислота
−0
Cl – e = Cl (окисление)
+ 5 |
0 |
Cl +5å = Cl (восстановление)
− 1
Cl — хлорид ион, обладая электронодонорными функция-
0
ми, отдает один электрон и окисляется до Cl, а атом Cl в хлора-
нионе ClO3— проявляет электроноакцепторные функции, при-
0
нимает 5 электронов и восстанавливается до Cl
− 1 |
0 |
|
+ 1 |
+ 3 |
+ 5 |
+ 7 |
|
|
|
|
|
|
Cl |
Cl |
Cl |
Cl |
Cl |
Cl |
|
|
|
|
|
|
|
− 3 |
|
→ |
|
|
0 |
+ 2 |
+ 3 |
|
|
+ 4 |
→ |
+ 5 |
N |
|
|
|
N → |
N → |
N → |
N |
N |
||||
↓ |
|
|
|
|
|
|
|
|
|
|
|
↓ |
может быть только |
окислитель и восстановитель |
|
окислитель |
|||||||||
восстановителем |
|
|
в зависимости от партнеров |
|
|
|||||||
− 2 |
→ |
|
+ |
4 |
→ |
|
+ 6 |
|
|
|
|
|
S |
|
S |
|
S |
|
|
|
|||||
↓ |
|
|
↓ |
|
|
↓ |
|
|
|
|
|
|
восстановитель |
окислитель и |
окислитель |
|
|
||||||||
|
восстановитель |
|
|
|
|
|
|
|
||||
+ 6 |
|
|
|
|
|
|
|
|
|
|
|
|
3K2 Mn O4 + 2H2 = |
|
|
|
|
|
реакция диспропор- |
||||||
|
|
|
|
|
||||||||
+ |
7 |
|
+ 4 |
|
|
|
|
|
|
|||
= 2KMn O4 + Mn O2 + 4KOH |
|
|
|
ционирования, так |
||||||||
+ 6 |
|
|
+ 7 |
|
|
|
|
|
|
как здесь К2MnO4 ÿâ- |
||
2Mn – 1e → |
2 Mn (окисление) |
|
|
|
ляется и окислителем, |
|||||||
+ 6 |
|
+ |
4 |
|
|
|
|
|
|
и восстановителем од- |
||
Mn + 2å → |
Mn (восстановление) |
|
новременно |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
— 81 —
1)Надо знать, что в окислительно-восстановительной реакции происходит эквивалентный обмен электронов между восстановителем и окислителем.
2)Î2 в кислой среде Н2О; в щелочной и нейтральной
ÍÎÍ + Î2 = 2ÎÍ
Применимы два метода составления уравнений реакций: а) электронного баланса, б) ионноэлектронный метод — предусматривает раздельное составление реакции окисления и восстановления и суммарный электронный эффект.
à) Метод электронного баланса:
|
|
|
− 2 |
+ 6 |
|
|
0 |
+ 3 |
|
|
|
Í2 S + K2Cr 2O7 + H2SO4 → |
S + Cr 2(SO4)3 + K2SO4 + H2O |
||||||||
|
↓ |
↓ |
|
|
|
|
|
|
||
восстановитель |
окислитель |
|
|
|
|
|
|
|||
|
|
|
− 2 |
0 |
|
|
|
|
|
− 2 |
|
|
|
|
|
|
|
||||
|
3 |
|
S – 2e = S (окисление), окисленное число S повысилось |
|||||||
|
|
|
+ 6 |
îò –2 äî 0 |
|
|
|
+ 6 |
|
|
|
|
|
|
|
|
|
|
|
||
|
2 |
|
Cr + 3å = Cr+3 (восстановление) Cr окислительное число |
|||||||
|
|
|
|
понизилось до +3, то есть хром восстанавлива- |
||||||
|
|
|
|
åòñÿ, à Ê2Ñr2O7 является окислителем. |
||||||
|
Находят общий множитель, он равен 6. |
|||||||||
|
|
|
− 2 |
0 |
|
|
|
|
|
|
|
3 S — 6e = 3 S |
|
|
|
|
|
|
|||
+ 6 |
|
3S-2 + 2Cr+6 → |
0 |
|||||||
|
2 Cr + 6e = 2Cr+3 |
3 S + 2Cr+3 |
||||||||
|
|
|
|
|
|
0 |
|
|
|
|
3H2S + K2Cr2O7 + 4H2SO4 → |
3 S + Cr2(SO4)3 + K2SO4 + 7H2O |
|||||||||
|
á) Ионно-электронный метод: |
|
|
|
||||||
|
S-2 + Cr |
O − 2 + H+1 → S + 2Cr+3 + H |
O |
|
||||||
2 |
7 |
|
|
|
2 |
|
|
|||
|
|
|
|
|
0 |
|
|
|
|
|
|
восстановитель S-2 – 2e = S (окисление) |
|||||||||
|
|
|
|
|
|
|
− 2 |
− |
|
|
|
окислителем является Cr |
O |
+ 6 e → |
2Cr+3 |
||||||
|
|
|
|
|
2 |
|
7 |
|
|
|
При этом освобожденный кислород и ионы водорода (реакция в кислой среде) образуют молекулу Н2Î.
Cr2O −72 + 14H+ → 2Cr+3 + 7H2O сумма зарядов в левой и правой частях должна быть равна:
— 82 —

Cr |
O − 2 + 14H+ + 6e → |
2Ñr+3 + 7H O (Cr+6 |
восстановлен до Cr+3) |
|
2 |
7 |
|
2 |
|
12 положит. |
добавим |
6 положит. |
|
|
|
зарядов |
6 отрицат. |
зарядов |
|
Затем сбалансирование уравнений окисления, восстанов-
ления:
0
3 S-2 – 2e = S
1 Cr2O −72 + 14H+ + 6e = 2Cr+3 + 7H2O
множитель
3S-2 + Cr2O −72 + 14H+ = 3S + 2Cr+3 + 7H2O
Важнейшие окислители и восстановители периодической системы
Наиболее сильными восстановительными свойствами обладают: Fr, Cs, Rb, K, Ra, Ba (меньшая величина ионизационного потенциала). Наиболее сильными окислительными свойствами обладают F2, O2, Cl2, S, Br2, N2.
Окислительная активность является функцией величины сродства к электрону, чем выше она и чем больше электроотрицательность элементов, тем выше окислительные свойства.
+ 3 |
+ 3 |
+ 3 |
+ 3 |
Fe, Co, Ni наибольшие окислительные свойства у Ni ; Fe+2, Co+2, Ni+2 восстановительные свойства выше у Fe+2.
− 1 − 1 |
− 1 − 1 |
− 1 |
F , Cl , Br , J восстановительная функция увеличивается к J , значит, HJ является довольно сильным восстановителем.
+ 7 |
|
|
+ 5 |
|
|
+ 7 |
+ 6 |
|
|
+ 6 |
−42, |
+ 6 |
|
+ 5 |
|
Cl O |
− |
, |
Cl O |
− |
, |
Mn O− |
, Cr 2O |
− |
2 |
, Cr O |
Fe O− 2 |
, |
N O− 2 |
ÿâ- |
|
|
4 |
|
|
3 |
|
4 |
|
7 |
|
|
|
4 |
|
3 |
|
ляются сильными окислителями.
Í2Î2 обладает окислительными и восстановительными свойствами.
Í2, Ìå, H2S, SO2, SnCl2 C, спирты, альдегиды — восстановители.
Примеры
— 83 —
− 2 |
|
|
− 1 |
→ |
+ 6 |
− 2 |
|
|
− 2 |
Pb S |
+ 4H |
2 |
O |
Pb S O |
+ 4H |
2 |
O |
||
|
|
|
2 |
|
4 |
|
|
S-2 – 8e → S+6 (окисление)
− 1
O 2 + 2å → 2Î−2 (восстановление)
Í2Î2 — окислитель в данной реакции, у кислорода в Н2Î2 окислительное число –1.
MnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
— 84 —
Òåìà 9
ЭЛЕКТРОЛИЗ
Анодное окисление и катодное восстановление
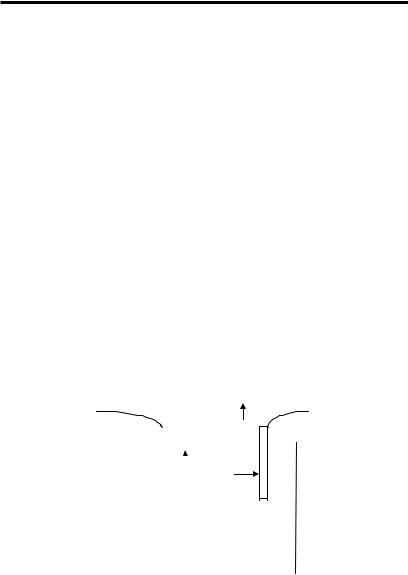
Протекание электричества через раствор электролита, сопровождающееся разрядом положительных ионов (катионов) на катоде (процесс восстановления) и отрицательных ионов (анионов) на аноде (процесс окисления) называется электролизом. В результате электролиза на электродах отлагаются те или иные вещества, а вблизи электродов образуются новые вещества (вторичные процессы при электролизе). Для осуществления электролиза к внешнему источнику тока присоединяют два электрода, к отрицательному полюсу — катод, к положительному полюсу — анод и погружают их в раствор или расплав электролита. Электроды бывают металлические и неметаллические (графитовые). Металлы могут быть растворимыми (при электролизе они посылают в раствор свои ионы) и нерастворимыми Na2SO4 (служат для передачи элек-
тронов). Схема: Pt нерастворимый электрод на К процесс восста-
−
новления: 2Н+ + 2e = Í2 (â âèäå ãàçà), íà À (окисление) 2Cl – 2e = Cl2 (ãàç)
|
|
Pt |
H2 Pt |
|
+ |
|
|
|
H+ |
|
|
|
||
|
|
|
|
|
|
|
Cl2 → |
||
|
|
Cl |
← |
|
|
|
|||
|
|
HCl ↔ |
H+ + Cl |
|
|
|
|
|
|
|
|
|
|
|
— 85 —
Один из электродов является водородным, а другой хлорным электродом. Стандартные потенциалы этих электродов соответственно:
Å°Í2 Í+ =0,00 â; Å°Cl2 Cl = 1,358 â
ÅÝÄÑ = Å° Ñl2 Cl — E°H2 Í+ = 1,358 â = ÝÄÑ
Эту ЭДС и нужно преодолеть. К ЭДС от источника тока нужно добавить ЭДС на преодоление сопротивления электролита. Это дополнительное напряжение, которое нужно приложить извне при электролизе (сверх потенциала разложения этого вещества), называется перенапряжением. Общее напряжение внешнего источника тока, при котором начинается электролиз, называется напряжением разложения.
Последовательность разряда иона
Можно было бы ожидать, что при разряде катионов на К легче всего будут разряжаться те из них, которым отвечает наибольшее значение положительного потенциала. Аналогично при переходе с анода в раствор каких-либо положительных ионов (анодное растворение вещества) легче всего в раствор будут переходить те из них, которым отвечает наибольшее отрицательное значение потенциала. Однако указанная последовательность разряда ионов и их образования на электродах часто нарушается изза перенапряжения.
Например: при электролизе ZnSO4 в кислоте на катоде в первую очередь должны были бы разряжаться водородные ионы, а затем цинк-ионы, так как потенциал Е°Í2 Í+ = 0,00â, à Å°Zn Zn+2 = –0,76 в; но так как перенапряжение водорода на цинке очень велико (≈ 0,70 в), то фактически в указанных условиях будет выделяться цинк, таким образом, при электролизе на катоде легче всего будут разряжаться те ионы, для которых суммарное значение потенциала и перенаряжение наиболее велико.
Закон Фарадея
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит электри- чества выражается двумя законами Фарадея:
— 86 —
I. Массы веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит. Масса вещества, выделившаяся при прохождении 1 кулона, называется электрохимическим эквивалентом.
II. Одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы различных веществ. Для выделения на электроде 1 г экв любого вещества необходимо затратить одно и то же количество электричества, а именно 96494 кулонов, которое называется числом Фарадея.
Вытекает из законов уравнение:
|
|
|
Jt |
|
Jt |
|
|
|
g = Ý |
|
= Ý |
|
, |
|
|
F |
96494 |
|||
ãäå |
Ý |
— ã-ýêâ; |
|
|
|
|
|
J |
— ñèëà òîêà; |
|
|
|
|
|
t |
— продолжительность электролиза; |
||||
|
g |
— масса в г; |
|
|
|
|
F — константа Фарадея, равная произведению числа Аво-
−
гадро на заряд электрона: F = N . e
Все электрохимические эквиваленты пропорциональны химическим.
Применение электролиза для проведения процессов окисления-восстановления
Электролиз является весьма эффективным методом осуществления процессов окисления (на аноде) и восстановления (на катоде). Процессы электроосаждения (осаждение посредством электролиза) разделяются на две группы: процессы гальваностегии и процессы гальванопластики (Якоби, 1837 г.) Гальваностегия — это электроосаждение на поверхности детали из одного металла другого металла, прочно сцепляющегося с поверхностью детали. Электроосажденный слой металла защищает деталь от коррозии, улучшает сцепление поверхности детали с неметаллическим материалом (например, с резиной).
В гальванопластике применяются чаще всего неметаллические катоды (например, из гипса) с поверхностной проводимос-
— 87 —

тью за счет нанесения на них проводящего ток слоя (например, графита). Обычно после нанесения металла на катод слой металла от катода отделяется. При катодном осаждении слоя металла на его структуру и свойства влияют следующие факторы: 1) природа металла и состав электролита; 2) плотность тока; 3) температура электролита; 4) присутствие поверхностно-активных веществ; 5) природа Ме — анода.
Из растворов, содержащих КС (цианкомплексы), образуются особо гладкие и плотные слои Ме. Одновременное выделение электролизом двух металлов возможно, если потенциалы выделения металлов близки. Разделение Ме при электролизе растворов их солей, в принципе, вполне возможно, если потенциалы выделения разделяемых металлов отличны (Cu, Zn). Многие металлы получаются электролизом расплавленных соединений, например, Mg, Al и др. Электролиз проводится в растворах или расплавах электролитов. Применяются растворимые и нерастворимые электроды:
Пример:
1) Ê → чистая медь, А+ — черновая медь — электролит |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
− |
|
|
CuSO |
; на аноде Cu = Cu+2 + 2 e |
; на катоде Cu+2 |
+ 2 e = Cu |
|||||||||||||
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(растворимый медный анод). |
|
|
|
|
|
|
||||||||||
2) Нерастворимый платиновый электрод: |
|
|
|
|
||||||||||||
|
|
Na |
SO |
4 |
↔ |
|
2Na+ + SO − |
2 (диссоциация); |
|
|
|
|
||||
|
|
2 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
íà Ê |
4N a+ + 4H |
2 |
O + 4 e |
= 4Na+ + 4OH +2H |
2 |
↑ |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
4Í+ |
|
4ÎÍ |
вблизи К(NaOH) |
|
||||||
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
èëè 4Í |
2 |
Î + 4e = 4ÎÍ + 2Í |
2 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
íà À+ |
2SO −42 |
+2H2O + 4e = 4H+ + 2SO −42 |
+ O2↑ |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
вблизи А+ (H |
SO |
) |
|||
|
|
èëè 2H |
|
O – 4e = 2H+ + O ↑ |
|
2 |
4 |
|
|
|||||||
|
|
2 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
2H+ |
|
|
|
|
(2OH – 4e) = 4H+ + O2 |
|
|
|
|
|||||
Следовательно, электролиз водного раствора Na2SO4 приво- |
||||||||||||||||
дит к разложению Н2Î íà ↑ |
Í2 è Î2↑ |
|
|
|
|
|
||||||||||
3) Водный раствор KJ с платиновыми электродами:
KJ ↔ K+ + J
— 88 —
|
|
|
|
− |
|
↑ èëè |
íà Ê |
2Ê+ + 2Í |
2 |
Î + 2e = 2Ê+ + 2ÎÍ + Í |
|||
|
|
|
|
2 |
|
|
|
2Í |
2 |
Î + 2å = 2ÎÍ + Í |
↑ |
|
|
|
− |
|
2 |
|
|
|
|
|
|
|
|
|
|
íà À+ |
2J – 2 e = J2↓ |
|
|
|||
По активности к окислению на аноде отрицательные ионы могут быть расположены в следующий ряд: элементарные ионы, сложные:
J, Br, Cl, S2, Se2
элементарные ионы
При электролизе водных растворов соединений, содержащих сложные ионы, вместо последних на аноде будет разряжаться гидроксид-ион.
Пример еще: электролиз водного раствора серной кислоты
с Pt электродом. |
|
|
|
|
|
|
|
|
||
|
H |
SO |
↔ |
2H+ + SO − 2 |
(диссоциация) |
|||||
|
2 |
|
|
4 |
|
|
4 |
|
|
|
|
|
|
|
|
ÍÎÍ ↔ Í+ + ÎÍ |
|
|
|||
íà Ê |
2Í+ + 2å → Í |
↑ |
|
|
|
|||||
|
|
|
|
|
|
2 |
|
|
|
|
íà À |
ÎÍ, SO − 2 |
|
|
|
|
|||||
|
|
|
|
|
|
4 |
|
|
|
|
4OH – 4e → |
|
|
2O ↑ |
+ 4H+ |
|
|
|
|
||
|
|
|
|
|
2 |
|
|
|
|
|
2SO − 2 |
+ 2H |
2 |
O — 4e = 4H+ + 2SO − 2 |
+ O |
↑ |
|||||
4 |
|
|
|
|
|
|
4 |
2 |
|
|
Аккумуляторы
Аккумуляторы — это устройства, являющиеся вторичными источниками электрической энергии. Они характеризуются обратимостью, то есть после разрядки могут быть приведены в исходное состояние пропусканием через них электрического тока от внешнего источника (зарядка аккумулятора).
Аккумулятор применяется для приведения в движение электрокар, шахтных электровозов, подводных лодок, для обслуживания самолетов, аэродромов и беспилотных управляемых объектов, для запуска двигателей автомобилей. Свинцовый аккумулятор состоит из двух перфорированных свинцовых пластин, одна из которых (отрицательная) после зарядки заполнена губчатым металлическим свинцом, а другая (положительная) — двуокисью свинца.
— 89 —
Обе пластины находятся в 25—30 %-м растворе серной кислоты.
Перед зарядкой в свинцовые пластины электродов вмазываются органические связывающие с PbO. В результате взаимодействия получаем:
PbO + H2SO4 ↔ PbSO4 + H2O
На электродных пластинах образуется сульфат свинца.
Процесс зарядки аккумулятора:
+ 2
на катоде — Pb SO4 + 2e = Pb0 + SO−42
+ 2
на аноде — Pb SO4 – 2e + 2H2O = PbO2 + 4H+ + SO −42 Суммарную химическую реакцию при зарядке выразим так:
+ 2 |
|
|
|
0 |
+ |
4 |
|
|
|
|
2 PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4 |
||||||||||
Процесс разрядки: |
|
|
|
+ 2 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
|
на катоде — Pb + SO− 2 |
= Pb SO |
4 |
+ 2e; |
Pb = Pb+2 + 2e |
||||||
+ 4 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на аноде — Pb Î2 + 2H2SO4 = Pb(SO4)2 + 2H2O |
||||||||||
+ 4 |
|
|
|
+ |
2 |
|
|
|
+ SO − |
2 |
Pb (SO |
) |
2 |
+ 2e = Pb SO |
4 |
||||||
4 |
|
|
|
|
|
|
4 |
|
||
_________________________ |
||||||||||
|
|
|
+ 4 |
|
− |
|
+ 2 |
|
|
|
èëè Pb + 2e = Pb |
|
|||||||||
Процессы протекают при зарядке и разрядке аккумулятора суммарно:
|
разрядка |
0 |
+ 2 |
Pb + PbO2 |
+ 2H2SO4 ↔ 2 Pb SO4 + 2H2O |
|
зарядка |
ЭДС аккумулятора:
1,68 |
-0,36 |
Å°[PbO2 + 4H+ ] — E°[Pb + H2SO4] = 1,68 — (–0,36) = 2,046 Â.
Помимо свинцового аккумулятора в практике применяется никелево-кадмиевый, никелево-железный и серебряно-цинко- вый аккумулятор.
— 90 —
