
Химия учеб посрбие
.pdfВалентность — сложное понятие. Наиболее общим можно считать следующее определение: валентность элемента — это способность его атомов соединяться с другими атомами в определенных соотношениях.
Ïîä степенью окисления понимают заряд иона элемента в соединении, вычисленный исходя из предположения, что молекула состоит только из ионов. Ионы щелочных металлов имеют степень окисления +I, ион кислорода –II.
Пример 1. Cl2, Cl:Cl — одна связь, следовательно, хлор одновалентен, а молекула состоит из двух одинаковых атомов, степень окисления равна нулю.
Пример 2. Определить валентность и степень окисления уг-
− 4 − 2 |
0 |
+ 2 |
+ 4 |
лерода в СÍ4, СÍ3ÎÍ, ÑН |
2Î, ÍСÎÎÍ, СÎ2. Валентность угле- |
||
рода во всех соединениях равна четырем, а степень окисления — –IV, –II, О, +II, +IV соответственно.
Кроме валентности по водороду и по кислороду, способность атомов элемента соединяться друг с другом или атомами других элементов можно выразить иными способами: например, через химические связи, образуемые атомом данного элемента (ковалентность) или числом атомов, непосредственно окружаю-
+ 3
щих данный атом (координационное число) Na[Al(OH)4], [C Î (NH3)5Cl]Cl2 — координационное число 5.
Между валентностью элемента в данном соединении, его атомным весом и эквивалентом существует простое соотношение: эквивалент элемента равен атомному весу последнего, деленному на его валентность в данном соединении:
экв. = атомныйвес . валентность
— 11 —
Òåìà 2
ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
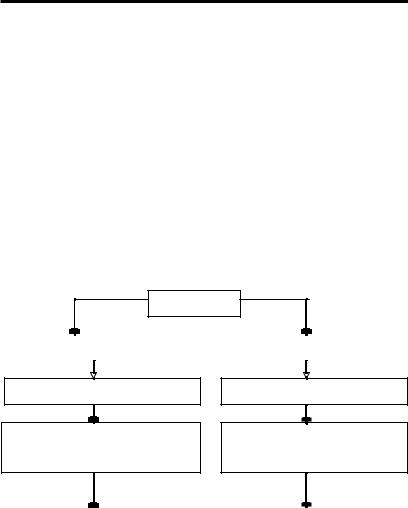
Простые — состоят из одного элемента: металлы и неметаллы, деление основано на физических свойствах простых веществ.
Свойства металлов: блеск, ковкость, тягучесть, прокатываемость, тепло- и электропроводность, находятся в твердом состоянии все металлы кроме Hg при комнатной температуре.
Свойства неметаллов: блеск, хрупкость, плохо проводят тепло и электричество, некоторые газообразны.
Сложные — состоят из двух и более элементов (неоргани- ческие и органические соединения).
ВЕЩЕСТВА
Простые |
|
Сложные |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Состоят из атомов одного вида |
В химических реакциях не могут |
разлагаться с образованием |
нескольких других веществ |
Состоят из атомов разного вида
В химических реакциях могут |
разлагаться с образованием |
нескольких других веществ |
Кислород, водород, сера, |
|
Вода, сульфид железа, |
железо и др. |
|
поваренная соль (хлорид натрия) |
|
|
|
Неорганические соединения: окислы, основания, кислоты, соли.
Окислы — соединения элементов с кислородом, делятся на солеобразующие и несолеобразующие.
— 12 —
Солеобразующие окислы делятся на основные (основания), кислотные — ангидриды кислот (кислоты) и амфотерные (гидраты с основными и кислыми свойствами).
Несолеобразующие окислы не образуют ни кислот, ни оснований.
Согласно международной номенклатуре окислы называются оксидами (ЭО — оксид, ЭО2 — диоксид, ЭО3 — триоксид и т. д.).
Основания состоят из металла и одновалентных гидроксильных групп ОН, основания делятся на растворимые è нерастворимые; растворимые щелочи по силе делятся на сильные (КОН, NaOH) и слабые (NH4OH).
Кислоты состоят из водорода, способного замещаться металлом, и кислотного остатка (HСl, H2SO4, HNO3, CH3COOH). Кислоты классифицируются по их силе, по основности и наличию кислорода в составе кислоты. По силе кислоты делятся на сильные (HNO3, HCl, H2SO4) è слабые (CH3COOH). По основности кислоты делятся на îäíî-, äâóõ-, òðåõ- è ò. ä. основные (число атомов водорода в молекуле кислоты, способных замещаться на металл с образованием соли). HCl, CH3COOH — одноосновные кислоты; H2SO4 — двухосновная кислота; Н3ÐÎ4 — трехосновная кислота (ортофосфорная кислота).
По наличию кислорода кислоты делятся на кислородсодержащие è бескислородные. HNO3 è H2SO4 — кислородсодержащие кислоты, а HCl, H2S — бескислородные кислоты.
Название кислот производят от того элемента, от которого образована кислота и еще добавляется слово «водородная»:
HCl — хлористоводородная; HBr — бромистоводородная; H2S — сероводородная, и т. д.
В случае кислородсодержащих кислот в названии отсутствует слово «водородная»:
HNO3 — азотная;
HNO2 — азотистая; H2CrO4 — хромовая; H3AsO4 — мышьяковая; H3AsO3 — мышьяковистая.
Одному и тому же оксиду могут отвечать несколько кислот
в зависимости от содержания Н2Î: |
→ |
|
Í3ÐÎ4 — ортофосфорная (Р2Î5 |
3Í2Î); |
|
ÍÐÎ3 — метафосфорная (Р2Î5 |
→ |
1Í2Î). |
— 13 —
Ñîëè представляют собой продукты замещения водорода в кислоте на металл или гидроксильных групп в основании на кислотный остаток.
При полном замещении водорода на металл получаются средние — нормальные соли; при неполном замещении гидроксильных групп получаются или кислые, èëè основные ñîëè:
Ca(OH)2 + H2SO4= CaSO4 + 2H2O
↓
нормальная соль (сульфат кальция)
ÊÎÍ + H2SO4 = KHSO4 + H2O
↓
кислая соль (гидросульфат калия)
Mg(OH)2 + HCl = MgOHCl + H2O
↓
основная соль (гидроксохлорид магния)
Двойные соли: KAl(SO4)2 — сульфат калия-алюминия.
Смешанная соль: CaClOCl — кальциевая соль соляной и хлорноватистой кислоты (HOCl).
По международной номенклатуре в названии соли отражается название металла и латинское название кислотного остатка:
бескислородные соли — «ид» — NaCl — хлорид натрия; Na2S — сульфид натрия;
кислородсодержащие соли — «ат» |
— Na2SO4 — сульфат натрия; |
— максимальная валентность |
|
«ит» — минимальная валентность |
— Na2SO3 — сульфит натрия. |
Если металл имеет переменную валентность, то называется
òàê:
сульфат Fe — FeSO4 — (II);
тоже сульфат Fe — Fe2(SO4)3 — (III); Na2HPO4 — гидрофосфат натрия; NaH2PO4 — дигидрофосфат натрия; AlOHCl2 — гидроксохлоридалюминия; Al(OH)2Cl — дигидроксохлоридалюминия.
— 14 —

Òåìà 3
ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА
Гениальным русским ученым Д.И. Менделеевым в 1869 г. было сделано открытие периодического закона, что создало но-
вую эпоху в химии. Ученый сформулировал его |
|
|
следующим образом: свойства простых веществ, |
|
|
а также формы и свойства соединений элемен- |
|
|
тов находятся в периодической зависимости от |
|
|
величины атомных весов элементов. |
|
|
Слева направо уменьшаются металлические |
|
|
свойства, а возрастают металлоидные (от Li до |
|
|
Ne), затем от Na до Ar опять повторяются свой- |
|
|
ства по мере возрастания атомного веса. Изме- |
Дмитрий Иванович |
|
нение свойств химических элементов по мере |
Менделеев |
|
(1834—1907) |
||
возрастания их атомного веса не совершается не- |
||
|
прерывно в одном направлении, а имеет периодический характер.
Через определенное число элементов происходит как бы возврат назад, к исходным свойствам, после чего в известной мере вновь повторяются свойства предыдущих элементов в той же последовательности, но с некоторыми качественными и количественными различиями.
Ряды элементов, в пределах которых свойства изменяются последовательно, как, например, ряд из восьми элементов от Li до Ne и от Na до Ar, Д.И. Менделеев назвал периодами.
Разделив все элементы на периоды и располагая один период под другим так, что сходные по свойствам и типу образуемых соединений элементы находились друг под другом, ученый составил таблицу, названную им периодической системой элементов по группам и рядам.
В малых периодах (повторяемость 8 элементов) и больших периодах (через 18 элементов) повторяются свойства элементов.
— 15 —
В вертикальных столбцах таблицы, или в группах, располагаются элементы, обладающие сходными свойствами. Группы периодической системы делятся на две подгруппы («четную» и «не- четную» — составляя главную и побочную подгруппы).
Из опытов Резерфорда следовало, что заряд ядра численно равен порядковому номеру элемента в периодической системе. Порядковый номер оказался важнейшей константой элемента, выражающей положительный заряд ядра его атома.
Итак, заряд атомного ядра является основной величиной, от которой зависят свойства элемента и его положение в периодической системе (не были известны 43, 61, 72, 75, 85, 87).
Поэтому периодический закон Д.И. Менделеева в настоящее время можно сформулировать следующим образом: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
Некоторые элементы не были известны до составления таблицы, он оставил места, и в течение 15 лет их открыли: Лекок (Франция) — галлий (экв. Al); Нильсон (Швеция) — скандий Sc (экв. В); Винклер (Германия) — германий Ge (экв. Si). Он предсказал свойства этих элементов. Их открытие было величайшим триумфом периодического закона.
Периодическая система дала толчок к исправлению атомных весов некоторых элементов: Be, Cs (цезий).
Периодический закон остается путеводной нитью и руководящим принципом химии. На его основе были искусственно созданы в последние десятилетия трансурановые элементы (101 назван менделевием).
Периодическая система Д.И. Менделеева имеет огромное значение для химии, философии и для всего нашего миропонимания. В ее основе лежит фундаментальный закон развития природы — закон перехода количества в качество.
Периодическому закону не грозит разрушение, а обещается только надстройка и развитие.
— 16 —

Òåìà 4
СТРОЕНИЕ АТОМА
Состав атомов сложен. В 1897 г. английским физиком Томсоном был открыт электрон. Электрон — элементарная частица, обладающая отрицательным зарядом (4,803 . 10-10 ýë-ñò.åä).
Масса электрона 9,108 . 10-28 г, то есть в 2000 раз меньше массы атома водорода. Электроны содержатся в атомах всех элементов. Атомы представляют собой сложные образования, построенные из более мелких структурных единиц.
Открытие и изучение радиоактивности позволило установить сложную природу атома.
Радиоактивностью названо явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать почернение фотографических пластинок.
Таким ученым, как А.А. Беккерель (Франция) (1896), Мария Складовская-Кюри и Пьер Кюри (Франция) (1898), Э. Резерфорд (Англия), мы обязаны открытию радиоактивности, они заложили основы современного учения о строении атома.
Радиоактивное излучение (в магнитном поле):
-β -лучи — отрицательно заряженные частицы; это поток быстродвижущихся электронов;
-ϒ -лучи, не несущие электрический заряд; это электромагнитное излучение, сходное с ренгеновскими лучами, обладающее большой проникающей способностью;
-α -лучи, обладающие положительным зарядом; α -лучи состоят из частиц, масса которых равна массе атома гелия, а абсолютная величина заряда — удвоенному заряду электрона.
Э. Резерфорд в 1911 г. предложил схему строения атома, получившую название ядерной модели атома. Она обладает недостатками. Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома и вращающихся вокруг него электронов. Положительный заряд нейт-
—17 —
рализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру. Размеры ядра малы (диаметр атома — 10-8 см, диаметр ядра — 10-12 — 10-13 ñì).
Из опытов Резерфорда следовало, что заряд ядра, выраженный
âединицах заряда электрона, численно равен порядковому номеру элемента в периодической системе. Противоречие теория Резерфорда
âтом, что она не могла объяснить устойчивости атома. Электрон, непрерывно излучая электромагнитную энергию и двигаясь по спирали, будет приближаться к ядру. Исчерпав всю свою энергию, он должен «упасть» на ядро, и атом прекратит свое существование. На самом деле атом — это устойчивое образование.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Электрон, вращаясь вокруг ядра, должен приближаться к ядру, непрерывно меняя скорость своего движения, частота испускаемого им света определяется частотой его вращения и, следовательно, тоже должна непрерывно меняться. Это означает, что спектр излучения атома должен быть непрерывным, сплошным. В действительности же спектр у атома линейчатый.
Существенный шаг в развитии представлений о строении атома сделал в 1913 г. Нильс Бор, предложивший теорию, объединяющую ядерную модель атома с квантовой теорией света (основополагающие исследования принадлежат Эйнштейну).
Лучистая энергия испускается и поглощается телами не не-
прерывно, а дискретно, то есть отдельными порциями — квантами. Уравнение Планка Å = hν , ãäå h — постоянная Планка = 6,625 . 10-34 Äæ . ñ.
Излучение представляет собой поток неделимых материальных «частиц» фотонов, энергия которых определяется уравнением Планка. Фотон обладает двойственностью: ведет себя как частица корпускула и обладает волновыми свойствами — это проявляется в волновом характере распространения света.
Нильс Бор сделал вывод, что энергия электрона в атоме не может меняться непрерывно, а изменяется скачками, то есть дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные, «разрешенные» состояния.
—18 —
Иначе говоря, энергетические состояния атома квантованы. Переход из одного разрешенного состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
Основные положения теории Бора (постулаты), содержание которых сводится к следующему:
1.Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных.
2.Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3.Излучение происходит при скачкообразном переходе электрона с одной стационарной орбитали на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий атома в конечном и исходном состояниях.
|
Å = Åêîí — Åèñõ; hν = E — уравнение Планка, Åêîí — Åèñõ = hν ; |
|||
ν = |
Ек он− Еис х |
|
. Это уравнение позволяет вычислить частоты или |
|
h |
||||
|
|
|||
длины волн излучения, способного испускаться или поглощаться атомом, то есть рассчитать спектр атома.
Расчет спектра атома водорода, выполненный Бором, дал блестящие результаты. И все же триумф ученого нельзя счи- тать полным.
Теория страдала внутренней противоположностью. (Где находится электрон в процессе перехода с одной орбиты на другую?) Переход этот длится во времени. Промежуточные состояния электрона запрещаются теорией. Теория Бора не смогла объяснить некоторых важных спектральных характеристик многоэлектронных атомов и т. д. Но это был важный этап в развитии представлений о строении атома, с помощью квантовой механики удалось привести в соответствие описание свойств и поведения объектов микромира.
Электронам, как и фотонам, присуща корпускулярно-вол- новая двойственность. Электрон — это весьма сложное материальное образование.
Дальнейшее развитие науки вскроет более глубокие и сложные объекты микромира.
— 19 —
Исходя из представления о наличии у электрона волновых свойств, австрийский физик Э. Шредингер в 1925 г. предложил, что состояние электрона, движущегося в атоме, должно описываться уравнением стоячей электромагнитной волны де Бройля:
λ = h/mc,
ãäå λ — длина волны;
h — постоянная Планка; m — масса электрона;
ñ — скорость распространения.
Вероятность обнаружения электрона в некотором малом объеме ∆ V выражается произведением ϕ 2 . ∆ V, ãäå ϕ — волновая функция, а ϕ 2 выражает плотность вероятности.
Правильнее рассматривать схематическое изображение электрона, «размазанного» по всему объему атома, в виде так называемого «электронного облака». Иначе говоря, плотность электронного облака пропорциональна квадрату волновой функции. Под электронным облаком условно будем понимать область пространства вблизи ядра атома, в которой сосредоточена преобладающая часть (90 %) заряда и массы электрона.
Кинетическая энергия электрона:
|
|
Å = |
mv2 |
|
= |
h2 |
n2 |
, |
|
|
|
|
8ml2 |
||||
|
|
2 |
|
|
|
|
||
ãäå |
m |
— масса электрона; |
|
|
|
|
||
|
h |
— постоянная Планка = 6,62517 . 10-34 Äæ . ñ; |
||||||
|
v |
— скорость электрона; |
|
|
||||
|
l |
— длина одномерного атома; |
|
|||||
n— целое число (называется квантовым числом); n = 1, 2, 3, 4...
Для полного описания состояния электрона в реальном атоме необходимо указать значения четырех квантовых чисел (координаты в пространстве и «спин»).
Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа n (n = 1, 2, 3...
и т. д.). Наименьшей энергией электрон обладает при n = 1. Поэтому состояние электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме. n = 1 — первый энергети- ческий уровень и т. д.
— 20 —
