
Химия учеб посрбие
.pdf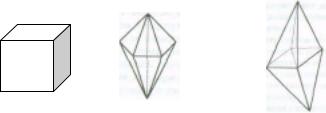
Строение и свойства кристаллов
Для твердых тел характерно два основных состояния: аморфное и кристаллическое.
Аморфным (бесформенным) называется состояние, при котором тела не имеют определенного строения, могут принимать любую форму и характеризуются изотропностью, то есть одинаковым изменением различных свойств (механических, оптических, электрических, магнитных и др.) независимо от направления.
Кристаллами называются твердые тела, которые имеют правильное периодическое расположение частиц (ионы, атомы, молекулы), колеблющихся относительно некоторых точек равновесия (поступательное движение частиц отсутствует). Вещества имеют строго определенную температуру плавления.
Анизотропия характерна для кристаллов, то есть свойства (прочность, теплопроводность и т. д.) изменяются неодинаково в зависимости от направления.
Явления анизотропии объясняются особенностями внутреннего строения кристаллов.
Все кристаллические формы подчиняются закону постоянства гранных углов: как бы неравномерно ни происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла, всегда остаются для данного вещества одни и те же.
Кристаллы являются различными комбинациями сочетаний
симметрии (32 вида симметрии): |
|
1) кубическая 2) гексагональная |
3) тетрагональная |
Плоскость симметрии — воображаемая плоскость, делящая кристалл на две части так, что одна из частей является зеркальным отражением другой.
— 41 —
Ось симметрии — линия, при вращении вокруг которой на 360° кристалл некоторое число раз может совместиться с самим собой (в кристалле может быть несколько осей симметрии).
Центр симметрии — это точка внутри кристалла, в которой пересекаются и делятся пополам линии, соединяющие соответствующие точки на поверхности кристалла.
Наименьшая часть решетки, отражающая форму всей кристаллической структуры данного тела, называется элементарной ячейкой. Вершины ячейки называются узлами. В узлах решетки располагаются ионы, атомы, молекулы, из которых построен кристалл.
Простейшим типом решетки является решетка кристаллов правильной системы с кубической элементарной ячейкой.
Число атомов или ионов, окружающих данный атом или ион в кристалле, называется координационным числом (2, 3, 4, 5, 6, 8 è 12).
Образование кристаллов из ионов, атомов, молекул, сопровождающееся выделением энергии, называется энергией кристаллической решетки.
От величины энергии кристаллической решетки зависят упругость твердого тела, его прочность, твердость, летучесть и д- ругие характеристики.
В зависимости от того, из каких частиц (ионы, атомы, молекулы) построен данный кристалл, проявляются различные типы связи, что и определяет свойства кристалла. Типы кристаллических решеток: ионная, атомная, молекулярная, металлическая.
Атомная решетка составлена не ионами, как это имеет место в ионной решетке, а атомами элементов. Атомная решетка характерна для некоторых элементарных веществ (алмаз) и сложных (SiC). В атомной решетке обычно проявляется ковалентная связь, для нее характерны большая твердость, высокая tïë и малая летучесть.
Молекулярная решетка — в ее узлах расположены молекулы веществ с ковалентной связью между атомами. Связь между молекулами осуществляется слабыми ван-дер-ваальсовыми силами. Обычно эти кристаллы обладают низкой tïë и большой лету- честью (нафталин, йод, твердая СО2).
— 42 —
Металлическая решетка — в ее узлах находятся положительные ионы, а между ними — свободные электроны. Электроны переходят от одного атома к другому, связывая их между собой. Металлическая связь, проявляющаяся за счет обобществления внешних электронов, является одним из видов химической связи. Характерные свойства металлов — электропроводность и теплопроводность, пластичность, блеск — обусловлены нали- чием в их решетке свободных электронов.
Целый ряд веществ, в том числе графит, глина, слюда, обладают слоистой структурой. Расстояние между слоями значи- тельно больше, чем между атомами, находящимися в одной плоскости, поэтому связь между слоями слабее.
Изоморфными называются вещества, близкие по химической природе и составу, способные образовывать кристаллы одинаковой формы.
Явление, называемое полиморфизмом, заключается в том, что одно и то же вещество в зависимости от условий кристаллизации образует кристаллы различной формы (сера, карбонат кальция и др.).
Стекла — это вещества, которым разнообразные причины препятствуют перейти в стабильное кристаллическое состояние. Наличие микрокристаллов обеспечивает упорядоченное их строение (S, Se, BO, фосфаты, силикаты, бараты).
— 43 —

Òåìà 6
РАСТВОРЫ
Раствором называется однофазная система переменного состава, состоящая из двух или более компонентов.
Компонентами являются растворитель и растворенное вещество. Количественный состав растворителя определяется концентрацией, то есть относительным содержанием каждого из компонентов, составляющих раствор. Способы выражения концентраций: весовые, молекулярные, атомные проценты. Концентрация выражается числом г-молей растворенного вещества в 100 молях раствора, или это число весовых долей вещества в 100 весовых долях раствора:
40 % Í SO â ìîë. % |
40 |
(молекулярный вес H SO = 98,08 г) |
||||||||||||||
|
||||||||||||||||
2 |
4 |
98,08 |
|
|
|
|
2 |
4 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 мол. раствора содержат мол. H2SO4 100 |
|
98,08 |
|
= |
||||||||||||
|
40 |
+ |
|
60 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
18 |
|
||||
= 10,91 ìîë. %; 100 — 10,91 = 89,09 ìîë % Í2Î |
98,08 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||
Моляльность: концентрация определяется числом молей m |
||||||||||||||||
растворенного вещества в 1 кг растворителя: |
|
|
|
|
|
|
|
|
||||||||
|
|
Ìîëü Í2Î = |
|
1000 |
= 55,5 |
|
|
|
|
|
|
|
|
|||
|
|
18,02 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
m = |
10,91 55,5 |
= 6,798 |
10,91 ìîë. % |
|
H SO |
|
||||||||||
|
|
|
||||||||||||||
|
89,09 |
|
|
|
|
|
|
|
2 |
|
4 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Молярность определяется числом молей растворенного вещества, содержащихся в 1 л раствора. 1М раствор — это значит, в 1000 мл раствора содержится 1М вещества (1М, 0,1М и т. д.).
40 % H |
SO |
, ïðè 25 °Ñ d = 1,303 ã/ñì 3 |
2 |
4 |
|
— 44 —

M |
|
= |
1,303 1000 0,4 |
= 5,314 |
H2SO4 |
|
|||
|
98,08 |
|
||
|
|
|
||
Нормальность определяется числом г-экв растворенного вещества в 1 л раствора:
1 ã-ýêâ. Í SO = 49 = |
М.mH2SO4 |
= |
98 |
= 49 |
||
2 |
2 |
|||||
2 |
4 |
|
|
|||
|
|
|
|
|||
Í = 1,303 1000 0,4 = 10,628, 49
где Н — нормальность Òèòð — концентрация определяется количеством граммов
вещества в 1 см3 раствора:
40
Ò = 1,303 100 = 0,521
Растворимость
Растворимость зависит от природы вещества, растворителя, температуры, давления. Растворимость газа в жидкости увеличи- вается с повышением давления и уменьшается с повышением температуры.
Зависимость растворимости газа от температуры при постоянном давлении выражается уравнением:
lgõ = À — TB — уравнение изобары растворимости,
Ò— абсолютная температура,
Àè Â — коэффициенты, характеризующие раствор.
Правило Генри:
õ = ÊÐ — изотерма растворимости, Ò = const, õ — концентрация насыщенного раствора, Ê — коэффициент, характеризующий природу компонента, Ð — давление.
Растворимость жидкости в жидкости обычно увеличивается с повышением температуры и почти не зависит от изменения давления (при 168 °С анилин в Н2О полностью растворим), твердое тело в жидкости — с увеличением температуры растворимость увеличивается.
— 45 —

Кривые растворимости
C1 = Ê, Ê — коэффициент распределения.
C2
Закон распределения: когда между двумя несмешивающимися жидкостями введен третий компонент, растворимый в I и II жидкостях, равновесное распределение третьего компонента между двумя несмешивающимися жидкостями обычно отвечает постоянству отношений концентраций.
Тепловые явления при растворении
Образование растворов сопровождается тепловым эффектом. Q зависит от типа связей растворенного вещества:
Í2SO4 â Í2О — экзотермическая реакция;
NaCl â Í2О — эндотермическая реакция — 5,36 кДж. Интегральная теплота растворения определяется величиной
суммы теплового эффекта при растворении определенного коли- чества вещества в определенном количестве растворителя [AgNO3(– Q), H2SO4(+Q)]
Q
m = Qp — теплота растворения;
Q
1моль в - ва = Q — молекулярная теплота растворения;
Qраств.= Q1 + Q2,
ãäå Q1 — разрыв кристаллической решетки; Q2 — образование кристаллогидратов.
Давление пара растворов
Давление насыщенного пара над раствором является важной характеристикой, оно во многом определяет физико-хими- ческие свойства раствора.
N1 + N2 = 1; состав в мольных долях; N1 — мольная доля растворителя ; N2 — мольная доля растворенного вещества.
— 46 —
Ð = Ð1 + Ð2; Ð1 — парциальное давление пара компонента 1; Ð2 — парциальное давление компонента 2.
Согласно закону Дальтона давление насыщенного пара над системой равно сумме парциальных давлений компонентов, образующих данную систему. Парциальные давления компонентов зависят от их количественного соотношения в смеси или от их мольной доли:
P1 = P 10 . N1; P2 = P 02 . N2; P = P 10 . N1 + P 02 . N2; если II компонент не летучий, то P 02 = 0 и тогда Ð2 = 0 и уравнение принимает вид:
Ð = P 10 . N1 = P 10 (1 — N2),
ãäå Ð — парциальное давление летучего соединения, то есть общее давление насыщенного пара над раствором определяется только парциальным давлением летучего компонента.
Это аналитическое выражение I закона Рауля. Он читается так: понижение давления насыщенного пара над раствором пропорционально мольной доле растворенного вещества.
Температура кипения и кристаллизации
Любая жидкость кипит, когда давление ее насыщенного пара достигает величины внешнего давления. Температура, при которой давление насыщенного пара равно нормальному давлению (760 мм рт. ст.), называется температурой кипения. Согласно I закону Рауля давление насыщенного пара растворителя над раствором меньше давления насыщенного пара над чистым растворителем при той же температуре. Значит, при температуре кипения чистого растворителя давление насыщенного пара над раствором нелетучего вещества не достигнет нормального давления и раствор кипит при более высокой температуре.
Разность между têèï раствора нелетучего вещества и чистого растворителя называется повышением ∆ têèï, с другой стороны, любая жидкость кристаллизуется, когда давление ее насыщенного пара равно давлению насыщенного пара соответствующих кристаллов.
— 47 —
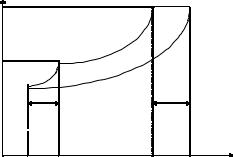
Ïðè Ò кристаллизации растворителя давление насыщенного пара растворителя над раствором не достигает давления пара кристаллов, и из раствора чистый растворитель кристаллизуется при более низкой температуре.
Разность между температурами кристаллизации чистого растворителя и раствора называется понижением температуры кристаллизации и обозначается ∆ têð.
|
|
∆ t |
êèï |
= Ê . m; ∆ t |
êð |
= Ê |
. m |
(1), |
|
|
|
ý |
|
ê |
|
||
ãäå |
m — моляльная концентрация раствора (число молей ве- |
|||||||
|
|
щества в 1000 г растворителя); |
|
|||||
|
Êêð |
— криоскопическая постоянная растворителя; |
|
|||||
|
Êý |
— эбуллиоскопическая постоянная растворителя. |
|
|||||
|
Уравнение (1) выражает II закон Рауля, он сформулирован |
|||||||
òàê: повышение температуры кипения или понижение температуры кристаллизации прямо пропорционально моляльной концентрации растворенного вещества.
Физический смысл Êêð, Êêèï: åñëè m = 1, ∆ têèï = Êý; ∆ tçàì =
Êêð.
Êý, Êêð показывают, на сколько градусов ниже или выше кипит раствор, содержащий 1 моль вещества, растворенного в 1000 г растворителя, по сравнению с têèï è tçàì чистого растворителя.
Рдав. Ратм. |
|
|
I |
|
|
∆ |
tкр |
II |
∆ |
tкип |
|
tкр |
0° |
|
100° |
tкип |
Т |
I кривая — давление пара чистого растворителя; II кривая — давление пара раствора.
Для разбавленных растворов может быть определен молекулярный вес через ∆ têð, ∆ týá.
— 48 —
|
|
|
x |
= 1000 x |
|||
|
|
|
|
|
|||
m = |
|
|
M |
||||
|
|
|
y |
|
M y |
, |
|
|
1000 |
|
|
|
|||
ãäå m — моляльная концентрация;
õ— масса растворенного вещества в граммах с молекулярным весом М;
ó— масса растворителя в граммах; в уравнение (1) подставляем m значение и решаем относительно молекулярного веса:
M = |
Kkp 1000 |
x |
, M = |
K |
Э 1000 x |
||
|
|
|
|
|
t y . |
||
t |
kp |
y |
|
|
|||
|
|
|
|
||||
|
|
|
|
|
|
кип |
|
В технике используется для приготовления низкозамерзающих жидкостей:
∆ t = K |
1000 x |
|
|
; |
|
M y |
||
30 %-й раствор СaCl2 замерзает при температуре –55 °С; 66,7 %-й раствор этиленгликоля замерзает при –75 °С.
Осмотическое давление
При соприкосновении чистого растворителя с раствором происходит выравнивание концентраций во всем объеме. Это процесс диффузии. Диффузию называют здесь осмосом.
На границе С1 è Ñî поставим пленку полупроницаемую:
1 |
1 |
|
о |
h |
о |
2 |
|
2 |
а |
|
б |
Са > |
Сб |
|
Vб |
|
|
Vа |
|
|
Процесс протекает до тех пор, пока возникшее в системе гидростатическое давление, равное разности уровней 1—1 и 2—
— 49 —

2, не будет уравновешено давлением молекул растворенного вещества, или осмотическим давлением.
Как установил Вант-Гофф, молекулы растворенного вещества ведут себя в растворе совершенно аналогично молекулам газов. Поэтому величина осмотического давления оказывается равной величине давления, которое оказало бы растворенное вещество, находясь в газообразном состоянии и занимая объем раствора.
Осмотическое давление может вычисляться по уравнению Клайперона — Менделеева:
n
Ðîñì = V RT,
ãäå n — число молей растворенного вещества; V — объем раствора;
R — универсальная газовая постоянная; Ò — абсолютная температура.
Отношение числа молей к объему раствора представляет со-
бой его молярную концентрацию:
n
Ñ = V .
Поэтому осмотическое давление можно вычислить по формуле (закон Вант-Гоффа):
Ðîñì = ÑRT.
Теория растворов
К концу прошлого столетия сформулировались две диаметрально противоположные точки зрения на природу растворов — физическая и химическая теории. Согласно физической теории растворы рассматриваются как смеси, возникающие в результате дробления растворяемого вещества в среде растворителя без непосредственного химического взаимодействия. Свойства зависят лишь от числа молекул вещества в данном объеме раствора, это подтверждается законом Рауля и Вант-Гоффа, эти законы действительны для идеальных растворов.
Химическая теория, выдвинутая Д.И. Менделеевым (1887), рассматривает процесс образования раствора из компонентов как
— 50 —
