
Химия учеб посрбие
.pdfхимическое взаимодействие. Растворы содержат ассоциации, образовавшиеся при взаимодействии молекул растворителя и растворенного вещества. Для водных растворов эти образования получили название гидратов, èëè сольватов (неводный). Гидратация и сольватация подтверждаются изменением энергии при образовании растворов. Современная теория растворов представляет собой синтез физической и химической теорий, но ее нельзя считать окончательно разработанной.
Растворы электролитов
Аррениус разработал теорию электролитической диссоциации, которая объяснила многие свойства электролита. Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Ê À ↔ Ê+ + À— — обратимый процесс
Процесс распада на ионы получил название электролити- ческой диссоциации. Молекулы электролита в среде с большой диэлектрической проницаемостью распадаются на ионы К+ и отрицательный А–. К проводникам II рода относятся ионы, электропроводность которых обусловлена наличием ионов К+ è À—. В этой теории исключалось химическое взаимодействие.
Причины диссоциации электролитов
К электролитам относятся вещества, в молекулах которых атомы связаны сильнополярной или ионной химической связью. По основным современным представлениям (главным образом труды Кистяковского и Каблукова) электролитическая диссоциация в растворе происходит в результате сложного физикохимического взаимодействия молекул электролита с полярными молекулами растворителя. Взаимодействие ионов с полярными молекулами растворителя называется сольватацией ионов. Это приводит к образованию ассоциаций между ионами и молекулами растворителя. Это можно записать так:
Ê+ . À– + õÍ2Î → Ê+ . (Í2Î)ê + À– . (Í2Î)a
тв. в-во жидкий |
гидратированные |
растворитель |
катионы и анионы |
— 51 —
Схематически:
+-
-+
+ - Na+ Cl- + -
-+
+-
+ |
- |
- |
+ |
+ - Na+ - + + - + Cl- + - |
|
- |
+ |
+ |
- |
Количество молекул Н2О называется координационным числом гидратации. Вследствие ослабления связи, вызванного действием полярных молекул растворителя, осуществляется диссоциация. Величина диэлектрической проницаемости растворителя имеет большое значение; чем больше эта величина, тем сильнее ослабляются связи между ионами электролита. Из закона Кулона:
|
|
F = |
e |
1 |
e 2 |
|
|
|
|
ε |
r 2 |
||
ãäå |
F |
— ñèëà; |
|
|
|
|
|
å1, å2 |
— заряды; |
|
|
|
|
|
r |
— расстояние между ионами; |
||||
|
ε |
— диэлектрическая проницаемость. |
||||
ε H2O = 80, значит, в Н2О сила взаимодействия между ионами ослабляется в 80 раз.
Растворы слабых электролитов
Сильные электролиты в растворе диссоциируют полностью, диссоциация слабых электролитов протекает обратимо, и уста-
— 52 —

навливается равновесие. Количественно оценивается диссоциация величинами: 1) степенью электролитической диссоциации
— α ; 2) изотоническим коэффициентом — i; 3) эквивалентной электропроводностью — λ ; 4) константой электролитической диссоциации — Êi.
Степень электролитической диссоциации λ — это отношение молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе. Она измеряется в долях единиц или в %. λ = 0 — диссоциация отсутствует; λ = 1, или 100 %, при полной диссоциации электролита. Это обратимый процесс — электролитическая диссоциация. Закон действия масс выявил внешние факторы, влияющие на состояние равновесия, приводящие к изменению λ . Степень диссоциации возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение λ = 1 в бесконечно разбавленном растворе. Повышение температуры будет смещать равновесие слева направо. То есть λ увеличивается с повышением температуры.
Изотонический коэффициент Вант-Гоффа i — это отношение суммы числа ионов непродиссоциированных молекул электролита к начальному числу молекул электролита. Если в растворителе находится N молекул электролита и степень диссоциации равна α , à
каждая молекула распалась на n ионов, то всего в растворе будет
i − 1
[1 + (n — 1)α ] . N, откуда i = 1 + (n — 1)α , α = n − 1 , по величи- не i вычисляют α . Давление пара, осмотическое давление и изме-
нение температуры кипения и замерзания растворов электролитов подчиняются тем же законам, но с введением i.
Законы: |
Неэлектролит |
Электролит |
|
|||||||||||||
Закон Рауля |
|
|
|
i = 1 |
|
|
|
|
i > 1 |
|
|
|
|
|||
Тонометрический |
∆ |
P = Ð 0 |
. N |
2 |
∆ |
P = iP 0 |
. N |
2 |
||||||||
|
∆ |
|
|
|
1 |
|
∆ |
|
|
|
i |
|
|
|
||
Криоскопический |
t |
криос |
= Ê . m |
t |
криос |
= iK |
m |
|
||||||||
|
∆ |
|
|
ê |
|
∆ |
|
|
|
k |
|
|
||||
Эбуллиоскопический |
t |
êèï |
=Ê |
. m |
|
t |
êèï |
= iK |
m |
|
||||||
|
|
|
|
ý |
|
|
|
|
|
ý |
|
|
|
|||
Осматический закон |
Pîñì = cRT |
|
Pîñì = icRT |
|
|
|||||||||||
Вант-Гоффа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
— 53 —
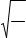
|
[K+][ A− |
] |
|
KK + A— = |
|
|
, |
[KA] |
|
||
|
|
|
|
где [KA] — концентрация г-ион/литр, моль/литр.
Чем больше Ê, тем лучше электролит распадается на ионы; Ê-const данного электролита при температуре t0 и, в отличие от α , не зависит от исходной молярной концентрации.
[Ê+] = [A—] = α . c,
ãäå ñ — исходная молярная концентрация раствора;
α— степень диссоциации слабого электролита.
|
|
[KA] = (1 — α |
) . c, откуда Ê = |
α2 |
ñ |
(1) |
|
|
|
|
α |
||||
|
|
|
1 − |
|
|
||
Это закон разведения или разбавления Оствальда; если α |
ìàëà |
||||||
|
|
K |
|
|
|
|
|
(1 — α |
≈ |
1), тогда α = C . |
|
|
|
|
(2) |
Из уравнения (2) видно, что с уменьшением концентрации электролита в растворе степень диссоциации электролита возрастает. Н2ÑÎ3 — пример ступенчатой диссоциации слабого электролита:
1) Í2ÑÎ3 ↔ |
Í+ + ÍÑÎ |
−3 Ê1 = |
[H + ][HCO−3 ] |
= 4,45 . 10-7 |
||||||||
|
H2 CO3 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
[H |
+ ][CO2− |
] |
|
||
2) HCO |
↔ |
H+ + CO 2 |
− |
K |
= |
|
|
3 |
|
= 4,7 . 10-11 |
||
3 |
|
|
− |
|
||||||||
|
|
3 |
|
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
[HCO3 ] |
|
|
|
|
Диссоциация Н2ÑÎ3 íà òðè èîíà Í+, CO 23− è ÍÑÎ −3 è âåñü
процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Растворы сильных электролитов
Сильные электролиты диссоциируют в растворах полностью. Для них следует отметить существование процесса дегидратации, когда воды не хватает для полной гидратации. Вода начинает перераспределяться между гидратированными ионами таким образом, чтобы было энергетически «выгоднее». Это влечет за собой усиле-
— 54 —
ние взаимодействия между ионами. В растворе происходит процесс, который приводит к кажущемуся уменьшению степени диссоциации сильного электролита. Для количественного описания свойств растворов сильных электролитов целесообразно ввести новую функцию — активность (α ), которая заменяет в уравнении концентрацию: α = γ . ñ, ãäå ñ — концентрация молярная, α — активность растворенного вещества в растворе, отвечающая указанной концентрации, γ — коэффициент активности.
Для разбавленных растворов γ = 1 è α = ñ. Коэффициент активности можно понимать как меру отклонения от идеальности в поведении вещества в реальном растворе.
Характеристика различных электролитов
Кислоты и основания.
1. Кислотой называются соединения, диссоциирующие в водном растворе с образованием гидратированных водородных ионов и кислотного остатка:
ÍÀ + õÍ2Î ↔ Í3Î+ + À—(Í2Î)à, ãäå Í3Î+ — гидроксоний-ион.
В кислой среде синий лакмус переходит в красную окраску. 2. Основаниями (МеОН) называются соединения, диссоциирующие в водном растворе с образованием отрицательных гид-
роксид-ионов (ОН—):
ÌåÎÍ + nÍ |
Î ↔ |
Ìå + (Í |
Î) |
ê |
+ ÎÍ— + (n — K)H |
O. |
||||||||
|
|
|
|
|
|
2 |
|
2 |
|
|
|
2 |
|
|
В щелочной среде (ОН—) красная окраска лакмуса перехо- |
||||||||||||||
дит в синюю. |
|
= 4,45 . 10-7 |
|
|
|
= 4,7.10-11 |
|
|
||||||
Í |
ÑÎ Ê |
Ê |
|
|
||||||||||
2 |
|
|
3 |
|
1 |
|
|
. 10-3 |
|
|
2 |
= 6,34 . 10-8, Ê |
= 1,26 . 10-12 |
|
Í |
ÐÎ |
Ê = 7,11 |
Ê |
|||||||||||
3 |
|
|
4 |
|
1 |
|
|
|
|
|
2 |
3 |
. 10-5 |
|
ÑÍ |
ÑÎÎÍ Ê = 1,7 . 10-5 |
NH OH K = 1,79 |
|
|||||||||||
C |
3 |
|
NH |
Ê = 3,82 . 10-10 |
|
|
|
4 |
|
|
||||
H |
|
|
|
|
|
|
||||||||
6 |
|
5 |
|
|
2 |
|
|
|
|
|
|
|
|
|
Ñîëè. С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
Õêèñë + Óîñí = ñîëü + Í2Î.
В зависимости от Õ è Ó получаются следующие типы солей, которые в водном растворе диссоциируют по схемам:
Õ > Ó — кислые соли:
— 55 —

|
|
2Í2SO4 + Mg(OH)2 → |
Mg(HSO4)2 + 2H2O |
|
|
||||||||||||||
|
|
Mg(HSO4)2 ↔ |
|
Mg+2 + 2HSÎ −4 |
|
|
|
|
|
|
|
|
|||||||
Õ = Ó — средние соли: |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
H2SO4 + Mg(OH)2 → MgSO4 +2H2O |
|
|
|
|
|||||||||||||
|
|
MgSO |
4 |
↔ |
Mg+2 +SÎ 2− |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
||
Õ < Ó — основные соли: |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
H2SO4 + MgOH → (MgOH)SO4 + 2H2O |
|
|
|||||||||||||||
|
|
Mg(OH) |
SO |
4 |
↔ |
2MgOH+ +SÎ |
2− |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
2 |
|
|
|
|
4 |
|
|
|
|
|
|
|
||
Соли относятся к сильным электролитам. |
|
|
|
|
|||||||||||||||
|
|
|
|
|
Ионно-обменные |
реакции |
|
|
|
|
|
|
|||||||
Ê1À1 + Ê2À2 ↔ |
Ê1À2 |
+ Ê2À1 |
K = |
[К1 A2 ][K2 A1 ] |
|||||||||||||||
[K1 A1 ][K2 A2 ] |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[K |
+ |
][ A− |
] |
|
|
Ê À ↔ |
Ê + |
|
+ À − |
|
|
|
Ê |
|
= |
1 |
1 |
|
|
||||||
|
|
|
|
|
[K1 A1 ] |
|
|
||||||||||||
1 |
1 |
1 |
|
|
|
1 |
|
|
|
11 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[K |
+ |
][ A− |
] |
|
|
K A ↔ |
K + |
+ A − |
|
|
|
K |
|
= |
|
2 |
2 |
|
|
||||||
|
|
|
|
[K2 A2 ] |
|
|
|||||||||||||
2 |
2 |
2 |
|
|
|
2 |
|
|
|
22 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[K |
+ |
][ A− |
] |
|
|
K A ↔ |
K + |
+ A − |
|
|
|
K |
|
= |
1 |
2 |
|
|
|||||||
|
|
|
|
[K1 A2 ] |
|
|
|||||||||||||
1 |
2 |
1 |
|
|
|
2 |
|
|
|
12 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[K |
+ |
][ A− |
] |
|
|
K A ↔ |
K + |
+ A − |
|
|
|
K |
|
= |
|
2 |
1 |
|
|
||||||
|
|
|
|
[K2 A]1 |
|
|
|||||||||||||
2 |
1 |
2 |
|
|
|
1 |
|
|
|
21 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
K11 K22
K = K12 K21 K > 1 — слева направо; К < 1 — справо нале-
во смещено равновесие.
Равновесие в ионных обменных реакциях в растворах смещается в сторону реакций образования наименее диссоциированных соединений. Направление реакций ионного обмена определяется следующим правилом: ионные реакции протекают в сто-
— 56 —
рону образования осадков, газов, слабых электролитов, комплексных ионов:
1. Образование осадка: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Ag+ + NÎ 3− + Na+ + Cl = AgCl↓ |
+ Na+ + NÎ3− ; |
|
|
|
|
||||||||||||||||||||||||||
Ag+ + Cl— = AgCl↓ — ионное уравнение. |
|
|
|
|
|
|
|||||||||||||||||||||||||
2. Образование газов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
2Na+ + S-2 + 2H+ + SÎ 2− = H S + 2Na+ + SÎ2 − |
; |
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
2 |
|
|
|
|
|
4 |
|
|
|
|
|
||
2H+ + S-2 = H S — ионное уравнение. |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Образование слабого электролита: |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Na+ + OH + H+ + Cl = H2O + Na+ + Cl |
|
|
|
|
|
|
|||||||||||||||||||||||||
H+ + OH = H |
|
O вернее Н |
|
Î+ |
+ ÎÍ = 2Í |
2 |
Î |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
NÍ +4 + Cl + K+ + OH = NH4OH + K+ + Cl |
|
|
|
||||||||||||||||||||||||||||
NÍ |
+ |
|
|
+OH |
= NH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
4 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2CH |
3 |
COO + 2Na+ + 2H+ + SÎ 2− = |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
= 2CH |
3 |
COOH + 2Na+ + SÎ |
− 2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
||
CH |
COO |
+ H+ = CH |
COOH |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Образование комплексного иона: |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O |
|
|
|
|
|
|
|||||||||||||||||||||||||
Cu+2 + SO |
− 2 |
+ 4NH |
4 |
OH = [Cu(NH |
) |
|
]+2 + SO − 2 |
+ 4H |
2 |
O |
|||||||||||||||||||||
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
4 |
|
|
|
|
4 |
|
|
|||
Cu+2 + 4NH |
4 |
OH = [Cu(NH |
) |
4 |
]+2 + 4H |
2 |
O |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
[PbCl ]2- ↔ |
Pb+2 + 4Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
2 |
|
- 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
Pb |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
K H = |
|
|
|
|
|
|
|
|
— константа нестойкости комплекс- |
||||||||||||||||||||||
|
|
|
|
[PbCl4 ]− |
2 |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
íîãî èîíà. |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Произведение растворимости
Абсолютно нерастворимых веществ нет!
— 57 —

K+A ↔ |
K+ + A K = |
[K+ ][ A− |
] |
[K+][A] = K[K+A] |
[KA] |
|
|||
|
|
|
↓ |
|
|
|
|
|
|
|
|
|
|
константа равновесия |
При постоянной температуре К и [K+A] будут иметь постоянное значение, значит, и [K+] . [A] = ПР будет иметь постоянное значение, называемое произведением растворимости. Таким образом, произведение концентрации ионов в насыщенном растворе малорастворимого сильного электролита при данной температуре есть величина постоянная, называемая произведением растворимости. Правило: если произведение концентрации превышает величину ПР, то выпадает осадок. Если произведение концентрации ионов не достигает величины ПР, то осадок образоваться не может: AgCl ПР = [Ag+] . [Cl] = 1,73 . 10-10; раствори-
мость (моль/л) =  1,73 10− 10 = 1,32 . 10-5 концентрация (г-ион/
1,73 10− 10 = 1,32 . 10-5 концентрация (г-ион/
л), концентрация катиона 1,32 . 10-5, аниона 1,32 . 10-5; CaSO4 — ÏÐ = 3,72 . 10-5, растворимость = 6,1 . 10-2, концентрация ионов К = 6,1 . 10-2 и аниона 6,1 . 10-2.
Электролитическая диссоциация воды
Электролитическая диссоциация воды — незначительная электропроводность, наличие ионов. Вода характеризуется проводимостью. Диссоциация воды происходит в две стадии:
I. H2O ↔ H+ + OH (I стадия эндотермична);
II. H+ + H2O ↔ H3O+ — гидроксоний-ион (II стадия сильно экзотермична).
Уравнение электролитической диссоциации воды:
2Í2Î → Í3Î+ + ÎÍ.
Ïðè 22 °Ñ α = 1,80 . 10-9, то есть из 555 000 000 молекул Н2О диссоциирует одна молекула.
Í2О — очень слабый электролит. Согласно закону действия масс:
[H3O+] . [OH] = K[H2O]2
[H2O] — const, то окончательно [H3O]+ . [OH—] = KH2O; К — константа электролитической диссоциации Н2Î; ÊÍ2O — ионное произведение воды.
— 58 —

Водородный показатель
Реакция среды зависит от концентрации [H+] è [OH]. Åñëè [H3O+] = [OH], то реакция среды нейтральная. Н2О — амфотерное вещество.
По значению концентраций этих ионов охарактеризовывают реакцию среды:
ÊÍ2Î = 0,5702 . 10-14, ïðè 18 °Ñ; [H+] =  0,57 10− 14 = 0,755 . 10-7 ã-èîí/ë.
0,57 10− 14 = 0,755 . 10-7 ã-èîí/ë.
Чтобы избавиться от (-), предложено пользоваться отрицательным значением логарифма величины [H+], названного водородным показателем: рН = –lg[H+], точнее = -lgaH+
[H+] = 10-pH, pH = –lg(0,755 . 10-7) = 7,122
[H+] = 10-7ã . èîí/ë |
ðÍ = 7 |
|
Í |
Î ïðè 18°Ñ |
|
|
|
2 |
|
0 — 6 — |
7 |
— |
8 — 14 |
|
кислая |
нейтральная |
|
щелочная |
|
Индикаторы изменяют окраску в зависимости от [H+] èëè [OH] (кислоты или основания).
На практике принимают КÍ2Î = 10–14, ïðè 22 °Ñ;
нейтральная среда [H+] = [OH] = 10-7 г-ион/л рН = 7; кислая среда [H+] > [OH] > 10-7 г-ион/л рН < 7; щелочная среда [H+] < [OH] < 10-7 ã-èîí/ë ðÍ > 7.
Характеристика индикаторов
Характеристика |
Значение PH, |
Окраска |
|
|
|
|
Окраска |
||
область перехода |
при низкой |
|
|
|
при высокой |
||||
индикатора |
|
|
|
||||||
окраски |
границе |
|
|
|
|
границе |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Метилоранж |
3,1—4,1 |
красна< |
|
|
|
|
желта< |
||
(основной) |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лакмус |
6—8 |
красна< |
|
|
|
|
син<< |
||
(кислотный) |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Фенолфталеин |
8,3—9,8 |
бесцветна< |
|
|
|
малинова< |
|||
(кислотный) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тимолфталеин |
9,8—10,5 |
бесцветна< |
|
|
|
син<< |
|||
(кислотный) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HJnd ↔ H+ + Jnd |
K HJnd |
= |
[H |
+ |
][ Jnd |
] |
|||
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
[HJnd ] |
|
||||
|
|
|
|
[Jnd |
+ |
|
- |
||
JndOH ↔ Jnd+ + OH |
K JndOH |
= |
|
][ OH ] |
|||||
|
— 59 — |
|
|
[JndOH ] |
|||||
|
|
|
|
|
|
|
|
||

окраска I окраска II
Гидролиз солей
Гидролиз солей — взаимодействие ионов соли с водой, приводящее к образованию слабого электролита (кислоты, основания, кислого или основного иона).
|
|
Кислоты |
||
|
|
сильные |
слабые |
|
Основания |
сильные |
I. NaCl, KNO3 |
II. Na2CO3, K2S |
|
слабые |
III. ZnCl2, Al(NO3)3 |
IV. CH3COONH4, Al2S3 |
||
|
||||
Ñîëè I òèïà гидролизу не подвергаются, так как при взаимодействии с Н2О не могут быть получены слабые электролиты.
Гидролиз солей II типа на примере Na2CO3:
I ступень: |
2Na+ + ÑÎ − 2 |
+ Í Î ↔ Na+ |
+ HCO −3 + Na+ + OH |
|||
|
3 |
|
2 |
|
|
|
|
CO − 2 + H O ↔ |
HCO − |
+ OH |
|
||
|
3 |
|
2 |
3 |
|
|
II ступень: |
Na+ + HCO − |
+ H O ↔ |
H CO + Na+ + OH |
|||
|
|
|
3 |
2 |
2 |
3 |
|
HCO − |
+ H O ↔ |
H CO + OH |
|||
|
|
|
3 |
2 |
2 |
3 |
Накапливается ОН рН > 7. I ступень выражена сильнее. |
||||||
Гидролиз солей III типа на примере ZnCl2: |
||||||
I ступень: |
Zn+2Cl − |
|
+ H O ↔ ZnOH+ + Cl + H+ + Cl |
|||
|
2 |
|
2 |
|
|
|
|
|
|
Zn+2 + H O ↔ |
ZnOH+ + H+ |
||
|
|
|
|
2 |
|
|
II ступень: |
ZnOH+ + Cl + H O ↔ Zn(OH) + H+ + Cl |
|||||
|
ZnOH+ + H2O ↔ |
2 |
2 |
|
||
|
Zn(OH)2 + H+— накапливаются |
|||||
èîíû [H+] pH < 7 |
|
|
|
|
|
|
Гидролиз солей IV типа на примере СН3ÑÎÎNH4: |
||||||
NH + |
+ CH COO |
+ H O ↔ NH OH + CH COOH |
||||
4 |
3 |
|
2 |
4 |
|
3 |
|
|
|
|
|
(легко гидролизуются) |
|
NH OH – Ê = 1,79 . 10-5; ÑÍ ÑÎÎÍ – Ê |
= 1,76 . 10-5 |
|||||
4 |
ýë.äèñ. |
|
|
3 |
ýë.äèñ. |
|
— 60 —
