
Химия учеб посрбие
.pdfкоторых имеются одинарные, двойные или тройные связи между атомами углерода.
2.Карбоциклические органические соединения, содержащие замкнутые в кольцо цепи атомов углерода. Эти соединения подразделяются на соединения ароматического ряда, характеризующиеся наличием в молекулах бензольного ароматического ядра,
èациклические соединения (насыщенные и ненасыщенные).
3.Гетероциклические.
Насыщенные. Общая формула СnH2n+2. Например, метан, у которого на σ -связь приходится один электрон, а остальные электроны затрачиваются на образование σ -связи с атомами водорода.
CH3 |
CH3 |
| |
| |
ÑÍ3—ÑÍ—ÑÍ2—ÑÍ3 |
ÑÍ2—Ñ—ÑÍ3 |
|
| |
|
CH3 |
2-метилбутан 2,2-диметилпропан
Это бесцветные вещества, нерастворимые в воде. Углеводороды, содержащие от 1 до 4 атомов углерода, — это газы, от 5 до 15 — жидкости, от 16 и далее — твердые вещества.
Изомеры с нормальной цепью кипят при более высокой температуре, чем изомеры с разветвленной цепью. Химические реакции насыщенных углеводородов осуществляются путем расщепления σ -связи С—Н и разрыва углеродных атомов. Это нуклеофильные реакции замещения при насыщении атома углерода или радикальные реакции замещения. Промышленное значение имеют С20 — Ñ25, для них характерна реакция окисления для получения жирных кислот с различной длиной цепи, которые используются для производства мыл, поверхностно-активных веществ, смазочных материалов, синтетических смол или олиф, лаков и эмалей.
Метан является главной составной частью природного газа (60—99 %), он используется как топливо и восстановитель.
Ацетилен также является одним из важнейших углеводородов, которые используются для промышленных целей.
В качестве газообразного топлива применяется пропан и бутан.
— 121 —

Этиленовые. Это алкены или олефины. Общая формула СnH2n. В их цепи содержится двойная связь. Их изомерия зависит от последовательности порядка соединения атомов С и от положения двойной связи в цепи:
ÑÍ3—ÑÍ2—ÑÍ=ÑÍ2 |
ÑÍ3—ÑÍ=ÑÍ—ÑÍ3 |
1-бутен |
2-бутен |
ÑÍ3—Ñ=ÑÍ2 |
ÑÍ3—ÑÍ2—Ñ=ÑÍ2 |
| |
| |
CH3 |
CH3 |
2-метилпропен-1 |
изобутелен 2-метил-1-бутен |
Для них характерны реакции присоединения и полимеризации.
В этиленовых соединениях вследствие перекрывания ð-элект- ронных облаков π -связи в плоскости, перпендикулярной осям облаков, создается жесткая конфигурация молекул. В силу этого у атомов углерода, связанных двойной связью, свободного вращения нет. Двойные связи обуславливают наличие у молекул нового вида изомерии — геометрической цис- и транс-изомерии:
– ÑÍ2 |
Í |
|
ÑÍ3 |
Í |
\ |
/ |
|
\ |
/ |
Ñ=Ñ |
|
Ñ=Ñ |
||
/ |
\ |
|
/ |
\ |
ÑÍ3 |
ÑÍ2 |
– |
– ÑÍ2 |
ÑÍ2 – |
Транс-изомер |
|
цис-изомер |
||
гуттаперча |
n |
Натуральный n |
||
|
|
|
каучук |
|
Натуральный каучук эластичен при нормальной температуре, а гуттаперча — твердое вещество.
Геометрические изомеры различаются и по дипольным моментам.
Алкены — это бесцветные вещества. Три первых представителя алкенов — газы, начиная с С5 и более — жидкости, высшие твердые вещества.
Алкены способны реагировать по радикальному и ионному
механизму: |
|
|
/ \σ + σ – |
|
\ / |
\ / |
\ |
||
Ñ=Ñ → |
Ñ—Ñ |
Ñ=Ñ → |
Ñ = Ñ |
|
/ \ |
/ \ |
/ |
\ |
/ |
— 122 —

Качественная реакция на двойную связь: СН2=ÑÍ2 + Br2=CH2—CH2
| |
| |
Br |
Br |
Правило Марковникова: |
|
R—CH = CH2 + HX → R—CHX—CH3
Такой механизм обусловлен смещением электронов π -ñâÿ-
зи под влиянием электродонорной группы: +σ –σ
R→ CH = CH2 + HÑl
|
R = CH3, C2H5 è ò. ä. |
||
+σ |
-σ |
|
|
ÑH3→ CH = CH2 + HCl → |
CH3—CHCl —CH3 |
||
|
|
|
2-хлорпропан |
+σ |
-σ |
катализ |
|
ÑÍ3—ÑÍ = ÑÍ2 + ÍÎÍ → |
ÑÍ3—ÑÍÎÍ—ÑÍ3 |
||
|
|
|
изопропиловый спирт |
Эти реакции используются в производстве пластических масс, химических волокон, синтетических каучуков, моющих средств.
Алкены легко подвергаются окислению перманганатом калия в воде и щелочных растворах.
Реакция Вернера:
3CH2= CH2 + 2KMnO4 + 4H2O = 3CH2—CH2 + 2MnO2 + 2KOH
| |
| |
OH |
OH |
|
этиленгликоль |
Реакция эпоксидирования: |
|
2R—CH=CH—R1 + O2 |
→ 2R—CH—CH—R1 |
|
\ / |
|
Î |
Окись этилена является сырьем для химических волокон, эмульгаторов для минеральных масел, пластификаторов, растворителей для лаков. Следует отметить высокую реакционную спо-
— 123 —
1)ÑÍ≡ ÑÍ — ýòèí.
2)ÑÍ≡ Ñ—ÑÍ3 — пропин, СН≡ Ñ—ÑÍ2—ÑÍ3 — бутин, СН3— Ñ≡ Ñ—ÑÍ3 — 2-бутин. Присоединение Н2О, спиртов и кислот к ацетиленовым углеводородам осуществляется в присутствии катализаторов (соли Hg и Cu).
3)Реакция Кучерова:
H2SO4
ÑÍ≡ ÑÍ + ÍÎÍ → ÑÍ2=ÑÍÎÍ
HgSO4 виниловый спирт
— 124 —

|
|
|
|
Í |
ÑÍ2—Ñ—Í → |
/ |
|||
ÑÍ3—С изомеризация в уксусный альдегид |
||||
|
|
| |
\\ |
|
|
||||
|
|
ÎÍ |
Î |
|
|
|
|
|
|
Реакция Кучерова используется в органической химии для получения уксусного альдегида, этилового спирта, уксусной кислоты, этилацетата.
4)
ÑÍ3—Ñ≡ ÑÍ + Í2Î → ÑÍ3—Ñ—ÑÍ3
HgSO4 || O
реакция винилирования кетон-ацетон
5) Реакция Фаворского-Шостаковского:
ÊÎÍ, Ò = 150—160°
ÑÍ≡ ÑÍ + Ñ2Í5ÎÍ → |
ÑÍ2=Ñ͗ΗÑ2Í5 |
Ð = 15 àòì |
винилэтиловый эфир |
К полимеризации способны эфиры, специальные клеи, полимеры, пленкообразующие вещества и медицинские препа-
ðàòû. |
|
|
6) |
Î |
Î |
|
// |
// |
|
ÑÍ≡ ÑÍ + ÑÍ3—Ñ → |
ÑÍ2=Ñ͗ΗїÑÍ3 |
|
\ |
винилацетат |
|
ÎÍ |
|
CuCl2
ÑÍ≡ ÑÍ + ÑÍ2=ÑÍ2 → ÑÍ2=ÑÍ—Ñ≡ ÑÍ + Í2
NH4Cl винилацетилен
Взаимодействие π -электронов двойной и тройной связи в молекулах обуславливает высокую реакционную способность мономера.
7) ÑÍ2=ÑÍ—Ñ≡ ÑÍ + HCl → CH2=CH—C=CH2 — äëÿ ñèí-
| |
тетического |
Cl |
каучука (СК) |
хлоропрен |
|
— 125 —
|
катализ |
ÑÍ≡ ÑÍ + Í—Ñ≡ N → CH2=CH—C≡ N — äëÿ ÑÊ |
|
синильная |
акрилонитрил |
кислота |
|
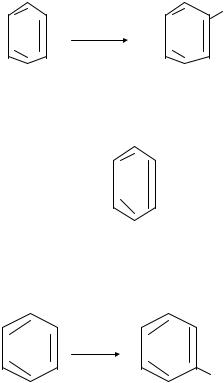
Бензол и ароматические соединения
В 1865 г. А. Кекуле была предложена структурная формула для бензола (С6Í6) — плоский шестиугольник, têèï = 80,1°, têð = 5,5 °С. Ядро бензола весьма устойчиво, поэтому ненасыщенные соединения трудно окисляются. Вступают в реакции замещения, не полимеризуются, только в особых условиях вступают в реакцию присоединения.
Двойная связь имеет длину 1,32 А°, ординарная 1,54 А°, но в бензоле все углерод-углеродные связи равноценны, а длина каждой из них равна 1,40 А°. Все атомы углерода связаны s-связями, находящимися в одной плоскости, шесть σ -электронов распределены симметрично, причем каждый из них находится под прямым углом к плоскости бензольного ядра с sp2-гибридизацией орбиталей:
Н
|
C
H C C H
C C
H H
C
|
H
Общая формула ароматических соединений — СnH2n—6
Гомологами бензола являются толуол, этилбензол, ксилолы. С6Í5 — радикал фенил, у толуола радикал толуил СН3—Ñ6Í4. Вступление новых заместителей в бензольное ядро направ-
ляется уже находящимися в нем заместителями.
К заместителям первого рода относятся нуклеофилы: OH–, OR, NH−2, NR2, CH• 3, F–, Cl–, Br–, J–. Они направ-
ляют заместители в орто- и пара-положения.
— 126 —
К заместителям второго рода относятся электрофилы — электроноакцепторы:
Î |
Î |
// |
// |
—NO2, —SO3H, —C, |
—Ñ, —Ñ≡ N |
\ |
\ |
Í |
ÎÍ |
Они направляют заместители в м-положение.
ОН |
OH |
| |
| |
o |
NO2 |
HONO2 |
+ H2O |
м |
|
n |
о-нитрофенол |
и еще возможно
ОН
|
|
| |
|
NO2 |
|
n-нитрофенол |
NO2 |
NO2 |
| |
| |
Br2 |
+ HBr |
|
Br |
|
м-бромнитробензол |
— 127 —

Галогенопроизводные углеводороды
К галогенопроизводным углеводородам относятся органи- ческие соединения, у которых атом Н замещен на F, Cl, Br, J.
ÑÍ4 |
CH3Cl |
CH2=CH2 |
метан |
хлористый метил |
этилен |
|
хлорметан |
|
.. |
|
|
ÑÍ2=ÑÍ—Cl: |
|
C6H5Cl |
.. |
|
хлорбензол |
хлорэтен |
|
|
|
хлористый фенил |
|
хлористый винил |
|
|
Галогенопроизводные углеводороды — это бесцветные вещества, нерастворимые в Н2О, легко растворимые в органических растворителях, обладающие пониженной горючестью (а некоторые — негорючестью).
300—600° |
|
|
|
CH4 + Cl2 → |
CH3Cl |
ÑÍ2Cl2 + Cl2 → |
CHCl3 + HCl |
ñâåò |
хлороформ-растворитель |
||
CH3Cl + Cl2→ |
CH2Cl2 + HCl |
CHCl3 + Cl2 → CH4 + HÑl |
|
|
хлористый метилен |
четырех-хлористый |
|
|
негорючий |
|
углерод негорючий |
|
|
растворитель для смол, |
|
|
|
|
жиров, масел |
Хлорэтан С2Í5Cl используется в производстве этилсвинца Pb(C2H5), является антидетонатором моторного топлива.
Полигалогенопроизводные — фреоны (СF2Cl2) — используются в холодильной промышленности, têèï= –30 °Ñ.
+ 3Сl2 → C6H6Cl6 |
+ Cl2 → C6H5Cl |
гексахлорцикло- |
хлорбензол |
гексан, |
и т.д. до С6Cl6 |
инсектицид |
|
— 128 —
Спирты и фенолы
Гидролиз галогенопроизводных насыщенных углеводородов:
|
|
NaOH |
|
|
|
AlKHal + H2O ↔ |
AlKOH + HHAl |
||||
|
+σ |
|
-σ |
||
K+ + :OH– + C |
H |
Cl → |
C |
H |
OH + K+ + Cl–, |
2 |
5 |
|
2 |
5 |
|
ÎÍ– — более сильный нуклеофильный агент, чем Н2О. Спирты являются продуктами замещения Н+ на гидроксил
âсоответствующих углеводородах.
1.Метиловый спирт СН3ОН получают каталитической гидрогенизацией окиси углерода в присутствии катализатора (Cr2O3 + ZnO):
CO +2H2 → CH3OH
2. Этиловый спирт получают следующим образом:
Í2Ñ=ÑÍ2 + Í2Î → ÑÍ3– ÑÍ2ÎÍ
этилен Н3ÐÎ4
или брожением сахаристых веществ:
Î2 Ñ6Í12Î6 = 2Ñ2Í5ÎÍ + 2ÑÎ2
или гидролизом древесины в особых условиях.
Изомерия спиртов определяется положением ОН– на первичном, вторичном или третичном углеродном атоме:
|
ÑÍ3 |
|
\ |
ÑÍ3—ÑÍ—ÑÍ2—ÑÍ3 |
ÑÍ—ÑÍ2ÎÍ |
| |
/ |
ÎÍ |
ÑÍ3 |
вторичный бутил-спирт |
изобутиловый |
|
первичный спирт |
CH3 |
|
| |
|
ÑÍ—ÑH2—ÑÍ3 |
ÑÍ3—ÑÍ2—ÑÍ2—ÑÍ2—ÎÍ |
| |
н.бутиловый спирт первичный |
ÎÍ |
|
третичный |
|
бутиловый |
|
спирт |
|
— 129 —
Введение ОН сильно влияет на физические и химические свойства, например, повышается температура кипения, и т. д. Высшие спирты являются твердыми веществами.
Для спиртов характерна ассоциация за счет водородных свя-
çåé:
Ñ2Í5 |
Ñ2Í5 |
Ñ2Í5 |
|
\-σ |
+σ |
\-σ +σ |
\-σ +σ |
ÎÍ.................... |
ÎÍ................... |
|
ÎÍ |
В этом причина их слабой летучести. Водородные связи сохраняются и при кристаллизации спиртов.
2Ñ2Í5ÎÍ + 2Na = 2C2H5ONa + H2 — для спиртов характерна реакция этерификации.
- +
Ñ2Í5ОNa + HOH → C2H5OH + Na+ + OH– O O
|
|
|
|| |
|| |
|
R |
OH + Í |
O—C—R1 ↔ |
R—O—C—R1 + H |
O |
|
|
|
|
|
2 |
|
спирт |
кислота |
эфир сложный |
|
||
|
|
|
|
|
|
ÑÍ3–ÑÍ2– |
ÎÍ+Í |
ΖÑÍ2—ÑÍ3 → |
ÑÍ3–ÑÍ2–ΖÑÍ2–ÑÍ3 +Í2Î |
||
|
|
|
|
простой эфир диэтиловый |
|
ÑÍ2ÎÍ–ÑÍ=ÑÍ2 — аллиловый спирт, используется в производстве пластмасс.
Спирты делятся на алкоголи — одноатомные; гликоли — двухатомные; глицерины — трехатомные и многоатомные спирты (высококипящие жидкости, смешивающиеся с Н2Î).
ÑÍ2—ОН — пропантриол, используется для получения
| |
нитроглицерина в парфюмерной и пищевой |
CH—OH |
промышленности |
| |
|
CH2—OH |
|
ÑÍ2—ОН — этандиол (гликоль), используется | для получения лавсана
ÑH2—OH
Гликоли используются в качестве антифризов. Растворы гликолей замерзают при очень низкой температуре.
— 130 —
