
biohimiyaverstka
.pdfОколо 40 % всех мышечных белков находится в миофибриллах, около 30 % – в саркоплазме, около 14 % – в митохондриях, около 15 % – в сарколемме, остальные в ядрах и других клеточных органеллах.
При обработке измельченных мышц водой в раствор переходят саркоплазматические белки миогеновой группы (в основном ферменты, в частности, ряд ферментов гликолиза) и миоальбумин – запасной белок, содержание которого с возрастом постепенно снижается. В саркоплазме мышечных волокон находится окрашенный в красный цвет белок миоглобин – хромопротеид, по структуре и функциям сходный с гемоглобином крови и обладающий способностью связывать кислород в несколько большей степени, чем гемоглобин.
Если после экстракции водой мышечную ткань обработать слабым солевым раствором (0,1 М раствором КСl), в него переходят белки – глобулины. В них также имеются ферменты и запасные белки, способные при тренировке преобразовываться в сократительные белки миофибрилл.
Миофибриллярные белки извлекаются из измельченных мышц более концентрированными солевыми растворами (0,6–1 М раствором КСl или NaCl). Более половины миофибриллярных белков составляет миозин, около четверти – актин, остальное – тропомиозин, тропонин, - и-актинины, ферменты креатинфосфокиназа, дезаминаза адениловой кислоты и некоторые другие.
Щелочными растворами из мышечной ткани можно извлечь ядерные белки – нуклеопротеиды.
Особые методы применяются для извлечения митохондриальных белков, состав которых многообразен: структурные белки, в основном липопротеиды, а также белкиферменты цикла трикарбоновых кислот, -окисления жирных кислот, ферменты дыхательной цепи и белковые сопрягающие факторы, участвующие в процессах окислительного фосфорилирования.
После обработки измельченных мышц различными растворителями остается нерастворимый остаток белков
221
мышечной стромы. Основную массу ее составляют коллаген и эластин сарколеммы и миостромины, входящие в состав мембран SR и связанные с Z-мембранами миофибрилл. Мышечная строма обладает высокой эластичностью и играет важную роль в расслаблении мышцы.
Из водорастворимых азотистых соединений наиболее важны для работы мышц АТФ, содержащаяся в количестве 0,25–0,4 %, и креатинфосфат (КрФ), количество которого колеблется в пределах 0,4–1 % и повышается при тренировке. В меньших количествах имеются и другие нуклеозидфосфаты. АТФ и КрФ – энергетические источники мышечного сокращения. Продукты их распада – АДФ, АМФ, креатин – оказывают регулирующее действие на обмен веществ в мышцах.
В скелетных мышцах человека содержится около 0,1– 0,3 % дипептида карнозина, принимающего участие в ферментативном переносе фосфатных остатков, оказывающего стимулирующее влияние на передачу импульсов с нерва на мышцу, участвующего в восстановлении работоспособности утомленных мышц. В мышцах содержится также карнитин, участвующий в переносе через клеточные мембраны жирных кислот – важных энергетических источников. Из других азотистых соединений следует упомянуть аминокислоты (главным образом глютаминовую), пуриновые основания, мочевину и аммиак. Скелетные мышцы содержат около 1,5 % фосфатидов, играющих большую роль в процессах тканевого дыхания. В зависимости от особенностей функционирования мышц количество фосфатидов в них может меняться.
К важнейшим безазотистым соединениям мышц относятся гликоген и продукты его обмена, жиры, холестерин, кетоновые тела, минеральные соли. Гликоген может находиться в свободном и связанном с белками состоянии. Количество его колеблется в зависимости от пищевого рациона и степени тренированности в пределах от 0,2 до 3 %. При тренировке увеличивается главным образом количество свободного гликогена.
222
Протоплазматический (связанный с белками) жир в мышечных волокнах составляет примерно 1 %. Запасные жиры могут накапливаться в мышцах, специфически тренированных на выносливость к длительной работе. В мембранах мышечного волокна может содержаться до 0,2 % холестерина.
Из минеральных веществ в мышцах имеются главным образом соли К+, Na+, Mg2+, Ca2+, Сl-, Н2РO4-, НРО42 -» (1– 1,5 % от веса мышцы). Минеральные ионы играют важную роль в регуляции биохимических процессов в сокращающихся мышцах (табл. 12).
Т а б л и ц а 1 2
Химический состав мышц млекопитающих |
||
(по В.Л. Збарскому) |
|
|
Вещество или неорганические ионы |
Содержание |
|
в мышцах, % |
||
|
||
|
|
|
Вода |
72–80 |
|
|
|
|
Белки |
16,3–20,9 |
|
|
|
|
Гликоген |
0,3–2 |
|
|
|
|
Фосфатиды |
0,4–1,0 |
|
|
|
|
Холестерин |
0,03–0,23 |
|
|
|
|
Креатин и креатинфосфат |
0,2–0,55 |
|
|
|
|
Азотсодержащие вещества (креатинин) |
0,383–0,535 |
|
|
|
|
Свободные аминокислоты |
0,1–0,7 |
|
|
|
|
Мочевина |
0,002–0,2 |
|
|
|
|
Молочная кислота |
0,01–0,2 |
|
|
|
|
К+ |
0,32 |
|
|
|
|
Na+ |
0,08 |
|
|
|
|
Са2+ |
0,007 |
|
|
|
|
Mg2+ |
0,02 |
|
|
|
|
Fe2+ |
0,026 |
|
|
|
|
Cl- |
0,02 |
|
|
|
|
Строение мышц. При изучении скелетных мышц с помощью светового микроскопа в них обнаружили поперечную исчерченность, отсюда их название – поперечнополосатые.
223

В скелетной мышце выделяют сухожильную головку, которой мышца начинается на кости, мышечное брюшко, состоящее из волокон, и сухожильный хвост, которым мышца заканчивается на другой кости (рис. 42).
|
Мышечные волокна |
Сухожилие |
Сухожилие |
Рис. 42. Мышца
Мышечное волокно – структурная единица мышцы. Известны три типа мышечных волокон: белые быстро сокращающиеся, промежуточные и медленно сокращающиеся. Биохимически они различаются механизмами энергетического обеспечения мышечного сокращения. Их иннервируют разные мотонейроны, чем обусловлены неодновременность включения в работу и различная скорость сокращения волокон. Разные мышцы имеют разное сочетание типов волокон.
Каждая мышца состоит из нескольких тысяч мышечных волокон, объединяемых соединительными прослойками и такой же оболочкой. Мышца представляет собой многокомпонентный комплекс. Чтобы разобраться в строении мышцы, следует изучить все уровни ее организации, а также структуры, входящие в ее состав (рис. 43).
|
Мышца |
|
|
|
|
||
|
|
|
|
|
|
|
|
Мышечное волокно (миоцит) |
|
|
|
|
|||
Сарколемма |
|
|
|
Миофибриллы |
|
||
Толстые филаменты |
|
|
|
|
|||
|
Тонкие филаменты |
|
|||||
|
|
|
Актин |
|
|
Тропонин |
|
|
|
|
|||||
|
|
|
|
||||
|
Миозин |
Тропомиозин |
|
||||
|
|
|
|
|
|||
Рис. 43. Уровни структурной организации мышцы
224

Строение мышечного волокна. Отдельное волокно имеет длину от 0,1 до 2–3 см (в портняжной мышце до 12 см) и толщину от 0,01 до 0,2 мм. Мышечное волокно представляет собой одну гигантскую клетку, а точнее, бесклеточное образование – симпласт (рис. 44).
Миелиновая оболочка
Мышечное волокно |
Аксон |
|
ла |
||
|
||
Вену |
|
Мотонейрон
Артелиола
Нервные Кровеносные окончания капилляры
Рис. 44. Отдельное мышечное волокно с нервными окончаниями и кровеносными сосудами (масштаб не соблюден)
Симпласт покрыт оболочкой – сарколеммой, на поверхности которой располагаются окончания двигательных нервов. К одному волокну может подходить несколько нервных окончаний. Все скелетные мышцы пронизаны множеством кровеносных сосудов. Каждый структурный компонент мышечного волокна выполняет свою определенную функцию.
Сарколемма представляет собой двухслойную липопротеидную (плазматическую) мембрану толщиной около 10 нм, как бы оплетенную коллагеновыми волокнами. При расслаблении мышцы в ней создаются упругие силы; при расслаблении эти силы растягивают мышечное волокно в исходное положение.
Сарколемма отгораживает внутреннее содержимое мышечного волокна от омываемой его межклеточной жидкости. Она обладает свойством избирательной проницаемости для различных веществ. Через нее не проходят
225
высокомолекулярные вещества: жирные кислоты, белки, полисахариды, но проходят глюкоза, молочная и пировиноградная кислоты, кетоновые тела, аминокислоты и короткие пептиды. Перенос веществ через сарколемму носит активный характер, что позволяет накапливать внутри клетки некоторые вещества в большей концентрации, чем снаружи. Сдвиг реакции среды в кислую сторону увеличивает проницаемость сарколеммы для высокомолекулярных веществ. Избирательная проницаемость сарколеммы играет большую роль в возникновении возбуждения в мышечном волокне. Сарколемма проницаема для ионов К+, накапливающихся внутри волокна, и содержит «ионный насос», удаляющий из клетки ионы Na+. Концентрация ионов Na+ в межклеточной жидкости больше, чем концентрация ионов К+ внутри клетки. Во внутренних зонах волокна содержится большое количество органических анионов. Всё это приводит к возникновению на наружной поверхности сарколеммы избытка положительных, а на внутренней – отрицательных зарядов. Этот мембранный потенциал, который в состоянии покоя равен 90–100 мВ, является необходимым условием возникновения и проведения возбуждения.
Все внутреннее пространство мышечного волокна занято саркоплазмой, представляющей собой коллоидную белковую структуру, в которую вкраплены глыбки гликогена, жировые капли и некоторые другие включения. В саркоплазме имеются различные субклеточные частицы: ядра, митохондрии, миофибриллы, рибосомы и др. (рис. 45). Их функция заключается в регуляции обмена веществ в мышечном волокне путем воздействия на синтез специфических мышечных белков.
Миофибриллы (мышечные нити) являются сократительными элементами мышцы. В нетренированных мышцах миофибриллы располагаются рассеянно, а в тренированных сгруппированы в пучки.
226

Пузырек саркоплазматического ретикулума Поперечная трубочка
Саркоплазма |
Нервное волокно |
|
Ацетилхолин
 Митохондрия
Митохондрия
Окончание
двигательного
нейрона Ядро
Сарколемма
Миофибрилла Митохондрия
Рис. 45. Схема строения отдельного участка мышечного волокна с синапсом (продольный разрез, масштаб не соблюден)
Каждая миофибрилла имеет поперечную исчерченность благодаря чередующимся светлым и темным дискам, причем темные диски одной миофибриллы располагаются рядом с темными дисками другой, что создает поперечную полосатость всего мышечного волокна. Изучение тончайших срезов с мышц позволило установить внутреннюю структуру миофибрилл. Их длина может соответствовать длине мышечного волокна, а диаметр около 1 мкм. Темные диски обладают двойным лучепреломлением и называются А-(анизотропными) дисками; светлые диски, не обладающие двойным лучепреломлением, называются I-(изотропными) дисками (рис. 46). В середине диска I расположена плотная линия Z, которая пронизывает все волокно, как бы удерживая миофибриллы в пучке и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Пучок миофибрилл от од-
227

ной до другой Z-линии называется саркомером. Диски А имеют в середине более светлую полосу – зону Н, пересекаемую более темной М-зоной. В одной миофибрилле может содержаться до 1000–1200 саркомеров. Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплазматический ретикулум, составляющий 8–10 % объема клетки; 3) несколько митохондрий.
Фибриллы
50 -
100 мкм
|
а |
|
I-ДИСК |
А-ДИСК |
I-ДИСК |
z-линия |
Н-зона |
z-линия |
0,8 мкм |
|
1,5 мкм |
|
0,8 мкм |
|
|
б |
|
|
Рис. 46. Структура мышцы на разных уровнях организации: а – мышечное волокно; б – расположение миофибрилл в покоящейся мышце
Миофибриллярные структуры представляют собой агрегаты, состоящие из толстых филаментов диаметром около 14 нм и из расположенных между ними тонких филаментов диаметром 7–8 нм. Филаменты располагаются таким образом, что тонкие входят своими концами в промежутки между толстыми (рис. 47). Диски I состоят только из тонких филаментов, а диски А – из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм; расстояние между этими мостиками 40 нм.
228

"Головки" молекул миозина
 Толстые филаменты
Толстые филаменты
Тонкие
филаменты
Рис. 47. Схема взаимного расположения толстых и тонких филаментов
Толстые филаменты состоят из белка миозина. Молекула миозина длинная (160 нм) и тонкая (2 нм), с утолщением на одном конце – головкой (4 нм). Миозин содержит две одинаковые полипептидные цепи – самые длинные из всех известных (1800 аминокислотных остатков), и четыре легких цепи. Обе цепи имеют конфигурацию -спирали и закручены относительно друг друга в двойную спираль, расходящуюся на одном конце молекулы – стержень. К очень длинному стержню миозина присоединены две головки, части глобулярной формы (рис. 48).
Глобулярная
область

 Стержень молекулы из -спирали
Стержень молекулы из -спирали

Рис. 48. Схематическое изображение молекулы миозина
Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис. 49). Миозиновые нити стыкуются «хвост к хвосту».
229
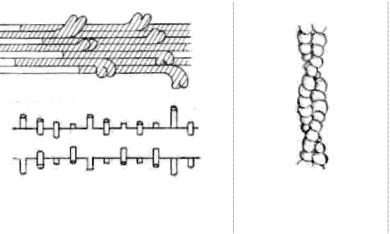
Рис. 49. Расположение миозиновых |
Рис. 50. Спираль фиб- |
молекул в толстых филаментах |
риллярного актина |
Молекула миозина вследствие значительного содержания глютаминовой кислоты имеет довольно большой отрицательный заряд и обладает специфической способностью взаимодействовать с ионами Са2+ и Mg2+. В присутствии ионов Са2+ миозин проявляет аденозинтрифосфатную активность, то есть ферментативную способность ускорять гидролиз АТФ по уравнению:
АТФ + Н2O → АДФ + H3PO4 + энергия (40 кДж/моль).
С помощью ионов Mg2+ миозин способен связывать молекулы АТФ и АДФ, а также образовывать комплекс с актином.
Миозин выполняет три биологически важные функции:
–при физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно;
–миозин обладает каталитической активностью, т. е.
является ферментом. В 1939 г. В.А. Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
230
