
Вопросы для самоконтроля
Раствор как гомогенная система. Растворитель, растворённое вещество. Концентрированные и разбавленные растворы.
Количественный состав раствора как одна из главных характеристик раствора.
Роль воды и растворов в жизнедеятельности.
Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя.
Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
Химический эквивалент, закон эквивалентов.
Эквивалентная масса вещества, её связь с молярной массой, фактор эквивалентности. Правила расчёта фактора эквивалентности для различных классов неорганических соединений.
Изменения эквивалента вещества (эквивалентной массы) в зависимости от реакций, в которых участвует вещество.
Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств.
Растворимость веществ, растворы насыщенные, ненасыщенные и пересыщенные. Влияние на растворимость различных факторов: коэффициент растворимости как количественная характеристика растворимости веществ.
Физический смысл понятия «идеальный раствор».
Тесты для самоконтроля
ТЕСТ 1
Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О.
2. Эквивалентная масса меди в соединении СuSO4 равна:
а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль.
3. Укажите истинный раствор:
а) мел + вода, б) вода + поваренная соль, в) вода + глина,
г) вода + масло.
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n.
ТЕСТ 2
1. Нормальная концентрация – это количество моль вещества, растворенного в:
а) 1 л раствора, б) 1 л растворителя, в) 100 г растворителя,
г) 100 г раствора.
2. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора.
3. Приведите основную формулу для определения концентраций в объемном анализе.
а)
С1V2=
С2
V1,
б)
С1V1=
С2
V2,
в)
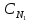 V2=
V2=
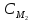 V1
V1
4. Масса хлорида натрия количеством вещества 0,8 моль равна:
а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г.
5. Массовая доля показывает количество:
а) моль-экв/л;
б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора;
г) г растворенного вещества в 100 г раствора.
ТЕСТ 3
1. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора.
2. Эквивалентная масса меди в соединении СuSO4 равна:
а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль.
3. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
4. Приведите основную формулу для определения концентраций в объемном анализе.
а)
С1V2=
С2
V1,
б)
С1V1=
С2
V2,
в)
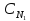 V2=
V2=
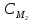 V1
V1
5. Укажите истинный раствор:
а) мел + вода, б) вода + поваренная соль, в) вода + глина,
г) вода + масло.
ТЕСТ 4
1. Массовая доля показывает количество:
а) моль-экв/л;
б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора;
г) г растворенного вещества в 100 г раствора.
2. Масса хлорида натрия количеством вещества 0,8 моль равна:
а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г.
3. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n.
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды;
б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора;
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
Эквивалент Cu(NO3)2 равен:
а) 188 г/моль; б) 171 г/моль; в) 94 г/моль; г) 114 г/моль.
ТЕСТ 5
1. Приведите основную формулу для определения концентраций в объемном анализе.
а)
С1V2=
С2
V1,
б)
С1V1=
С2
V2,
в)
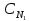 V2=
V2=
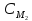 V1
V1
Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О.
Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40 г воды равна:
а) 2, б) 0,6, в) 1,5, г) 0,5.
4. При полной нейтрализации Н3РО4 её эквивалент равен:
а) 49 г/моль, б) 98 г/моль, в) 32,6 г/моль, г) 196 г/моль.
5.Методом точной навески можно приготовить раствор:
а) Na2CO3, б) HCl, в) H2SO4, г) KOH.
Ответы к тестам
ТЕСТ 1
|
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
|
ОТВЕТ |
а |
а |
б |
б |
б |
ТЕСТ 2
|
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
|
ОТВЕТ |
а |
б |
б |
б |
г |
ТЕСТ 3
|
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
|
ОТВЕТ |
г |
а |
б |
б |
б |
ТЕСТ 4
|
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
|
ОТВЕТ |
г |
б |
б |
б |
в |
ТЕСТ 5
|
№ ВОПРОСА |
1 |
2 |
3 |
4 |
5 |
|
ОТВЕТ |
б |
а |
б |
б |
б |
