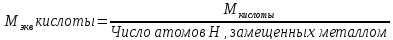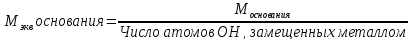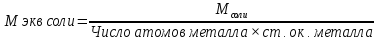Способы выражения концентрации растворов.
Количественной характеристикой раствора служит его концентрация, то есть количество растворенного вещества в определенном количестве раствора или растворителя. Различают массовую долю, молярную и нормальную концентрации. В аналитической химии наряду с общими химическими понятиями широко используют ряд таких понятий, которые присуще только ей и помогают характеризовать состав раствора. К ним относятся титр, эквивалент, титр по определяемому веществу. Рассмотрим каждый из способов определения концентрации вещества.
1. Массовая доля (ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)=m(х)/ m (раствора)
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора. Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Выражается она в моль/л. Сокращенно пишут М. Например, 2М (NaOH).
См=n(х)/V
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество моль- эквивалентов вещества, содержащегося в 1 л раствора.
СN=nэкв(х)/V
Единица измерения моль-экв/л, Сокращенно обозначается буквой N. Например, 0.1N HCL означает, что в 1 литре такого раствора содержится 0,1моль- эквивалент НСl.
Эквивалент - такая масса вещества, которая способна заместить или вытеснить один моль атома водорода. Обозначается эквивалент Э, выражается в молях. Масса одного эквивалента называется эквивалентной массой, обозначается Мэкв, выражается в г/моль-экв. Эквивалент в большинстве случаев – величина переменная и зависит от типа реакции.
Способы расчета Мэкв.
Закон эквивалентов предложен в 1814г. И.Рихтером: «Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам». Математическое выражение этого закона:

Следствие закона: Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
|
V1/V2=N2/N1 |
Или |
V1N1= V2N2 |
|
V1/V2=M2/M1 |
|
V1М1= V2М2 |
4. Титр (Т)- масса растворенного вещества, содержащаяся в 1 мл раствора, выраженная в граммах. Определятся по формуле:
Т= СN·Мэкв/1000
Раствор с известным титром называется титрованным раствором.
Способы приготовления стандартных растворов.
Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал - ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
Метод приблизительной навески. Предполагает работу с растворами, которые меняют свою массу на воздухе, например, перманганат калия. Работать с такими растворами нельзя, поэтому перед применением их в качестве стандартных, необходимо оттитровать другим раствором с точно известной концентрацией.
Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.