
Физика
.pdf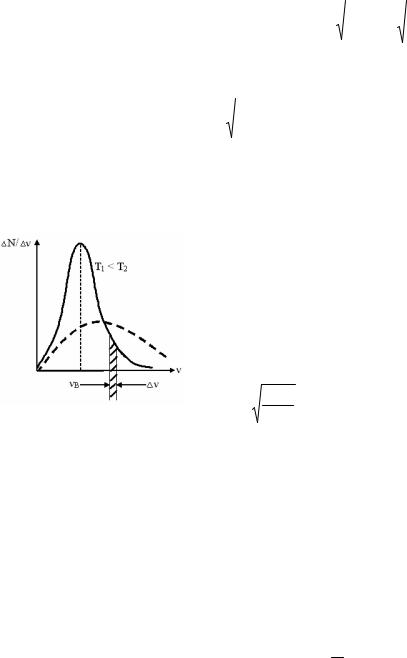
Молекулы газа движутся с различными скоростями. Скорость движения молекул газа зависит от его температуры. Так как скорости отдельных молекул различны, то имеет смысл говорить о средней скорости молекул газа при данной температуре.
Получим выражение для средней квадратической скорости поступательного движения молекул:
Eк = 3KT |
|
|
|
|
|
|
|
|
|
|
|||||||
|
Eк = |
mV 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
2 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
mV 2 |
|
|
|
|
|
|
|
|
|
|
|||
|
3 |
KT = |
V = |
3KT |
= |
|
3RT |
|
|||||||||
|
|
|
|
|
|
rA × m |
|
||||||||||
2 |
|
2 |
|
|
|
|
m |
|
|||||||||
|
R = K × rA K = |
R |
|
|
|
||||||||||||
|
rA |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
V = |
|
3RT |
|
|
|
|
|
|
|
|
|
|
|
||||
|
M |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Средняя квадратическая скорость поступательного движения молекул пропорциональна корню квадратному из термодинамической температуры.
Распределение молекул газа по скоростям (по Максвеллу).
На графике (рис.25) представлена кривая распределения молекул по скоростям. Все молекулы газа движутся с различными скоростями.
Наибольшее число молекул обладают средней скоростью, а большой и маленькой – обладает незначительное количество молекул.
Vв. = 2RT
M |
наиболее вероятная скорость молекул |
T1 T2 |
|
Рисунок 25.
Понятие идеального газа
.
Идеальным газом называется воображаемая модель газа, молекулы которого представляют собой материальные точки и силами взаимодействия, между молекулами можно пренебречь.
Получим уравнение состояния идеального газа ( Менделеева - Клапейрона) –
P = n0 KT ( n0 - концентрация молекул).
n0 = r V
31

= rKT
P
V
r = m × rA M
P ×V = rKT = m r × KT = m RT |
|
M A |
M |
Получаем:
PV = m × RT
M
уравнение состояния идеального газа Реальный газ – при рассмотрении реальных газов учитывают размеры, форму и
силы взаимодействия между молекулами.
Уравнение состояния реального газа. (Ван-Дер-Ваальса) – (P + P¢) × (V -V ¢) = m RT ,
M
где P′ − давление реального газа; V ′ - объем самих молекул.
P¢ = m2 × a
M 2 V 2
V = m × b
M
a, b − некоторый коэффициент
Изотермы Ван-дер-Ваальса.
На PVдиаграмме изобразим изотермы реального газа.
Рисунок 26.
Изотермы реального газа в отличии от изотерм идеального газа имеют некоторую неоднородность, которая едва проявляется при температуре, равной критической, и все явственнее видна при температурах более низких (рис.26). Таким образом на графике выделяется область(заштрихованная) переходного состояния пар-жидкость. Область, соответствующая меньшим значениям объема и большим значениям давления, показывает жидкое агрегатное состояние. А область с большими значениями объема и меньшими значениями давления соответствует газообразному агрегатному состоянию.
Критическая температура – это некоторое пороговое значение, если газ находится при температуре выше критической, то его никаким давлением нельзя перевести в
32
жидкое состояние, если - ниже критической, то его можно перевести в жидкое состояние.
1.4.Диффузия
Явления переноса характеризуют перенос какой-либо физической величины. К ним относятся:
-диффузия
-теплопроводность
-внутреннее трение
Диффузия – это явление, перемешивания молекул двух различных газов или двух веществ в результате хаотического движения молекул. При диффузии переносится масса вещества. Запишем уравнение диффузии (Фика).
Уравнение Фика: DM = -D DCρ × DSDt
D - коэффициент диффузии
Масса газа, переносимая в результате диффузии через площадку S в направлении убывания плотности пропорциональна площади этой площадки, промежутку времени переноса и градиенту плотности.
1.5.Теплопроводность
Теплопроводность – это перенос тепла или энергии тепла от более нагретых частей тела к менее нагретым, происходящее в результате взаимодействия молекул. Запишем уравнение теплопроводности (Фурье).
Уравнение Фурье.
DQ = -À DCΔΤ × DSDt
Q - количество теплоты
- коэффициент теплопроводности
Рисунок 27.
Количество теплоты, переносимое через площадку S в направлении убывания температуры, пропорционально площади этой площадки, градиенту температуры и времени переноса.
1.6.Внутреннее трение
Внутреннее трение – это перенос импульса или скорости между двумя слоями газа, движущимися с разными скоростями. Запишем уравнение внутреннего трения:
Уравнение Ньютона.
33
Переносимой характеристикой является импульс молекулы γ = k = mω .
Тогда D(n0γ ) = D(n0 k ) = D(n0 mω ) = n0 mDω (Dω = ω1 -ω).
В свою очередь:
(Nγ ) = (Nk ) = K R = F t
где ∆К – изменение импульса одного слоя, относительно другого за время ∆t на
площадке ∆S.
Рисунок 28. Получили уравнение Ньютона для внутреннего трения:
DF = -η DCω × DS
Сила внутреннего трения, возникающая в плоскости соприкосновения двух скользящих относительно друг друга слоев газа или жидкости пропорциональна gradV
и площади соприкосновения слоев S .
1.7.Уравнение переноса в общем виде.
Рассмотрим перенос какой-либо физической величины через произвольную площадку с площадью S (рис.29). Изменение переносимого параметра происходит на расстоянии X, равном двум значениям средней длины свободного пробега молекул.
Рисунок 29.
r(ϕ) = - 1 λ V Dn0 (ϕ ) × DSDt - уравнение переноса в общем виде. 3 DC
34

Частный случай диффузии.
Осмос – это явление, характеризующее проникновение молекул растворителя через полу прочищаемую перегородку – молекулы растворителя могут проходить через полу прочищаемую перегородку, а молекулы растворенного вещества – нет.
Pостатич. = cRT
M
P1 P2 ; P1 - осмотическое давление
Вопросы для самоконтроля.
1.В чем заключается явление переноса физической величины?
2.Что называется диффузией?
3.Что называется теплопроводностью?
4.Что называется внутренним трением?
5.В чем заключается физический смысл явления осмоса?
6.Назвать основные положения МКТ?
7.Какой газ называется идеальным?
8.В чем заключается физический смысл температуры и давления?
9.Какие изопроцессы вы знаете?
10.В чем заключается физический смысл критической температуры?
СПИСОК ЛИТЕРАТУРЫ
Основная
1.Грабовский, Р.И. Курс физики. / Р.И. Грабовский. – 6-е изд – СПБ. : Издательство
«Лань», 2002.- 608 с
2.Пронин, В.П. Краткий курс физики / В.П. Пронин. – Саратов. ФГОУ ВПО
«Саратовский ГАУ», 2007 г. – 200 с 3.
Дополнительная
1.Основы физики и биофизики / А.И. Журавлев [и др.] – М. : Мир. 2005. – 384 с.
2.Пронин, В.П. Практикум по физике : уч. пособия / В.П. Пронин.- 2-е изд.– краткий курс физики. – Саратов. СГАУ. 2007 г., 200с.
3.Телесин, Р.В. Молекулярная физика: Учебное пособие 3-е издание / Р.В. Телесин. – С.- Петербург: Издательство «Лань», 2009г.- 368с. 1000 экз.
35

Лекция 4
ТЕРМОДИНАМИКА
1.1.Понятие числа степеней свободы
Понятие числа степеней свободы. Числом степеней свободы называется число независимых координат, определяющих положение молекулы или тела в пространстве. Молекулы в газах движутся беспорядочно, при этом они совершают поступательный и вращательный вид движения.
Максимальное число степеней свободы молекул = 6 (3 поступательных и 3 вращательных степеней свободы).
Одноатомная молекула имеет три поступательных степени свободы. При вращении одноатомной молекулы относительно ее центра, ее положение в пространстве не изменяется, значит, вращательные степени свободы у одноатомных молекул = 0.
Двухатомные молекулы имеют пять степеней свободы: 3 поступательных и 2 вращательных, вращается относительно осей одной линии связи атомов.
Трех и более атомные молекулы имеют все шесть степеней свободы. Число степеней свободы молекулы – j.
1.2.Основные понятия термодинамики
Внутренняя энергия вещества называется суммарная кинетическая энергия всех молекул этого тела.
Внутренняя энергия определяется температурой, а так же от рода вещества.
Внутренняя энергия вещества - U = i × m KT . 2 M
Внутренняя энергия вещества распределяется по степеням свободы равномерно. Внутренняя энергия зависит от удельной теплоемкости вещества.
Теплоемкость – это способность вещества накапливать или принимать тепло. Удельная теплоемкость – определяется количеством теплоты, которую нужно сообщить единицы массы, чтобы увеличить его температуру на один Кельвин.
C = Q mDT
Q = cmΔΤ
[Q] = 1Дж
Удельная теплоемкость газов зависит от условий, при которых газ нагревается. Газ можно нагревать при двух условиях:
1.при постоянном давлении (в этом случае, рассматривается теплоемкость газа при постоянном давлении (Ср.));
2.при постоянном объеме (удельная теплоемкость газа при постоянном объеме (СV)). Ср больше, чем СV на величину работы, которую совершает газ при нагревании
постоянном давлении.
Физический смысл универсальной газовой постоянной. Универсальная газовая постоянная численно равна работе, совершаемой одним молем газа при нагревании его на один Кельвин.
36

Уравнение Майера
C р = Cv + R
Cv = dU = iRT dT 2T
Cv = iR
2
C р. = iR + R
2
Получим отношения C р к Сv через число степеней свободы:
C p |
|
|
iR |
+ R |
iR |
+ 2R |
|
R(i + 2) |
|
i + 2 |
||||||||||
|
|
|
|
|
2 |
|
|
|||||||||||||
= |
|
2 |
|
|
|
|
= |
|
|
|
= |
= |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Cv |
|
|
|
iR |
|
|
|
|
iR |
|
iR |
i |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
||||
|
C p |
|
= |
|
i + 2 |
= γ |
показатель адиабаты |
|||||||||||||
|
Cv |
|
|
|
|
i |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Состояние газа характеризуется тремя параметрами: Т, P, V.
Термодинамический процесс – это переход системы из одного состояния в другое, в результате которого изменяются параметры P, V, T.
Термодинамика базируется на двух основных законах, называемых началами термодинамики.
1.3.Основные законы термодинамики
Первое начало термодинамики – это все количество теплоты, переданное системе, расходуется на изменение ее внутренней энергии и совершение работы.
Q = U + A
Изобразим PV диаграмму циклического (периодического) процесса (рис.30), при котором система, проходярядтермодинамическихсостояний, возвращаетсявисходноесостояние.
Рисунок 30.
Q = A
37

Система не может совершать работу большую, чем переданное ей тепло. Термодинамические процессы бывают обратимыми и необратимыми. Обратимый
(идеализированный) процесс, при котором система, пройдя ряд термодинамических состояний, возвращается в исходное и при этом никаких изменений не происходит.
Все термодинамические процессы необратимы.
Адиабатический процесс – это процесс, протекающий без теплообмена между системой и окружающей средой.
Рисунок 31.
На PVдиаграммах адиабата изображается круче изотермы (рис31).
Изменение давления при адиабатическом процессе происходит не только за счет изменения объема, как это происходит при изотермическом процессе, но и за счет изменения температуры.
1.4.Работа при термодинамических процессах.
При термодинамических процессах совершается работа. Получим выражение для этой работы.
A = F × Dh
P = F F = PS
S
A = PS h
A − P V
Рассмотрим переход системы из первого состояния во второе. На бесконечно малом участке совершается работа, равная:
dA = PdV
38
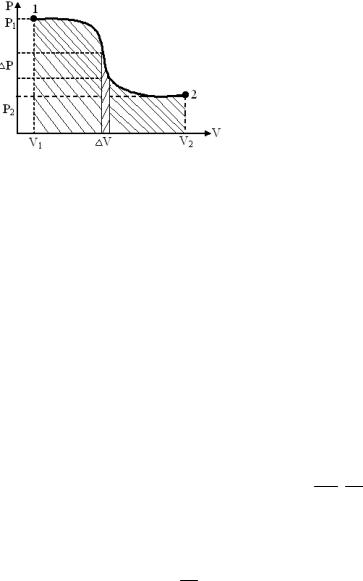
Рисунок 32.
V2
A = ∫ PdV
V1
- полная работа, совершаемая при переходе системы из первого состояния во второе.
Полная работа, совершаемая при переходе системы из первого состояния во второе, графически равна площади, ограниченной кривой 1,2, ординатами P1 и P2 и осью
(рис.32).
Работа, совершаемая при термодинамических процессах зависит от характера процесса.
Рассмотрим работу при изотермическом, изобарическом, адиабатическом процессе.
Работа при изотермическом процессе.
Из уравнения МенделееваКлапейрона имеем:
PV = RT P = RT ; m = 1
|
|
|
|
V M |
||
V2 |
V2 |
RT |
V2 |
1 |
|
|
A = ∫ PdV ∫ |
dV = RT ∫ |
= RT (LnV2 − LnV ) |
||||
V |
|
|||||
V |
V |
V |
V |
|||
1 |
1 |
|
1 |
|
|
|
A = RT ln V2 - работа при изотермическом процессе.
V1
Работа при изобарическом процессе.
P = const
V2 |
V2 |
A = ∫ PdV = P ∫ dV = P(V2 − V1 ) |
|
V1 |
V1 |
A = P(V2 − V1 ) - работа при изобарическом процессе
Работа при адиабатическом процессе.
Q = U + A
Q = 0
A = − U
39

U - изменение внутренней энергии
Работа при адиабатическом процессе происходит за счет изменения внутренней энергии системы.
dA = −dU
Т.к., при адиабатическом процессе не происходит теплообмена между системой и окружающей средой Q = 0 , значит работа при адиабатическом процессе совершается
за счет изменения внутренней энергии системы: dA = −dU .
Сv |
= |
dU |
dU = Cv × dT |
|
dT |
||||
|
|
|
||
dA = PdV = -dU = -Cv dT |
||||
|
|
T2 |
T2 |
|
A = -∫Cv dT = -Cv ∫Cv (T1 - T2 )
T1 |
T1 |
Таким образом работа при адиабатическом процессе равна:
A = Cv (T1 - T2 )
Для описания адиабатического процесса используется уравнение Пуассона:
TV γ −1 = const
C p = i + 2 = γ - показатель адиабаты
Cv i
При адиабатическом расширении температура газа уменьшается, при адиабатическом сжатии температура увеличивается.
1.5.Тепловая машина. Цикл Карно.
Машиной называется периодический действующий механизм, который, пройдя ряд термодинамических состояний, возвращается в исходное состояние и этот процесс повторяется.
Рассмотрим устройство и работу тепловой машины, изобретенной французским физиком Карно.
С помощью своей тепловой машины Карно провел важнейший опыт, который лег в основу второго начала термодинамики. Для проведения своего опыта Карно использовал цилиндрический сосуд с нетеплопроводными стенками и с теплопроводным дном, заключив в этот сосуд один моль газа. Внутри стенок сосуда перемещался поршень, который давал газу возможность изменять свой объем . В процессе проведения опыта в системе, изобретенной Карно, протекало 4 процесса: изотермическое расширение, адиабатическое расширение, изотермическое сжатие, адиабатическое сжатие. Графики этих процессов представлены на рисунке 33.
Рассмотрим работу идеальной тепловой машины, в качестве рабочего тела в которой используется один моль идеального газа (рис.33)
40
