
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Практическое применение окислительно-восстановительных реакций
Окислительно-восстановительные реакции являются самыми распространенными и играют важную роль в природе и технике. Дыхание и обмен веществ живых организмов, коррозия металлов, горение топлива — это примеры окислительно-восстановительных реакций. С помощью ОВР получают металлы, щелочи, кислоты и многие другие ценные продукты. ОВР используют для очистки веществ, природных и сточных вод, газовых выбросов предприятий. Окислители и восстановители, образующие окрашенные растворы, широко применяют для анализа различных веществ методом титрования. С упрощенным вариантом метода анализа вы познакомитесь в данной работе.
Экспериментальная часть
Опыт 1. Влияние рН среды на характер протекания окислительно-восстановительной реакции
Известны соединения
марганца, содержащие этот элемент в
различных степенях окисления:
![]() ,
,![]() ,
,![]() ,
,![]() .
Эти вещества
проявляют различные окислительно-восстановительные
свойства и окрашивают растворы в разные
цвета:
.
Эти вещества
проявляют различные окислительно-восстановительные
свойства и окрашивают растворы в разные
цвета:
![]() в темно-малиновый,
в темно-малиновый,![]() — в зеленый,
— в зеленый,![]() образует бесцветный раствор,
образует бесцветный раствор,![]() выпадает в виде бурого осадка.
В химических
реакциях
выпадает в виде бурого осадка.
В химических
реакциях
![]() восстанавливается до одного из указанных
веществ в зависимости от кислотности
среды.
восстанавливается до одного из указанных
веществ в зависимости от кислотности
среды.
Для оценки влияния
рН среды на окислительные свойства
перманганата калия в три пробирки
налейте по 2-3 мл раствора сульфита натрия
![]() .
В одну
пробирку добавьте 1 мл раствора
.
В одну
пробирку добавьте 1 мл раствора
![]() ,
во второй пробирке оставьте
раствор соли
нейтральным, в третью пробирку добавьте
1 мл раствора
,
во второй пробирке оставьте
раствор соли
нейтральным, в третью пробирку добавьте
1 мл раствора
![]() .
В каждую
пробирку
внесите одинаковое количество (2-3 мл)
раствора
перманганата
калия
.
В каждую
пробирку
внесите одинаковое количество (2-3 мл)
раствора
перманганата
калия
![]() .
.
Отметьте изменение
окраски растворов и напишите схемы
реакций, протекающих в разных средах.
Определите степень окисления Mn
в его соединениях, расставьте коэффициенты
в уравнениях. Сделайте вывод о влиянии
рН среды на окислительные свойства
![]() .
.
Опыт 2. Определение содержания железа(II) в его соли методом перманганатометрии
Метод перманганатометрии
применяется для количественного
определения веществ, способных окисляться,
и основан на изменении окраски соединений
Mn
при изменении его степени окисления.
При титровании подкисленного раствора
определяемого вещества раствором
![]()
![]() восстанавливается до
восстанавливается до![]() ,
что сопровождается обесцвечиванием
раствора соли марганца. Когда исследуемое
вещество прореагирует полностью, от
одной капли прилитого раствора
,
что сопровождается обесцвечиванием
раствора соли марганца. Когда исследуемое
вещество прореагирует полностью, от
одной капли прилитого раствора![]() появляется слабое розовое окрашивание.
Появление
окраски
свидетельствует об окончании реакции
и наличии незначительного избытка
реактива.
появляется слабое розовое окрашивание.
Появление
окраски
свидетельствует об окончании реакции
и наличии незначительного избытка
реактива.
Определив
экспериментально количество
израсходованного
![]() ,
можно по закону эквивалентов рассчитать
количество исследуемого вещества.
,
можно по закону эквивалентов рассчитать
количество исследуемого вещества.
Количественное
определение двухвалентного железа
основано на том, что в кислой среде ион
![]() легко окисляется перманганатом до иона
легко окисляется перманганатом до иона![]() .
Реакция,
протекающая в процессе титрования
раствора соли двухвалентного железа,
выражается следующей схемой:
.
Реакция,
протекающая в процессе титрования
раствора соли двухвалентного железа,
выражается следующей схемой:
![]()
Для выполнения
работы взвесьте на аналитических весах
с точностью до 0,0002 г (на часовом стекле)
несколько кристаллов сульфата железа
![]() ,
известного под названием железный
купорос. Запишите массу соли в тетрадь.
Пересыпьте соль в коническую колбу,
налейте в нее 50 мл раствора серной
кислоты, и, осторожно перемешивая,
дождитесь растворения соли.
,
известного под названием железный
купорос. Запишите массу соли в тетрадь.
Пересыпьте соль в коническую колбу,
налейте в нее 50 мл раствора серной
кислоты, и, осторожно перемешивая,
дождитесь растворения соли.
В бюретку с помощью
воронки налейте раствор
![]() известной концентрации; под бюретку
подставьте
стакан. Подняв кончик бюретки выше
уровня зажима, вытесните воздух и
заполните его раствором. Установите
уровень раствора в бюретке на нулевой
отметке (для темных жидкостей это
делается по верхнему краю мениска).
известной концентрации; под бюретку
подставьте
стакан. Подняв кончик бюретки выше
уровня зажима, вытесните воздух и
заполните его раствором. Установите
уровень раствора в бюретке на нулевой
отметке (для темных жидкостей это
делается по верхнему краю мениска).
Держа колбу с
раствором
![]() в руке, при
постоянном перемешивании добавляйте
небольшими порциями раствор
в руке, при
постоянном перемешивании добавляйте
небольшими порциями раствор
![]() до появления слабо розового окрашивания.
По окончании титрования запишите в
тетрадь объем израсходованного раствора
перманганата калия.
до появления слабо розового окрашивания.
По окончании титрования запишите в
тетрадь объем израсходованного раствора
перманганата калия.
Напишите уравнение реакции, определите число электронов, отдаваемых ионом железа, и рассчитайте молярную массу его эквивалента по формуле (1):
![]() (1)
(1)
Массу окисленного
железа рассчитайте, используя закон
эквивалентов:
число
эквивалентов
![]() равно числу эквивалентов
равно числу эквивалентов![]() ,
поэтому в
данном случае выполняется равенство:
,
поэтому в
данном случае выполняется равенство:
![]() , (2)
, (2)
где
![]() - масса окисленного железа, г;
- масса окисленного железа, г;
![]() –молярная масса
эквивалента
–молярная масса
эквивалента
![]() ,
г/моль;
,
г/моль;
![]() (
(![]() )–молярная
концентрация эквивалента
)–молярная
концентрация эквивалента![]() ,
моль/л;
,
моль/л;
![]() (
(![]() )–объем
раствора
)–объем
раствора![]() ,
л, определенный экспериментально.
,
л, определенный экспериментально.
Из выражения 2 найдите массу окисленного железа:
![]() (3)
(3)
Процентное содержание железа в соли рассчитайте по формуле:
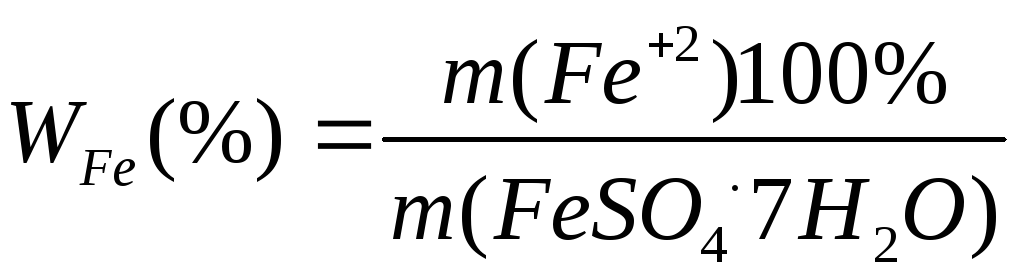 (4),
(4),
где
![]() –
масса анализируемой соли, г.
–
масса анализируемой соли, г.
Экспериментально полученное значение массовой доли железа в его соли сравните с расчетным значением.
