
- •Министерство сельского хозяйства Российской Федерации
- •Введение.
- •Лекция 1
- •Ж) мгновенное ускорение
- •Выражение пути и перемещения через мгновенную скорость.
- •Равнопеременное движение.
- •1.2. Криволинейное движение. Центростремительное ускорение. Кинематика вращательного движения. Движение материальной точки по окружности.
- •Ускорение при криволинейном движении.
- •Вопросы для самоконтроля
- •Лекция 2 основы динамики материальной точки
- •2.1. Законы Ньютона. Виды взаимодействий. Сила и масса. Виды сил в механике.
- •Законы Ньютона.
- •2.2. Импульс тела и импульс силы. Закон сохранения импульса для системы тел. Системы замкнутые и открытые. Центр массы системы тел.
- •2.3. Работа и мощность. Кинетическая и потенциальная энергия. Закон сохранения энергии.
- •Вопросы для самоконтроля
- •Лекция 3
- •Вращение твердого тела.
- •Теорема Штейнера.
- •Основное уравнение динамики вращательного движения.
- •Кинетическая энергия вращающегося твердого тела.
- •Вопросы для самоконтроля
- •Лекция 4 колебания и волны
- •4.1. Колебательное движение. Дифференциальное уравнение гармонических колебаний математического, физического и пружинного маятников. Амплитуда, фаза, частота и период колебаний.
- •Колебания математического маятника.
- •Вынужденные колебания. Резонанс. Затухающие колебания. Декремент затухания. Добротность.
- •Затухающие колебания.
- •Волновое движение. Продольные и поперечные волны. Уравнение волны. Фазовая и групповая скорость. Длина волны и частота. Энергия волны. Сложение волн. Стоячие волны.
- •Вопросы для самоконтроля
- •Лекция 5. Основы молекулярной физики и термодинамики.
- •5.1. Статистический и термодинамический методы в молекулярной физике. Масса и размеры молекул. Число Авогадро. Идеальный газ. Термодинамические параметры. Уравнение состояния. Изопроцессы.
- •5.2. I начало термодинамики. Теплота, работа и внутренняя энергия.
- •I начало термодинамики.
- •I начало термодинамики для различных процессов.
- •Уравнение Пуассона для адиабатического процесса.
- •Политропический процесс.
- •Вопросы для самоконтроля
- •Лекция 6.
- •6.1. Основное уравнение молекулярно-кинетической теории газов для давления. Распределение Максвелла-Больцмана молекул газа по скоростям.
- •Распределение Максвелла. Распределение молекул по скоростям.
- •Барометрическая формула.
- •Распределение Больцмана.
- •6.2. Число степеней свободы. Распределение энергии по степеням свободы. Явление переноса. Принцип распределения энергии по степеням свободы.
- •Явления переноса.
- •Цикл Карно. Теорема Карно.
- •Теорема Карно.
- •Понятие энтропии.
- •Неравенство Клазиуса.
- •Статистический смысл энтропии.
- •Вопросы для самоконтроля
- •Содержание
Цикл Карно. Теорема Карно.
P
T1 Q1
![]()
T2 ![]()
![]()
![]()
Q V
Цикл Карно состоит из 2-х изотерм и 2-х адиабат. Изотерма – участки [1,2],[3,4], Адиабата – [2,3],[4,1].
При движении по адиабатам система не обменивается теплом с нагревателем и холодильником, тепло принимается и отдается только на изотермах.
Вычислим КПД цикла Карно.
![]()
![]()
Для адиабатического процесса
![]()
![]()
![]()
![]()
![]()
T = const; Q1 = A12; ΔU = 0.
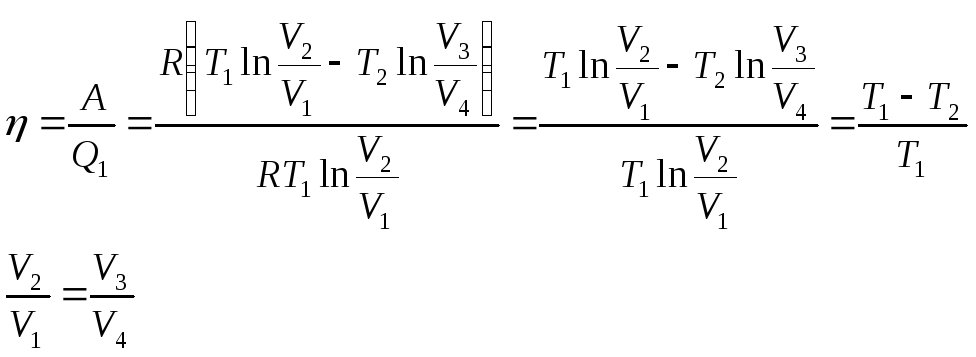
Уравнения для участков изотерм и адиабат.
![]()
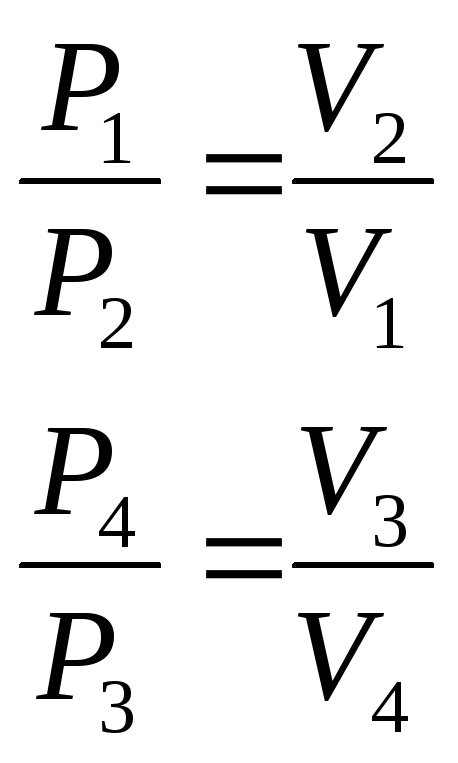
![]()
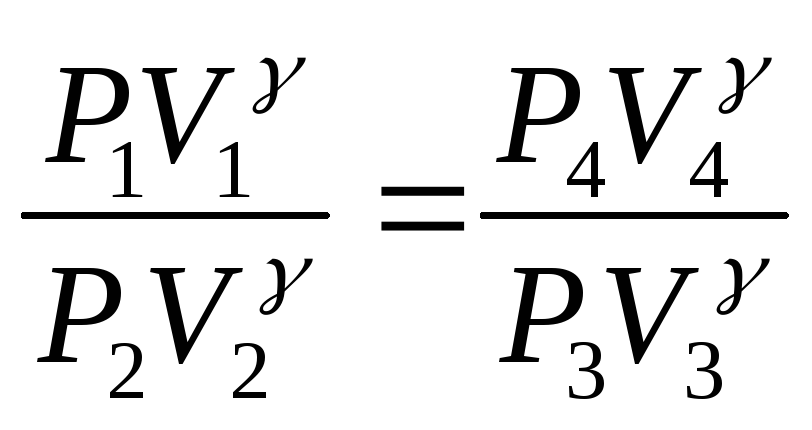

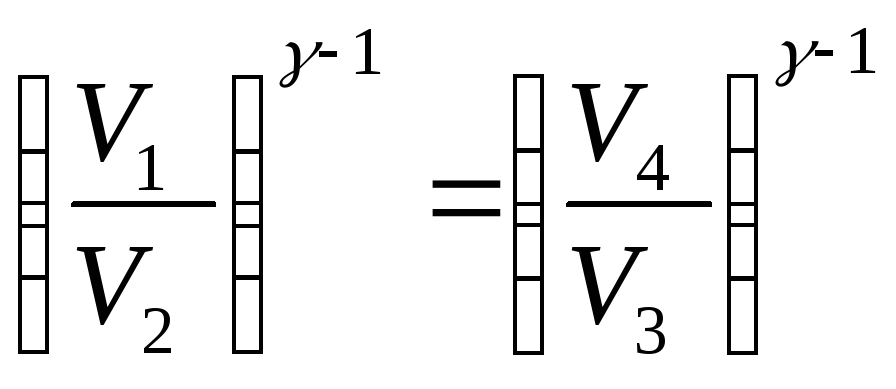 =>
=> ![]()
Теорема Карно.
1. Из всех тепловых двигателей, работающих при одинаковых условиях, т.е. при одинаковых температурах нагревателей и одинаковых температурах холодильников, максимальным КПД обладает машина, работающая по циклу Карно.
2.
КПД машины Карно определяется лишь
температурой нагревателя Т1
и температурой холодильника Т2
и не зависит от того, какой газ использован
в качестве рабочего тела.
![]()
Понятие энтропии.
 P
P
 δQ
δQ

V
Рассмотрим круговой процесс, при совершении этого кругового процесса газ обменивается теплом с окружающими телами.
Выберем некоторую часть (малую).В этой части система отдала или получила некоторое количество тепла δQ, и считаем, что при этом T = const.
Отношение:
![]() - приведенное количество теплоты.
- приведенное количество теплоты.
Энтропий называется такая термодинамическая величина, полный дифференциал которой равен приведенному количеству теплоты.
![]() .
.
Неравенство Клазиуса.
![]()
Знак «>» - для необратимого процесса, и «=» - для обратимого процесса.
Энтропия изолированной системы не может убывать - II закон термодинамики.
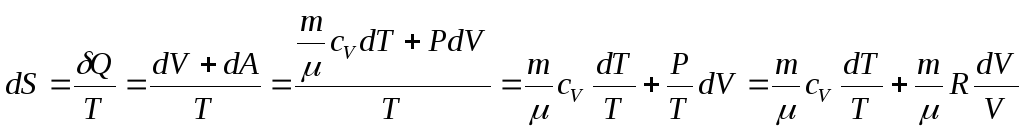
Пусть происходит термодинамический процесс при котором Т изменяется от Т1 до Т2, а объем от V1 до V2.
Вычислим уравнение энтропии.
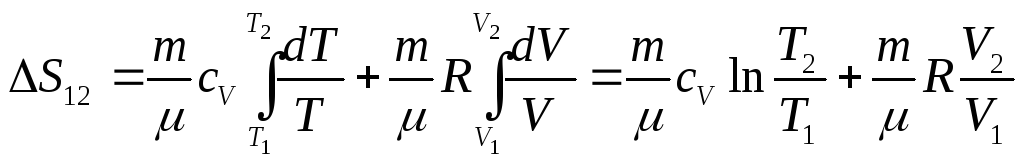
а) если процесс изохорный
![]()
![]()
б) процесс изотермический
![]()
![]() .
.
Статистический смысл энтропии.
Между
энтропией системы и термодинамической
вероятностью состояния тела или системы
![]() существует связь, установленная Л.
Больцманом:
существует связь, установленная Л.
Больцманом:
![]()
Таким образом, энтропия, соответствующая данному состоянию, равна произведению постоянной Больцмана на натуральный логарифм термодинамической вероятности этого состояния.
Термодинамическая вероятность W равна числу всевозможных микрораспределений частиц по координатам и скоростям, соответствующих данному термодинамическому состоянию (макросостоянию).
Вследствие того, что энтропия, в согласии с формулой Больцмана, имеет простое статистическое истолкование, приобретает статистический характер и второе начало термодинамики. Формулировка второго начала, приведенная ранее, теряет свою категоричность. Второе начало термодинамики следует теперь понимать как утверждение о наиболее вероятном направлении протекания процессов в изолированной системе. А именно, можно утверждать, что очень велика вероятность такого процесса, при котором система переходит из какого-то начального состояния в более близкое к равновесному, и, значит, в более вероятное состояние. Самопроизвольное удаление системы от состояния равновесия имеет очень малую вероятность, но не исключается полностью. Поэтому второе начало надо понимать следующим образом: если система находится в каком-то состоянии с данной энтропией, то с очень большой вероятностью следует ожидать ее перехода в состояние с большей энтропией; иными словами, наиболее вероятным изменением энтропии является её возрастание.
Возможные в принципе процессы, в которых энтропия не возрастает, а уменьшается, все время происходят в природе. Однако вероятность таких процессов тем меньше, чем больше отклонение энтропии от значения, соответствующего равновесию.
