
- •Министерство сельского хозяйства Российской Федерации
- •Введение.
- •Лекция 1
- •Ж) мгновенное ускорение
- •Выражение пути и перемещения через мгновенную скорость.
- •Равнопеременное движение.
- •1.2. Криволинейное движение. Центростремительное ускорение. Кинематика вращательного движения. Движение материальной точки по окружности.
- •Ускорение при криволинейном движении.
- •Вопросы для самоконтроля
- •Лекция 2 основы динамики материальной точки
- •2.1. Законы Ньютона. Виды взаимодействий. Сила и масса. Виды сил в механике.
- •Законы Ньютона.
- •2.2. Импульс тела и импульс силы. Закон сохранения импульса для системы тел. Системы замкнутые и открытые. Центр массы системы тел.
- •2.3. Работа и мощность. Кинетическая и потенциальная энергия. Закон сохранения энергии.
- •Вопросы для самоконтроля
- •Лекция 3
- •Вращение твердого тела.
- •Теорема Штейнера.
- •Основное уравнение динамики вращательного движения.
- •Кинетическая энергия вращающегося твердого тела.
- •Вопросы для самоконтроля
- •Лекция 4 колебания и волны
- •4.1. Колебательное движение. Дифференциальное уравнение гармонических колебаний математического, физического и пружинного маятников. Амплитуда, фаза, частота и период колебаний.
- •Колебания математического маятника.
- •Вынужденные колебания. Резонанс. Затухающие колебания. Декремент затухания. Добротность.
- •Затухающие колебания.
- •Волновое движение. Продольные и поперечные волны. Уравнение волны. Фазовая и групповая скорость. Длина волны и частота. Энергия волны. Сложение волн. Стоячие волны.
- •Вопросы для самоконтроля
- •Лекция 5. Основы молекулярной физики и термодинамики.
- •5.1. Статистический и термодинамический методы в молекулярной физике. Масса и размеры молекул. Число Авогадро. Идеальный газ. Термодинамические параметры. Уравнение состояния. Изопроцессы.
- •5.2. I начало термодинамики. Теплота, работа и внутренняя энергия.
- •I начало термодинамики.
- •I начало термодинамики для различных процессов.
- •Уравнение Пуассона для адиабатического процесса.
- •Политропический процесс.
- •Вопросы для самоконтроля
- •Лекция 6.
- •6.1. Основное уравнение молекулярно-кинетической теории газов для давления. Распределение Максвелла-Больцмана молекул газа по скоростям.
- •Распределение Максвелла. Распределение молекул по скоростям.
- •Барометрическая формула.
- •Распределение Больцмана.
- •6.2. Число степеней свободы. Распределение энергии по степеням свободы. Явление переноса. Принцип распределения энергии по степеням свободы.
- •Явления переноса.
- •Цикл Карно. Теорема Карно.
- •Теорема Карно.
- •Понятие энтропии.
- •Неравенство Клазиуса.
- •Статистический смысл энтропии.
- •Вопросы для самоконтроля
- •Содержание
5.2. I начало термодинамики. Теплота, работа и внутренняя энергия.
Теплоемкости газа. Применение I начала к изопроцессам.
Адиабатический и политропический процессы.

![]()
S
![]()
Сосуд
с газом, закрыт поршнем. Под действием
силы
![]() ,
поршень площадью S переместится на
,
поршень площадью S переместится на
![]() .
.
![]()
![]()
Работа при изотермическом расширении от объема V1 до V2.
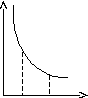 P
P
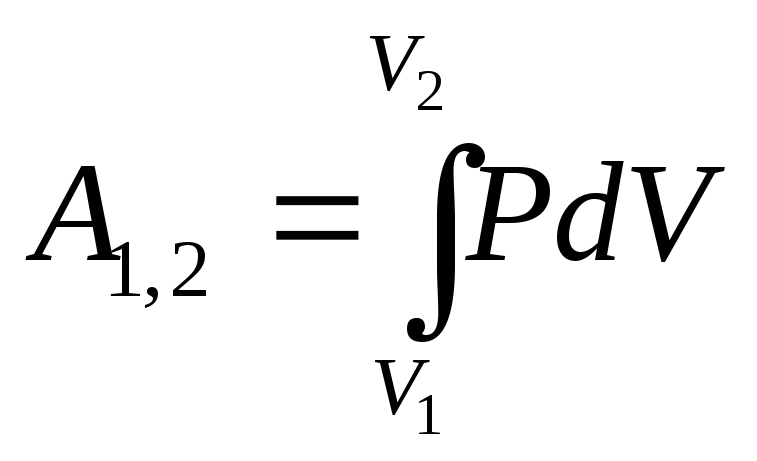
![]()
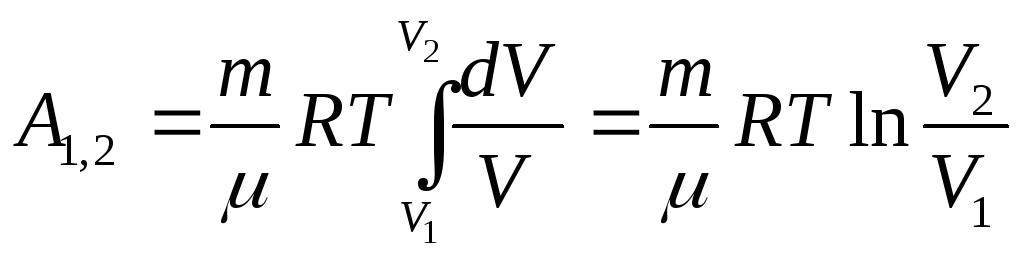
V1 V2 V
Геометрический смысл А – площадь под кривой.
Р абота
при изобарном процессе.
абота
при изобарном процессе.
P
![]()



P1
V1 V2 V
Работа при изохорном процессе А = 0, ΔV = 0.
Теплоемкость идеального газа.
Введём понятие теплоёмкости газа. Различают удельную и молярную теплоёмкости.
Под удельной теплоёмкостью с уд какого-либо вещества понимают физическую величину, численно равную количеству теплоты, которое нужно сообщить единице массы этого вещества, чтобы нагреть её на 1К.
Под молярной теплоёмкостью Смол вещества подразумевают физическую величину, численно равную количеству теплоты, которое нужно сообщить 1 молю вещества, чтобы нагреть его на 1К.
Внутренняя энергия газа.
Если имеется газ, то каждая молекула движется с некоторой скоростью, следовательно, обладает некоторой кинетической энергией. Если молекулы обладают конечными размерами, то они могут вращаться, следовательно, обладают кинетической энергией вращения и обладают потенциальной энергией взаимодействия друг с другом.
Таким образом, внутренняя энергия представляет собой сумму кинетических энергий поступательного движения всех молекул, кинетических энергий вращательного движения всех молекул, а также потенциальных энергий взаимодействия всех молекул.
Идеальный газ.(молекулы – материальные точки и не взаимодействуют друг с другом).
Следовательно, внутренняя энергия определяется только кинетической энергией поступательного движения всех молекул.
U~T оказывается, чем больше Т, тем быстрее движутся молекулы.
![]()
I начало термодинамики.
Количество теплоты, переданное системе, затрачивается на увеличение ее внутренней энергии и на совершение системой работы над внешними телами.
![]()
Различают удельную и молярную теплоёмкости.
Молярная теплоёмкость газа при изохорном процессе равна
![]() .
.
В случае изобарного процесса первое начало термодинамики запишется так:
![]() .
.
Подводимое к газу тепло частично тратится на увеличение его внутренней энергии, а частично – на совершение работы. Молярная теплоёмкость при изобарном процессе равна
![]()
Но первое слагаемое от вида процесса не зависит и равно CV и, следовательно,
![]()
Принимая во внимание уравнение Клапейрона-Менделеева, получим
![]()
Таким образом, молярная теплоёмкость газа при постоянном давлении больше его молярной теплоёмкости при постоянном объёме на величину универсальной газовой постоянной R.
Если в газе происходит изотермический процесс, то dU = 0 и
![]() .
.
Подводимое к газу при изотермическом процессе тепло целиком превращается в работу расширения. Теплоёмкость газа при изотермическом процессе становится бесконечно большой.
Рассмотрим газ при комнатной температуре. Есть поступательные и вращательные степени свободы.
Пусть у молекулы есть i степеней свободы.
![]() -
энергия всех молекул в 1 моле газа
-
энергия всех молекул в 1 моле газа
![]()
![]()
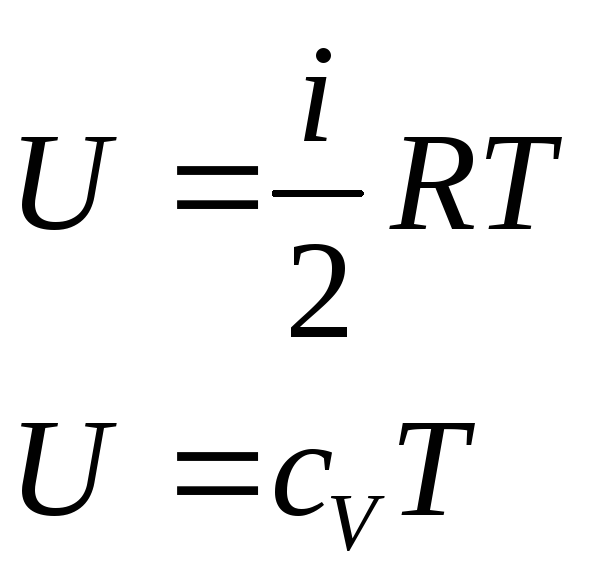 -
внутренняя энергия газа
-
внутренняя энергия газа
![]()
![]()
![]()
![]()
Следовательно, γ определяется числом и характером степеней свободы.
![]() .
.
|
Молекула |
Характер связи |
с |
i |
cV |
cP |
γ | ||
|
пост. |
вр. |
кол. | ||||||
|
1 - атомная |
- |
3 |
- |
- |
3 |
|
|
1.67 |
|
2-х - атомная |
Жесткая |
3 |
2 |
- |
5 |
|
|
1.4 |
|
|
Упругая |
3 |
2 |
1 |
7 |
|
|
1.29 |
|
>3 ат. |
жесткая |
3 |
3 |
- |
6 |
|
|
1.3 |
