
- •1.Строение и свойства моносахаридов.
- •2.Происхождение (синтез) углеводов на Земле. Моносахариды и их биологическая роль.
- •3.Производные моносахаридов. Олигосахариды.
- •4.Полисахариды (гликаны). Гетерополисахариды (гетерогликаны). Их значение.
- •5.Классификация липидов. Жирные кислоты. Нейтральные липиды.
- •6.Фосфолипиды. Сфинголипиды.
- •7.Общая характеристика белков. Элементарный состав белков и содержание их в тканях и органах.
- •8.Гидролиз белков. Аминокислоты. Общие свойства аминокислот.
- •10.Связи аминокислот в молекуле белка. Строение белковых молекул.
- •11.Физико-химические свойства белков. Молекулярная масса белков.
- •12.Методы осаждения и коагуляции белков. Денатурация белков.
- •13.Классификация белков. Простые белки. Сложные белки – протеиды.
- •14.Белки-ферменты. Состав нуклеиновых кислот.
- •15.Структура мононуклеотидов. Состав и структура рибонуклеиновых кислот.
- •16.Информационная рнк. Транспортная рнк. Рибосомальная рнк.
- •17.Общая характеристика витаминов. Классификация и номенклатура витаминов.
- •18.Жирорастворимые витамины.
- •19.Водорастворимые витамины. Их биологическая роль.
- •20.Общие сведения о ферментах. Молекулярная организация ферментов.
- •21.Регуляця активности ферментов. Механизм действия ферментов.
- •22. Общая характеристика действия ферментов. Общие свойства ферментов.
- •24.Механизм действия гормонов. Гормоны щитовидной железы.
- •25.Гормноы паращитовидной железы. Гормоны поджелудочной железы.
- •26.Гормоны надпочечников. Гормоны мозгового слоя надпочечников.
- •27.Гормоны коры надпочечников. Гормоны половых желёз.
- •28.Гормоны гипофиза. Эпифиз. Гормоны гипоталамуса.
- •29.Пути превращения энергии в организме. Методы изучения обмена веществ.
- •30.Дыхательный коэффициент. Метод балансовых опытов.
- •31.Изотопный метод. Методы изолированных органов.
- •32.Теория биологического окисления и окислительно-восстановительный потенциал.
- •33.Окислительные ферменты и транспорт электронов. Дыхательная цепь.
- •34.Механизм обезвреживания (нейтрализации) аммиака в организме животных.
- •35.Значение углеводов для организма животного. Переваривание углеводов.
- •36.Регуляция обмена гликогена. Окисление углеводов.
- •37.Механизм анаэробного расщепления углеводов в тканях животного (гликогенолиз, гликолиз).
- •39.Переваривание и всасывание жиров. Окисление жирных кислот.
- •40.Биосинтез липидов. Биосинтез холестерола.
- •41.Биологическая ценность белка.
- •42.Нормы белка и аминокислот в питании животных. Белковые резервы организма. Обмен простых белков.
- •43.Переваривание белков в желудочно-кишечном тракте моногастричных животных.
- •44.Всасывание продуктов гидролиза белковых веществ.
- •45.Особенности переваривания белков у жвачных животных.
- •46.Распад белков в тканях и его биологическое значение.
- •47)Биосинтез аминокислот в организме.
- •48)Пути использования свободных аминокислот.
- •49)Биосинтез белков. Современные представления о процессе биосинтеза белков.
- •50)Основные этапы биосинтеза белка и его регуляция.
- •51)Биосинтез белков в митохондриях. Дезаминирование аминокислот.
- •52)Биосинтез нуклеиновых кислот. Особенности обмена белков у птиц.
- •53)Некоторые вопросы патологии обмена белков и аминокислот.
- •54)Связь между обменом белков и нуклеиновых кислот, углеводов, липидов
- •55. Вода, ее содержание и роль в организме. Регуляция водного обмена.
- •56. Потребность животного организма в минеральных веществах, их поступление и выделение.
- •57. Физико-химические свойства крови. Буферные системы крови.
- •58. Плазма крови и ее химический состав.
- •59. Форменные элементы крови. Лимфа. Биологическое значение.
- •60. Белки мышц. Роль актино-миозинового комплекса.
12.Методы осаждения и коагуляции белков. Денатурация белков.
Под
коагуляцией понимают сближение и
склеивание белковых частиц, в результате
чего увеличивается их размер, и они
легко выпадают в осадок. Явление
коагуляции может быть обратимым, когда
при устранении факторов коагуляции
белок-коллоид может снова возвратиться
к своему первоначальному состоянию.
При подогревании растворов белка выше
 С большинство белков коагулирует,
особенно легко этот процесс протекает
в изоэлектрической точке. При этом
разрушается гидратационная оболочка
белковой частицы, и третичная структура
молекулы белка теряет гидрофильность,
становится гидрофобной и легко осаждается.
Соли тяжёлых металлов (Си,Pb,
Ag)
в небольших концентрациях способны
вызывать коагуляцию белков в их растворах.
Коагуляция белков как под давлением
ионов тяжёлых металлов, так и под
действием высокой температуры – процесс
необратимый. Коагуляцию белка можно
вызвать с помощью концентрированных
растворов некоторых минеральных кислот
(азотная, серная, соляная). Механизм
действия этих веществ сводится к
подавлению электрического заряда,
дегидратации и частичного гидролиза
белковой частицы. Под влиянием солей
щелочных металлов (NaCl,
С большинство белков коагулирует,
особенно легко этот процесс протекает
в изоэлектрической точке. При этом
разрушается гидратационная оболочка
белковой частицы, и третичная структура
молекулы белка теряет гидрофильность,
становится гидрофобной и легко осаждается.
Соли тяжёлых металлов (Си,Pb,
Ag)
в небольших концентрациях способны
вызывать коагуляцию белков в их растворах.
Коагуляция белков как под давлением
ионов тяжёлых металлов, так и под
действием высокой температуры – процесс
необратимый. Коагуляцию белка можно
вызвать с помощью концентрированных
растворов некоторых минеральных кислот
(азотная, серная, соляная). Механизм
действия этих веществ сводится к
подавлению электрического заряда,
дегидратации и частичного гидролиза
белковой частицы. Под влиянием солей
щелочных металлов (NaCl,
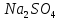 )
происходит обратимая коагуляция и
осаждение белков, которое называется
высаливанием. Механизм этой коагуляции
состоит в том, что приведённые электролиты
нейтрализуют электрический заряд
коллоидных частиц белка и, как сильные
водоотнимающие средства, разрушают их
гидратационную оболочку. Под влиянием
высоких или низких температур, изменений
рН, действия ионов тяжёлых металлов и
некоторых химических веществ в молекулах
белков происходят изменения, называемые
денатурацией. Наиболее ярким проявлением
денатурации глобулярных белков является
уменьшение их растворимости и выпадение
в осадок. У многих белков денатурация
наступает в результате нагревания их
до 50-60 С, а некоторые белки денатурируют
при охлаждении до температуры ниже
10-15 С. При денатурации белки теряют свою
биологическую активность.
)
происходит обратимая коагуляция и
осаждение белков, которое называется
высаливанием. Механизм этой коагуляции
состоит в том, что приведённые электролиты
нейтрализуют электрический заряд
коллоидных частиц белка и, как сильные
водоотнимающие средства, разрушают их
гидратационную оболочку. Под влиянием
высоких или низких температур, изменений
рН, действия ионов тяжёлых металлов и
некоторых химических веществ в молекулах
белков происходят изменения, называемые
денатурацией. Наиболее ярким проявлением
денатурации глобулярных белков является
уменьшение их растворимости и выпадение
в осадок. У многих белков денатурация
наступает в результате нагревания их
до 50-60 С, а некоторые белки денатурируют
при охлаждении до температуры ниже
10-15 С. При денатурации белки теряют свою
биологическую активность.
13.Классификация белков. Простые белки. Сложные белки – протеиды.
По химическому строению белки разделяются на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот, а сложные при гидролизе распадаются на аминокислоты и различные вещества небелкового характера. К группе простых белков относят альбумины, глобулины, гистоны, протамины, протеиноиды, глютелины и проламины. Альбумины – наиболее распространённая группа белков, они встречаются во всех тканях животных и растений, хорошо растворимы в воде и ненасыщенных солевых растворах. Глобулины – наиболее многочисленная группа белков в организме животных. Гистоны – группа ядерных белков, в состав молекул которых входит от 20 до 30% диаминомонокарбоновых кислот (лизин, аргинин) и циклической аминокислоты – гистидина. Гистоны в значительной степени обусловливают уникальную структуру ДНК и дезоксинуклеопротеидов в ядре, что служит необходимым условием для биосинтеза белков. Протамины – белки, отличающиеся высоким содержанием диаминомонокарбоновых кислот (от 50 до 80%). Протамины, как и гистоны, составляют белковую часть нуклеопротеидов. Протеиноиды – белки опорных тканей – костей, хрящей, сухожилий, связок, шерсти, волос, копыт. Проламины – группа белков растительного происхождения, встречаются главным образом в семенах злаков. Отличительной чертой проламинов является хорошая растворимость в 60-80% этиловом спирте. Глютелины – большая группа белков растительного происхождения, которые растворимы только в слабых растворах щелочей (0,2%). Их обнаруживают вместе с проламинами в семенах злаковых растений.К группе сложных белков относят: нуклеопротеиды, хромопротеиды, фосфопротеиды, гликопротеиды, липопротеиды, металлопротеиды и белки ферменты. Нуклеопротеиды построены из простого белка и нуклеиновых кислот. Белки, входящие в состав нуклеопротеидов, чаще всего представлены гистонами и протаминами. Хромопротеиды построены из простого белка и какого-либо окрашенного соединения небелкового характера. Фосфопротеиды построены из простого белка и остатков фосфорной кислоты. Гликопротеиды – группа сложных белков, которые построены из простого белка и небелковой части, состоящей из углеводов, производных углеводов (гексуроновые кислоты), серной и уксусной кислот.
Липопротеиды представляют собой различные комплексы простых белков с глицеридами, фосфолипидами и стеридами.
