
- •1.Строение и свойства моносахаридов.
- •2.Происхождение (синтез) углеводов на Земле. Моносахариды и их биологическая роль.
- •3.Производные моносахаридов. Олигосахариды.
- •4.Полисахариды (гликаны). Гетерополисахариды (гетерогликаны). Их значение.
- •5.Классификация липидов. Жирные кислоты. Нейтральные липиды.
- •6.Фосфолипиды. Сфинголипиды.
- •7.Общая характеристика белков. Элементарный состав белков и содержание их в тканях и органах.
- •8.Гидролиз белков. Аминокислоты. Общие свойства аминокислот.
- •10.Связи аминокислот в молекуле белка. Строение белковых молекул.
- •11.Физико-химические свойства белков. Молекулярная масса белков.
- •12.Методы осаждения и коагуляции белков. Денатурация белков.
- •13.Классификация белков. Простые белки. Сложные белки – протеиды.
- •14.Белки-ферменты. Состав нуклеиновых кислот.
- •15.Структура мононуклеотидов. Состав и структура рибонуклеиновых кислот.
- •16.Информационная рнк. Транспортная рнк. Рибосомальная рнк.
- •17.Общая характеристика витаминов. Классификация и номенклатура витаминов.
- •18.Жирорастворимые витамины.
- •19.Водорастворимые витамины. Их биологическая роль.
- •20.Общие сведения о ферментах. Молекулярная организация ферментов.
- •21.Регуляця активности ферментов. Механизм действия ферментов.
- •22. Общая характеристика действия ферментов. Общие свойства ферментов.
- •24.Механизм действия гормонов. Гормоны щитовидной железы.
- •25.Гормноы паращитовидной железы. Гормоны поджелудочной железы.
- •26.Гормоны надпочечников. Гормоны мозгового слоя надпочечников.
- •27.Гормоны коры надпочечников. Гормоны половых желёз.
- •28.Гормоны гипофиза. Эпифиз. Гормоны гипоталамуса.
- •29.Пути превращения энергии в организме. Методы изучения обмена веществ.
- •30.Дыхательный коэффициент. Метод балансовых опытов.
- •31.Изотопный метод. Методы изолированных органов.
- •32.Теория биологического окисления и окислительно-восстановительный потенциал.
- •33.Окислительные ферменты и транспорт электронов. Дыхательная цепь.
- •34.Механизм обезвреживания (нейтрализации) аммиака в организме животных.
- •35.Значение углеводов для организма животного. Переваривание углеводов.
- •36.Регуляция обмена гликогена. Окисление углеводов.
- •37.Механизм анаэробного расщепления углеводов в тканях животного (гликогенолиз, гликолиз).
- •39.Переваривание и всасывание жиров. Окисление жирных кислот.
- •40.Биосинтез липидов. Биосинтез холестерола.
- •41.Биологическая ценность белка.
- •42.Нормы белка и аминокислот в питании животных. Белковые резервы организма. Обмен простых белков.
- •43.Переваривание белков в желудочно-кишечном тракте моногастричных животных.
- •44.Всасывание продуктов гидролиза белковых веществ.
- •45.Особенности переваривания белков у жвачных животных.
- •46.Распад белков в тканях и его биологическое значение.
- •47)Биосинтез аминокислот в организме.
- •48)Пути использования свободных аминокислот.
- •49)Биосинтез белков. Современные представления о процессе биосинтеза белков.
- •50)Основные этапы биосинтеза белка и его регуляция.
- •51)Биосинтез белков в митохондриях. Дезаминирование аминокислот.
- •52)Биосинтез нуклеиновых кислот. Особенности обмена белков у птиц.
- •53)Некоторые вопросы патологии обмена белков и аминокислот.
- •54)Связь между обменом белков и нуклеиновых кислот, углеводов, липидов
- •55. Вода, ее содержание и роль в организме. Регуляция водного обмена.
- •56. Потребность животного организма в минеральных веществах, их поступление и выделение.
- •57. Физико-химические свойства крови. Буферные системы крови.
- •58. Плазма крови и ее химический состав.
- •59. Форменные элементы крови. Лимфа. Биологическое значение.
- •60. Белки мышц. Роль актино-миозинового комплекса.
10.Связи аминокислот в молекуле белка. Строение белковых молекул.
Аминокислоты,
являющиеся структурными элементами
белковой молекулы, образуют между
отдельными аминокислотами в белковой
молекуле различные типы связи: ковалентные,
водородные, ионные, дисульфидные,
сложноэфирные связи и гидрофобные
взаимодействия аминокислот. Пептидная
связьобразуется
при взаимодействии карбоксильной группы
(-СООН) одной аминокислоты с аминной
группой (-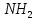 )
другой аминокислоты. Образующиеся при
этом соединения стали называть пептидами
или полипептидами. Дисульфидными
связями
могут соединяться остатки аминокислот
в одной полипептидной цепи особенно
тогда, когда цепь образует определённые
завитки и спирали. Эти связи скрепляют
ту специфическую укладку полипептидной
цепи, которая возникает в определённых
условиях биосинтеза и существования
белка. Водородная
связьвозникает
между протоном водорода и каким-либо
электроотрицательным атомом, который
содержит неподелённые электронные
пары. Ионные
связи
объединяют витки полипептидных цепей.
Гидрофобное
взаимодействие. Этот
вид связи возникает в результате
сближения неполярных углеводородных
радикалов аминокислот. Основу строения
белка составляет полипептидная цепь,
а молекула белка может состоять из
одной, двух или нескольких цепей.
Различают четыре порядка организации
молекул белка – первичная, вторичная,
третичная и четвертичная структуры.
Под первичной структурой белка понимают
полипептидную цепь, расположенную в
плоскости и имеющую определённый набор
аминокислот в известных количествах и
соотношениях, а также неповторимый для
каждого белка порядок чередования
остатков аминокислот в цепи. Под вторичной
структурой белка подразумевают
конфигурацию полипептидной цепи, т.е.
способ свёртывания, скручивания
полипептидной цепи в спиральную или
какую-либо другую конформацию. Под
третичной структурой понимают укладку
спиралевидной полипептидной цепочки
в пространстве в виде клубков разной
формы и величины. Четвертичная структура
представляет собой ассоциацию двух или
большего числа белков с третичной
структурой в одну большую молекулу.
)
другой аминокислоты. Образующиеся при
этом соединения стали называть пептидами
или полипептидами. Дисульфидными
связями
могут соединяться остатки аминокислот
в одной полипептидной цепи особенно
тогда, когда цепь образует определённые
завитки и спирали. Эти связи скрепляют
ту специфическую укладку полипептидной
цепи, которая возникает в определённых
условиях биосинтеза и существования
белка. Водородная
связьвозникает
между протоном водорода и каким-либо
электроотрицательным атомом, который
содержит неподелённые электронные
пары. Ионные
связи
объединяют витки полипептидных цепей.
Гидрофобное
взаимодействие. Этот
вид связи возникает в результате
сближения неполярных углеводородных
радикалов аминокислот. Основу строения
белка составляет полипептидная цепь,
а молекула белка может состоять из
одной, двух или нескольких цепей.
Различают четыре порядка организации
молекул белка – первичная, вторичная,
третичная и четвертичная структуры.
Под первичной структурой белка понимают
полипептидную цепь, расположенную в
плоскости и имеющую определённый набор
аминокислот в известных количествах и
соотношениях, а также неповторимый для
каждого белка порядок чередования
остатков аминокислот в цепи. Под вторичной
структурой белка подразумевают
конфигурацию полипептидной цепи, т.е.
способ свёртывания, скручивания
полипептидной цепи в спиральную или
какую-либо другую конформацию. Под
третичной структурой понимают укладку
спиралевидной полипептидной цепочки
в пространстве в виде клубков разной
формы и величины. Четвертичная структура
представляет собой ассоциацию двух или
большего числа белков с третичной
структурой в одну большую молекулу.
11.Физико-химические свойства белков. Молекулярная масса белков.
Размер и молекулярная масса, растворимость и электрический заряд, денатурация и другие физико-химические свойства белков в значительной мере определяют участие их в процессах обмена веществ и функциях живой системы. Белки, растворяясь в воде, всегда дают даже в молекулярно-дисперсном состоянии коллоидные растворы (золи). Для растворов белковых веществ характерен эффект Фарадея-Тиндаля. Если узкий пучок света пропустить через раствор белка, то путь луча становится хорошо заметным (клин Тиндаля) в результате рассеивания света частицами растворённого вещества (молекулами и агрегатами молекул белка). Для растворов белковых веществ характерны явления опалесценции, возникающие в проходящем свете вследствие его дифракции. Белки относятся к высокомолекулярным соединениям, так как в их состав входят десятки, сотни и тысячи аминокислотных остатков, сотни тысяч и миллионы атомов, связанных друг с другом различными типами связей. Молекулярная масса белков определяется по химическому составу, осмотическому давлению их растворов, ультрацентрифугированием, методом светорассеяния и хроматографии, основанной на принципе молекулярных сит (гель-фильтрация).
