
- •1.Электромагниттік сәуленің табиғаты және оның негізгі сипаттамалары, эмс спектрі
- •3. Атомдық спектр. Спектрлік сызықтардың толқын ұзындықтарын анықтау әдістері.
- •4. Атомдық спектрларді заттың химиялық құрамын анықтау үшін қолдану.
- •5. Жылулық шығарылған сәуле және оның сипаттамалары. Қара дене.
- •7.Жарық кванттары жайындағы Эйнштейн гипотезасы
- •12.Фотондар. Фотонның энергиясы, импульсы,массасы.
- •14. Микробөлшектердің толқындық қасиеттерінің тәжірибелік расталуы ( Дэвиссон мен Джермер, Томсон, Тартаковский тәжірибелері).
- •1.Кванттық механикада бөлшек траекториясы ұғымы мағынасын жояды.
- •2. Микробқлшектің толық тыныштық күйде болуы мүмкін еместігі.
- •3.Анықталмағандықтар қатынастарынан шығатын тағы бір қорытынды:бөлшектің толқындық қасиеттерін ескергенде бөлшектің толық энергиясын кинетикалық және потенциалдық энергияға бөлудің мағынасы жойылады.
- •16. Резерфорд тәжірибелері. Атомның құрылысы.
- •17.Атомның ядролық моделі, оның классикалық физика заңдарымен үйлеспеуі.
- •20 Ғ бас кезінде ешқандай күмәнсыз бар екендігі мойындалды.
- •18. Атомдық спектрлер.Сериялық заңдылықтар. Спектрлік терм. Комбинация принципі.
- •25.Бор теориясының кемшілігі
- •26.Спектрлік сызықтардың изотоптық ығысуы. Сутегі атомы мен сутегі тәрізді иондардың жиіліктері үшін формулалар мына түрге келеді
- •31. Бір электрондық атомдық жүйелер үшін Шредингер теңдеуі және атомның квантталуы.
- •32.Бір электронды атомның кванттық сандары және бұлардың физикалық мағынасы.
- •1.Атомдық жүйелердің ең қарапайымы бір электрондық атомдар: н,,,…; мезоатомдар, позитроний.
- •33. Бір электронды атомның толқындық функциялары. Энергия деңгейлерінің азғындау дәрежесі.
- •34.Күйлердің белгіленуі. Сұрыптау ережелері і.
- •35. Сутегі атомының энергетикалық спектрі. Шығару және жұтылу спектрі.
- •45.Ядро спині.Атомның энергия деңгейлерінің және спектрлік сызықтарының аса нәзік түзілісі.
- •I және j берілген жағдайда векторының абсолют шамасы
- •49.Рентген түтікшесінің антикатодын электрондармен атқылағанда пайда болатын рентгендік спектрлердің екі түрі болады:тұтас және сызықтық.
- •53.Қарапайым Зееман эффекті.
- •57. Екі атомды молекуланың айналысы, айналыс спектрі.
- •58.Екі атомды молекуланың тербелісі
18. Атомдық спектрлер.Сериялық заңдылықтар. Спектрлік терм. Комбинация принципі.
Берілген дене шығаратын электромагниттік сәуле жиіліктерінің жиыны шығару спектрі деп аталады. Өзара бірімен бірі әсерлеспейтін, еркін атомдардың спектрі жеке толқын ұзындықтардан, яғни жеке спектрлік сызықтардың белгілі жиынтықтарынан тұратын сызықтық спектр береді. Ең қарапайым спектр сутегі атомының спектрі. Спектрдің көрінетін бөлігінде сутегінің тек 4 сызығы бар, олар Нᵅ, Нᵦ, Нᵞ және Нᵟ сызықтары. Бұл сызықтардың аралығы спектрдің қысқа толқындық шетіне қарай кемиді. Осы сызықтардың толқын ұзындықтарын 1 формуламен өте дәл өрнектеуге болады. Оны 1885 ж. ең алғаш Швейцариялық ғалым И. Бальмер (1825-1898) тағайындаған:
 (1)
(1)
табуға болатындығын тапты; мұндағы В=364,6 нм, ал n=3,4,5,... бүтін мәндерiн қабылдайды. (1) формуланы Швед ғалымы И.Ридберг (1890) басқа түрде жазуды ұсынды:
 , (2)
, (2)
мұндағы
 -спектрлiк
сызықтың толқындық саны, см-1,
-толқын
ұзындығы, R-тұрақты
шама, Ридберг тұрақтысы деп аталады;
n=3,4,5,...
(2) формула өте жоғары дәлдiкпен тәжiрибеге
сәйкес келетiн нәтижелер бередi.
-спектрлiк
сызықтың толқындық саны, см-1,
-толқын
ұзындығы, R-тұрақты
шама, Ридберг тұрақтысы деп аталады;
n=3,4,5,...
(2) формула өте жоғары дәлдiкпен тәжiрибеге
сәйкес келетiн нәтижелер бередi.
32
Бальмер формуласын қамтитын сутегi атомының спектрлiк сызықтар тобы Бальмер сериясы деп аталады.Сутегi атомы спектрiнде Бальмер сериясына жататын сызықтардан басқа сызықтар да бар. Олар бiрнеше серия құрайды.
Спектрдiң ультракүлгін бөлiгiндегi бiр топ сызықтар Лайман (1906) сериясы деп аталады:
 n=2,3,4,...
n=2,3,4,...
Сутегi спектрiнiң жақын инфрақызыл бөлiгiнде Пашен (1908) сериясы деп аталатын бiр топ сызық бар. Бұлар мына формуламен өрнектеледi:
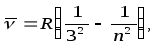 n=4,5,6,...
n=4,5,6,...

Спектрлiк терм. Комбинациялық принцип. Атомдардың сызықтық спектрлерiн зерттеу нәтижелерiне сүйенiп, Ридберг (1889) берiлген серияның барлық сызықтарының толқындық сандары (жиiлiктерi) мына қатынасты
 (4)
(4)
қанағаттандырады
деген қорытынды жасады; мұндағы m-тұрақты,
серияны анықтайтын тұрақты мәнге ие
сан, ал n
cанының өзгерiсi
(n=m+1, m 2,...)
берiлген серияның барлық сызықтарын
бередi; Т(m),
Т(n)-спектрлiк
термдер. Сутегi атомының (3) сериялық
формуласымен салыстырудан спектрлiк
термдердiң тиiсiнше мына қатынастарға
2,...)
берiлген серияның барлық сызықтарын
бередi; Т(m),
Т(n)-спектрлiк
термдер. Сутегi атомының (3) сериялық
формуласымен салыстырудан спектрлiк
термдердiң тиiсiнше мына қатынастарға
Т(m)=R/m2 және Т(n)=R/n2 (5)
тең болатындығы келiп шығады.
1908 ж. Ритц тәжiрибелiк деректердi қорыту нәтижесiнде комбинациялық принцип деп аталатын ереже ұсынды. Осы ережеге сәйкес, кез-келген атомның шығару спектрiндегi барлық сызықтарды спектрлiк термдердiң (4) комбинациясы түрінде өрнектеуге болады.
19. Бор постулаттары. Атомның Резерфорд ұсынған планетаралық моделінің мүлдем орнықсыздығын және сонымен бірге атомдық спектрлердегі таңғаларлық сериялық заңдылыққа,бұлардың дискреттілігіне сүйеніп Н.Бор 1913ж.кванттық физиканың екі маңызды постулатын тұжырымдауды қажет деп тапты.
1)Атом ұзақ уақыт бойы тек кейбір белгілі,стационарлық деп аталатын күйлерде бола алады;осы күйлер E1,E2,E3,…дискретті энергия мәндерімен сипатталады.Осы күйлерде атом,классикалық электродинамикаға қарамастан,жарық шығармайды.
2)Атом E2 энергиясы үлкенірек стационарлық күйден E1 энергиясы кішірек стационарлық күйге ауысқанда энергиясы ħw жарық квантын (фотонды) шығарады:
ħw= E2ˉ E1
Дәл осындай қатынас түсетін фотон атомды E1 төменгі энергетикалық деңгейден E2 жоғарырақ деңгейге ауыстыратын,ал фотонның өзі жойылатын,жұтылу жағдайында да орындалады.
ħw= E2ˉ E1 қатынас Бордың жиіліктер шарты деп аталады.Атомның жоғарырақ энергетикалық деңгейлерге ауысулары басқа атомдармен соқтығысуынан да бола алады.
Сонымен,атом бір стационарлық күйден басқасына секірмелі түрде ауысады,бұларды кванттық ауысулар деп атайды.

21. Сутегі атомының Бор ұсынған модульі
Н.Бор сутегі атомының бүкіл спектрін өте жақсы түсіндіретін және де атом құрылысының физикалық моделі негізіне алынған теория ұсынды. Бор моделіне сәйкес атомдағы электрондар ядроны орнықты дөңгелек орбилалар бойынша айналып жүреді. Осы орбиталарға екінші басқа орбитаға секіріп, электрондар энергияны қабылдап немесе жоғалта алады.
Бор теориясында сызықтық спектрдің эмперикалық заңдылықтары, Резерфордтың ядролық моделі және жарықтың шығарылуы және жұтылуының кванттық сипаты біртұтас біріктірілді.
Сутегі атомының энергетикалық спектрі
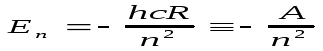
сутегі
атомынында
электрон қозғалысын қарастырсақ Кулондық
күш әсерінен шеңбер бойымен электрон
қозғалады ,
, -электрон
массасы,
-электрон
массасы, –орбитадағы радиусы,
–орбитадағы радиусы,
 -жылдамдығы
-жылдамдығы
 (n=1,
2, 3,...)(*) бұл
өрнек Бор ұсынған модельі орбиталар
радиусын анықтайды n=1
ең жақын ядроға
(n=1,
2, 3,...)(*) бұл
өрнек Бор ұсынған модельі орбиталар
радиусын анықтайды n=1
ең жақын ядроға
 -Бор
радиусы. Ол сутегі атомының ең кіші
-Бор
радиусы. Ол сутегі атомының ең кіші
 нм
орбита мөлшерін анықтайды.
rn=n2r1
, яғни стационарлық күйлер үшін орбиталар
радиустары квантталған r1,
4r1, 9r1,...мәндерге
тең.
нм
орбита мөлшерін анықтайды.
rn=n2r1
, яғни стационарлық күйлер үшін орбиталар
радиустары квантталған r1,
4r1, 9r1,...мәндерге
тең.
 (*)ескерсек
(*)ескерсек
 (n=1,
2, 3,...) тек дискретті мәндер қабылдайды.
(n=1,
2, 3,...) тек дискретті мәндер қабылдайды.
22.Сутегі
атомының энергия деңгейлерінің
диаграммасы.
Еn энергия деңгейлерінің орналасу
заңдылығы сутегі атомында ең
қарапайым.Сутегі атомының термі T(m)=R⁄m²
жәнеT(n)=R⁄n² формуласымен өрнектеледі.Демек
энергия мәндерінің дискретті жиыны (2) n=3,4,5…..
(2) n=3,4,5…..
Мұндағы
 спектрлік сызықтың толқындық саны c
спектрлік сызықтың толқындық саны c ,
, толқын ұзындығы, R-Ридберг тұрақтысы.
толқын ұзындығы, R-Ридберг тұрақтысы.
Бальмер формуласын қамтитын сутегі атомының спектрлік сызықтарының тобы Бальмер сериясы д.а.
(2) формуланы қамтитын сутегі атомының спектрлік сызықтар тобы Бальмер сериясы д.а. осы формулаға қарағанда n-нің мәні ұлғайған сайын көршілес сызықтардың толқын ұзындық айырмасы кеми береді,спектрлік сызықтар арасы жақындай тұседі.
Сутегі атомы спектрінде Бальмер сериясына жататын сызықтардан басқа сызықтар да бар. Олар бірнеше серия құрайды.
Спектрдің ультракүлгін бөлігіндегі бір топ сызықтар Лайман сериясы д.а.:
 n=2,3,4….
n=2,3,4….
Сутегі спектрінің жақын инфрақызыл бөлігінде Пашен сериясы деп аталатын бір топ сызық бар:
 n=4,5,6…..
n=4,5,6…..
Бұдан
басқа спектрдің алыс инфрақызыл бөлігінде
үш серия бар. Олар: Брэкет сериясы, Пфунд
сериясы, Хэмфри сериясы. Сонымен сутегі
атомының барлық спектрлік сызықтарын
былай анықтаймыз:
Сутегі
атомының энергетикалық спектрі мына
формуламен анықталады:

Мұндағы
 энергетикалық тұрақты;1,2,3,….
энергетикалық тұрақты;1,2,3,…. мәндерін қабылдайтын n саны бас кванттық
сан деп аталады. Ол сутегі атомының
энергия деңгейлерін қабылдайды.
Энергияның теріс таңбалары болуы
атомдағы электронның байланысқан күйде
тұрғандығын көрсетеді.
мәндерін қабылдайтын n саны бас кванттық
сан деп аталады. Ол сутегі атомының
энергия деңгейлерін қабылдайды.
Энергияның теріс таңбалары болуы
атомдағы электронның байланысқан күйде
тұрғандығын көрсетеді.
23. Сутегі тәрізді иондардың (He+,Li++т.б.)спектрлік сериялары.
Ең
қарапайым спектр сутегі атомының
спектрі. Спектрдің көрінетін бөлігінде
сутектің тек төрт сызығы бар,олар
 сызықтары.
сызықтары.





Осы сызықтардың толқын ұзындықтарын бір формуламен өте дәл өрнектеуге болады. Оны ең алғаш Швейцариялық ғалым И.Бальмер тағайындаған:
 (1)
(1)
Мұндағы В=364,6нм, ал бүтін мәндерін қабылдайды. Швед ғалымы И.Ридберг формуланы басқа түрде жазуды ұсынды:
 (2)
n=3,4,5…..
(2)
n=3,4,5…..
Мұндағы
 спектрлік сызықтың толқындық саны c
спектрлік сызықтың толқындық саны c ,
, толқын ұзындығы, R-Ридберг тұрақтысы.
толқын ұзындығы, R-Ридберг тұрақтысы.
Бальмер формуласын қамтитын сутегі атомының спектрлік сызықтарының тобы Бальмер сериясы д.а.
(2) формуланы қамтитын сутегі атомының спектрлік сызықтар тобы Бальмер сериясы д.а. осы формулаға қарағанда n-нің мәні ұлғайған сайын көршілес сызықтардың толқын ұзындық айырмасы кеми береді,спектрлік сызықтар арасы жақындай тұседі.
Сутегі атомы спектрінде Бальмер сериясына жататын сызықтардан басқа сызықтар да бар. Олар бірнеше серия құрайды.Спектрдің ультракүлгін бөлігіндегі бір топ сызықтар Лайман сериясы д.а.:
 n=2,3,4….
n=2,3,4….
Сутегі спектрінің жақын инфрақызыл бөлігінде Пашен сериясы деп аталатын бір топ сызық бар:
 n=4,5,6…..
n=4,5,6…..
Бұдан
басқа спектрдің алыс инфрақызыл бөлігінде
үш серия бар. Олар: Брэкет сериясы, Пфунд
сериясы, Хэмфри сериясы. Сонымен сутегі
атомының барлық спектрлік сызықтарын
былай анықтаймыз:
Сутегі
атомының энергетикалық спектрі мына
формуламен анықталады: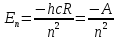
Мұндағы
 энергетикалық тұрақты;1,2,3,….
энергетикалық тұрақты;1,2,3,…. мәндерін қабылдайтын n саны бас кванттық
сан деп аталады. Ол сутегі атомының
энергия деңгейлерін қабылдайды.
Энергияның теріс таңбалары болуы
атомдағы электронның байланысқан күйде
тұрғандығын көрсетеді.
мәндерін қабылдайтын n саны бас кванттық
сан деп аталады. Ол сутегі атомының
энергия деңгейлерін қабылдайды.
Энергияның теріс таңбалары болуы
атомдағы электронның байланысқан күйде
тұрғандығын көрсетеді.
Сутегі
атомындағы электрон энергиясының ең
аз мәніне n=1 саны сәйкес келеді. Суретте
n=1 болатын күй негізгі,немесе қалыпты
күй,қалған күйлер қозған күйлер д.а.
Атом бір стационарлық күйден басқасына
ауысқан жағдайда энергиясы тиісті
стационарлық күйлер энергиясының
айырымына тең: шығарылады немесе жұтылады.
шығарылады немесе жұтылады.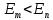 болған
жағдайда фотон шығарылады.
болған
жағдайда фотон шығарылады. болғанда фотон жұтылады. Мұмкін болатын
кванттық ауысуларға сәйкес келетін
дискреттік
болғанда фотон жұтылады. Мұмкін болатын
кванттық ауысуларға сәйкес келетін
дискреттік жиіліктер жиыны атомның сызықтық
спектрін анықтайды.
жиіліктер жиыны атомның сызықтық
спектрін анықтайды.


 =0
=0
 =0
=0
0

 =0
=0

 =0
=0
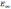
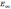 =0
=0

 =0
=0
Лайман сериясы
Бальмер сериясы
Пашен сер.
n=1
n=2![]()
n=3![]()
![]()
![]()
n=4
n=5
n=6


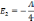
Li=2,Na=3,K=4
24 Cутегі атомының магниттік моменті. Бор магнетоны.Электрон радиусы r орбита бойымен v жылдамдықпен козғалатын болсын. Электрон орбитасын киып отетін аудан аркылы әр секунд сайын ev заряд тасымалданады, е-электрон заряды, v-электронның ядроны айналу жиілігі. Демек орбита бойынша козғалатын электрон дөңгелек тоққа пара пар.i=ev(1 сурет)

















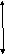
Ḹ
r
i
-e
→ µ
Осындай токтың магниттік моменті, аныктама бойынша, µ=iS немесе µ=evπr2. 2πrν=v болатыны ескерілгенде µ ушін өрнек мына турге келеді: µ=evr\2. Электронның импульс моменті L=mvr,сонда µ=-eL\2m, мундағы «-» таңбасы µ және L моменттерінің бағыттары өзара карама карсы екендігін нускайды. L векторы электронның орбиталық моменті деп аталады.
Бөлшектің магниттік моментінің оның механикалык моментіне катынасы гидромагниттік катынас деп аталады. Электрон ушін ол мынаған тен: µ\L=e\2m.(1)
Бордың кванттык шартына сәйкес L=ђn,осыны пайдаланғанда (1) өрнекті мына турде жазамыз: µ=µБ*n, n=1,2,…., мундағы µБ –Бор магнетоны.Ол мынаған тен болад µБ =ђe\2m=0,93*10-23Дж/Тл. Сонымен, электрон Бордың бірінші орбитасымен қозғалғанда оның магниттік моменті бір бор магнетонына тен болады.
