
- •1.Электромагниттік сәуленің табиғаты және оның негізгі сипаттамалары, эмс спектрі
- •3. Атомдық спектр. Спектрлік сызықтардың толқын ұзындықтарын анықтау әдістері.
- •4. Атомдық спектрларді заттың химиялық құрамын анықтау үшін қолдану.
- •5. Жылулық шығарылған сәуле және оның сипаттамалары. Қара дене.
- •7.Жарық кванттары жайындағы Эйнштейн гипотезасы
- •12.Фотондар. Фотонның энергиясы, импульсы,массасы.
- •14. Микробөлшектердің толқындық қасиеттерінің тәжірибелік расталуы ( Дэвиссон мен Джермер, Томсон, Тартаковский тәжірибелері).
- •1.Кванттық механикада бөлшек траекториясы ұғымы мағынасын жояды.
- •2. Микробқлшектің толық тыныштық күйде болуы мүмкін еместігі.
- •3.Анықталмағандықтар қатынастарынан шығатын тағы бір қорытынды:бөлшектің толқындық қасиеттерін ескергенде бөлшектің толық энергиясын кинетикалық және потенциалдық энергияға бөлудің мағынасы жойылады.
- •16. Резерфорд тәжірибелері. Атомның құрылысы.
- •17.Атомның ядролық моделі, оның классикалық физика заңдарымен үйлеспеуі.
- •20 Ғ бас кезінде ешқандай күмәнсыз бар екендігі мойындалды.
- •18. Атомдық спектрлер.Сериялық заңдылықтар. Спектрлік терм. Комбинация принципі.
- •25.Бор теориясының кемшілігі
- •26.Спектрлік сызықтардың изотоптық ығысуы. Сутегі атомы мен сутегі тәрізді иондардың жиіліктері үшін формулалар мына түрге келеді
- •31. Бір электрондық атомдық жүйелер үшін Шредингер теңдеуі және атомның квантталуы.
- •32.Бір электронды атомның кванттық сандары және бұлардың физикалық мағынасы.
- •1.Атомдық жүйелердің ең қарапайымы бір электрондық атомдар: н,,,…; мезоатомдар, позитроний.
- •33. Бір электронды атомның толқындық функциялары. Энергия деңгейлерінің азғындау дәрежесі.
- •34.Күйлердің белгіленуі. Сұрыптау ережелері і.
- •35. Сутегі атомының энергетикалық спектрі. Шығару және жұтылу спектрі.
- •45.Ядро спині.Атомның энергия деңгейлерінің және спектрлік сызықтарының аса нәзік түзілісі.
- •I және j берілген жағдайда векторының абсолют шамасы
- •49.Рентген түтікшесінің антикатодын электрондармен атқылағанда пайда болатын рентгендік спектрлердің екі түрі болады:тұтас және сызықтық.
- •53.Қарапайым Зееман эффекті.
- •57. Екі атомды молекуланың айналысы, айналыс спектрі.
- •58.Екі атомды молекуланың тербелісі
35. Сутегі атомының энергетикалық спектрі. Шығару және жұтылу спектрі.
Ең
қарапайым спектр сутегі атомының
спектрі. Спектрдің көрінетін бөлігінде
сутектің тек төрт сызығы бар,олар
 сызықтары.
сызықтары.





Осы сызықтардың толқын ұзындықтарын бір формуламен өте дәл өрнектеуге болады. Оны ең алғаш Швейцариялық ғалым И.Бальмер тағайындаған:
 (1)
(1)
Мұндағы В=364,6нм, ал бүтін мәндерін қабылдайды. Швед ғалымы И.Ридберг формуланы басқа түрде жазуды ұсынды:
 (2)
n=3,4,5…..
(2)
n=3,4,5…..
Мұндағы
 спектрлік сызықтың толқындық саны c
спектрлік сызықтың толқындық саны c ,
, толқын ұзындығы, R-Ридберг тұрақтысы.
толқын ұзындығы, R-Ридберг тұрақтысы.
Бальмер формуласын қамтитын сутегі атомының спектрлік сызықтарының тобы Бальмер сериясы д.а.
(2) формуланы қамтитын сутегі атомының спектрлік сызықтар тобы Бальмер сериясы д.а. осы формулаға қарағанда n-нің мәні ұлғайған сайын көршілес сызықтардың толқын ұзындық айырмасы кеми береді,спектрлік сызықтар арасы жақындай тұседі.
Сутегі атомы спектрінде Бальмер сериясына жататын сызықтардан басқа сызықтар да бар. Олар бірнеше серия құрайды.
Спектрдің
ультракүлгін бөлігіндегі бір топ
сызықтар Лайман сериясы д.а.: n=2,3,4….
n=2,3,4….
Сутегі спектрінің жақын инфрақызыл бөлігінде Пашен сериясы деп аталатын бір топ сызық бар:
 n=4,5,6…..
n=4,5,6…..
Бұдан
басқа спектрдің алыс инфрақызыл бөлігінде
үш серия бар. Олар: Брэкет сериясы, Пфунд
сериясы, Хэмфри сериясы. Сонымен сутегі
атомының барлық спектрлік сызықтарын
былай анықтаймыз:
Сутегі
атомының энергетикалық спектрі мына
формуламен анықталады:
Мұндағы
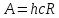 энергетикалық тұрақты;1,2,3,….
энергетикалық тұрақты;1,2,3,…. мәндерін қабылдайтын n саны бас кванттық
сан деп аталады. Ол сутегі атомының
энергия деңгейлерін қабылдайды.
Энергияның теріс таңбалары болуы
атомдағы электронның байланысқан күйде
тұрғандығын көрсетеді.
мәндерін қабылдайтын n саны бас кванттық
сан деп аталады. Ол сутегі атомының
энергия деңгейлерін қабылдайды.
Энергияның теріс таңбалары болуы
атомдағы электронның байланысқан күйде
тұрғандығын көрсетеді.
Сутегі
атомындағы электрон энергиясының ең
аз мәніне n=1 саны сәйкес келеді. Суретте
n=1 болатын күй негізгі,немесе қалыпты
күй,қалған күйлер қозған күйлер д.а.
Атом бір стационарлық күйден басқасына
ауысқан жағдайда энергиясы тиісті
стационарлық күйлер энергиясының
айырымына тең: шығарылады немесе жұтылады.
шығарылады немесе жұтылады. болған
жағдайда фотон шығарылады.
болған
жағдайда фотон шығарылады. болғанда фотон жұтылады. Мұмкін болатын
кванттық ауысуларға сәйкес келетін
дискреттік
болғанда фотон жұтылады. Мұмкін болатын
кванттық ауысуларға сәйкес келетін
дискреттік жиіліктер жиыны атомның сызықтық
спектрін анықтайды.
жиіліктер жиыны атомның сызықтық
спектрін анықтайды.


 =0
=0
 =0
=0
0
 =0
=0

 =0
=0

 =0
=0

 =0
=0
Лайман сериясы
Бальмер сериясы
Пашен сер.
n=1
n=2![]()
n=3![]()
![]()
![]()
n=4
n=5
n=6



38.Спин-орбиталық
әсерлесу. Сутегі атомы энергия деңгейлері
мен спектрлік сызықтарының нәзік
түзілісіЭлектронның
ядроны айнала қозғалысынан электронның
 орбиталық
импыльс моменті және онымен байланысқан
орбиталық магниттік моменті пайда
болатындығы белгілі. Екінші жағынан
электрон
орбиталық
импыльс моменті және онымен байланысқан
орбиталық магниттік моменті пайда
болатындығы белгілі. Екінші жағынан
электрон
 спиндік
моментке және онымен байланысқан
спиндік
моментке және онымен байланысқан спиндік
магниттік моментке ие.2
спиндік
магниттік моментке ие.2
 және
және
 моменттері арасында магниттік әсерлесу
пайда болады және ол
моменттері арасында магниттік әсерлесу
пайда болады және ол және
және векторларының
өзара бағдарлануына тәуелді. Осы әсерлесу
спин-орбиталық әсерлесу деп аталады.
векторларының
өзара бағдарлануына тәуелді. Осы әсерлесу
спин-орбиталық әсерлесу деп аталады.
Электрон
тыныштықта болатын, ал ядроэлектронды
айнала дөңгелек орбита бойымен қозғалатын
координаттар жүйесіне көшейік. 1-сурет

 магниттік
моменті бар бөлшекті
магниттік
моменті бар бөлшекті
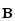

 магнит өрісіне орналастырғанда, ол
∆E=-(
магнит өрісіне орналастырғанда, ол
∆E=-( )
қосымша энергия қабылдайды. ∆Е энергияны
)
қосымша энергия қабылдайды. ∆Е энергияны
 магниттік моментке ие және
магниттік моментке ие және

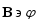
 магнит өрісінде тұрған электрон үшін
есептейік:
магнит өрісінде тұрған электрон үшін
есептейік:

Еn энергия деңгейлерiнiң орналасу заңдылығы сутегi атомында ең қарапайым.
Сутегi атомының термi (Т(m)=R/m2 және Т(n)=R/n2) формуласымен өрнектеледi. Демек, энергия мәндерiнiң дискреттi жиыны, яғни сутегi атомының энергетикалық спектрi мына формуламен анықталады:

мұндағы A=hcR энергетикалық тұрақты; 1, 2, 3,... мәндерiн қабылдайтын n саны бас кванттық сан деп аталады. Ол сутегi атомының энергия деңгейлерiн анықтайды. Энергияның терiс таңбалы болуы атомдағы электронның байланысқан күйде тұрғандығын көрсететiндiгi жайында айтылған болатын.
Сутегi атомындағы электрон энергиясының ең аз мәнiне (байланыс энергиясының ең үлкен шамасына) n=1 саны сәйкес келедi. n болғанда энергия Еn0 болады. Бұл электронның шексiздiктегi тыныштық күйiне сәйкес келедi. n саны өскенде көршi энергия деңгейлерiнiң ара қашықтығы кемидi және нөлге асимптотикалық ұмтылатын болады. Бұл n кванттық санының мәндерi үлкен болған жағдайда энергияның үздіксiз дерлiк өзгеретiндiгiн, ал n кiшi болған жағдайда энергия мәндерi секiрмелi түрде өзгеретiндiгiн көрсетедi.

(3.10)
формула сутегi
атомының энергия деңгейлерiн
анықтайды. Осы формула бойынша 3.2-суретте
сутегi
атомының энергия
деңгейлерiнiң диаграммасы тұрғызылған.
n=1
болатын күй негiзгi,
немесе қалыпты
күй.
Қалған күйлер ( болатын жағдайлар) атомныңқозған
күйлерi.
болатын жағдайлар) атомныңқозған
күйлерi.
 шамасы атомға оның электронынE=0
күйге ауыстыру үшін, яғни электронның
атомнан жұлынып шығарылуы үшін қажеттi
ең аз энергия. Бұл атомның ионданғандығын
көрсетедi.
шамасы атомға оның электронынE=0
күйге ауыстыру үшін, яғни электронның
атомнан жұлынып шығарылуы үшін қажеттi
ең аз энергия. Бұл атомның ионданғандығын
көрсетедi.
Егер
атом қозған E2 күйде тұрған болса, онда
ол негiзгi күйге энергиясы hv=E2-E1 фотон
шығарып барып ауысады. Осы сәуленiң
толқындық саны
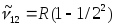 Лайман сериясының бас сызығына сәйкес
келедi. Басқа қозған энергия деңгейлерiнен
негiзгi деңгейге ауысқанда Лайман
сериясының барлық сызықтары пайда
болады. Сутегi атомы энергиялары Е3, Е4,
Е5,... қоздырылған күйлерден E2 қоздырылған
деңгейге ауысулар жасағанда Бальмер
сериясы пайда болады. Сутегi атомының
басқа сериялары да осыған ұқсас пайда
болады.
Лайман сериясының бас сызығына сәйкес
келедi. Басқа қозған энергия деңгейлерiнен
негiзгi деңгейге ауысқанда Лайман
сериясының барлық сызықтары пайда
болады. Сутегi атомы энергиялары Е3, Е4,
Е5,... қоздырылған күйлерден E2 қоздырылған
деңгейге ауысулар жасағанда Бальмер
сериясы пайда болады. Сутегi атомының
басқа сериялары да осыған ұқсас пайда
болады.
Спектрдiң ультракүлгін бөлiгiндегi бiр топ сызықтар Лайман (1906) сериясы деп аталады:
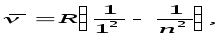 n=2,3,4,...
n=2,3,4,...
Сонымен, сутегi атомының барлық спектрлiк сызықтарын мынадай жалпы формуламен өрнектеуге болады:

39. Сілтілік металдар атомдарының энергия деңгейлері.кванттық ақау.Сілтілік металдар-Lі, Nа, К, Rb, Сs, Fr атомдарының бір сыртқы электроны бар, ол калыпты күйде s-электрон болып табылады. Бұлардың спектрлері - әдеттегі бір электрондық спектрлер.
Сутегі атомы жэне сутегі тәрізді иондарда ядро жалғыз электронға тікелей әсер ететін болса, сілтілік металл атомдарында сырткы электронға ядро ғана емес, оны тасалайтын ішкі электрондық қабықтар да әсер етеді.
Lі-ден басқа топтың барлық элементтері үшін (n — 1 )p6 -қабық соңғы толған қабық болып табылады; осы қабық үшін бас кванттық сан сыртқы электронның бас кванттық санынан бірге кем болады: Nа үшін 2р6 (сыртқы электроны 3s), К үшін Зр6 (сыргқы электроны 4s) және т.т. Lі-дің ішкі қабығы 1s2 және 2s -электронға қатысты ішкі болатын р-электрондары жоқ.
Сыртқы электрон салыстырмалы әлсіз байланысқандықтан, сілтілік металл атомы сфералық симметрияға ие атомдык қалдықтардан (инертті газ атомының конфигурациясы) және атомдық қалдықтан салыстырмалы үлкен қашықтықта болатын сыртқы (валенттік) электроннан тұрады деген модельді қабылдауға болады (1 - сурет). Атомдық қалдықтың заряды бейтарап атом үшін +1е-ге тең, ал иондар үшін +Zае, мұндағы +Zа=2 бір мәрте ионданғанда және т.т.
Атомның осы моделі үшін Шредингер теңдеуін шешіп, атомның стационарлық күйінің энергиясы өрнегін алуға болады.

Осы теңдеуді шешкенде валенттік электронның өзінен басқа электрондарды теуіп ядроны тартуынан пайда болатын атомдық қалдықтың поляризациясын ескеру қажет. Сондықтан Шредингер іеңдеуіне қойылатын U(r) потенциалдық энергия екі мүшенің косындысынан тұрады: бұлардың біріншісі нүктелік зарядтың өрісін, ал екіншісі бұған қабаттасатын диполь өрісін бейнелейді:
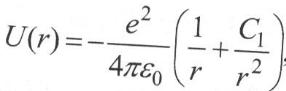
Сутегі атомы үшін Шредингер теңдеуін шешкендегі схемаға ұқсас схема бойынша шешу мына нәтижені береді:
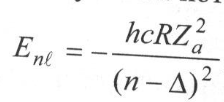

мұндағы c1 - атомдық калдықтың дипольдық моментінің мәнін сипаттайтын тұрақты; ∆l -кванттық ақау. ∆l–ның l-ден тәуелді
болуы себепті п -дері бірдей және l-дері әртүрлі деңгейлер жіктеледі.
Сілтілік металл атомдарының l-дері әртүрлі, бірақ п -дері бірдей деңгейлері бір-бірінен салыстырмалы алыс орналасады (Н атомында деңгейлер бойынша азғындалған). Қоздыру энергиясы өскен сайын сілтілік металл атомдарының деңгейлері бұларға сәйкес Н атомы деңгейлеріне жақындайтындығы байқалады. Сондықтан белгілі энергиядан бастап сілтілік металл атомдары күйлерінің «сутегі тәрізділігі» жайында айтуға болады. Мысалы, Nа атомында 3d,4d,... күйлер немесе барлық сілтілік металл атомдарында f-күйлер сутегі тәрізді болып табылады (2-сурет).

Сілтілік металдар атомдарының спектрінде төрт серия белгілі (3-сурет):
Бас
серия
Диффузиялық
серия
Айқын
серия![]()
Іргелі
серия![]()
Оң жақтағы бірінші мүшелер - тұрақты термдер (сериялардың шектері), ал екінші мүшелер - айнымалы термдер. Осы сериялар сызықтарының нәзік түзілісін қарастырайық.
Спектрдің ең интенсивті сызығы бас серияның n2s-n2p резонанстық сызығы болып табылады. Ол n2s1/2-n2p1/2 және n2s1/2-n2p3/2 екі нәзік жіктелу сызықтарынан тұрады. Мәселен, натрийда осы сызық сары дублеттен тұрады: D1 (λ=589,6нм) және D2 (λ=589,0 нм).
Дублеттік
терм деңгейлерінің арақашықтықтары
 -ке
сәйкес n өскенде кішірeйеді, сондықтан
бас серия сызыктары тарыла түсетін
дублеттер түрінде болады. Айқын серия
сызықтары осыған ұксас дублеттік сипатта
болады. Бірақ әрбір дублет сызыктарының
арақашыкгыктары бірдей болады, өйткені
әрбір сызық бір2р
дублеттік жіктелумен анықталады(4-сурет).
-ке
сәйкес n өскенде кішірeйеді, сондықтан
бас серия сызыктары тарыла түсетін
дублеттер түрінде болады. Айқын серия
сызықтары осыған ұксас дублеттік сипатта
болады. Бірақ әрбір дублет сызыктарының
арақашыкгыктары бірдей болады, өйткені
әрбір сызық бір2р
дублеттік жіктелумен анықталады(4-сурет).



Диффузиялық және іргелі сериялардың сызықтары үш кұраушыға жіктеледі, өйткені j кванттық саны бойынша сұрыптау ережелері осы жағдайда ауысулардың тек үш комбинациясын рұқсат етеді: n12p1/2-n2D3/2, n12p3/2-n2D3/2, n12p3/2-n2D5/2 және n12D3/2-n2F5/2, n12D5/2-n2F5/2, n12D5/2-n2F7/2.
41.Сілтілік
элемент атомы энергетикалық деңгейлерінің
және спектрлік сызықтарының нәзік
түзілісі.
Ажыратқыштық
қабілеті аса жоғары құралдар арқылы
сілтілік металл атомдарының спектрлік
сызықтарын зерттегенде бұлардың нәзік
түзілісі – дублетінің әрбір құраушысы
бірнеше сызыққа жіктеліп,күрделі
мультиплет түрінде көрінеді.Сонда
натрийдің сары дублетінің λ1=589,0
нм сызығы 6 құраушыға,ал λ2=589,6
нм сызығы 4

 құраушыға жіктелетіндігі анықталды.
Қазіргі кезде атомдық сызықтардың аса
нәзік түзілісі көпшілік жағдайда ядроның
механикалық моменті (спині) және онымен
байланысқан магниттік моменттің болуына
байланыстыекендігі тағайындалған.Ядролық
μI
магниттік
момент пен LI
механикалық
момент былай байланысқан μI=gI1/2(e-MN)LI
gI-ядроның
спиндік факторы, MN
–
ядро массасы
құраушыға жіктелетіндігі анықталды.
Қазіргі кезде атомдық сызықтардың аса
нәзік түзілісі көпшілік жағдайда ядроның
механикалық моменті (спині) және онымен
байланысқан магниттік моменттің болуына
байланыстыекендігі тағайындалған.Ядролық
μI
магниттік
момент пен LI
механикалық
момент былай байланысқан μI=gI1/2(e-MN)LI
gI-ядроның
спиндік факторы, MN
–
ядро массасы
μn=ħ/2*e/mp шамасы ядролық магнетон д.а. μn шамасы μБ магнетонынан 1836 есе кіші.Сондықтан аса нәзік түзіліс электрон спинімен байланысты мультиплеттік нәзік түзілістен шамамен 103 есе кіші.
Аса нәзік түзіліс құраушыларының санын атомдық спектрдің нәзік түзілісіндегі сияқты табуға,яғни ядролық спин ескерілген атомның векторлық моделі көмегімен анықтауға болады.Осы жағдайды атом күйін атомның толық моментін LF=LJ+LI анықтайтын F толық кванттық санымен сипаттайды.
Аса нәзік түзіліске жіктелу мына формуламен анықталады:δωF+1,F= δEF+1- δEF/ ħ=A/ ħ*( F+1)
Аса нәзік түзіліс құраушыларының арақашықтықтары аралықтар ережесін қанағаттандырады: δω1: δω2: δω3: ... ( F+1): ( F+2): ( F+3): ...Мұның өзі аса нәзік түзіліс табиғатының дұрыс түсірілгендігін көрсетеді және спектрдің аса нәзік түзілісі бойынша тікелей ядролық спиндерді анықтауға мүмкіндік береді.
43. Элементтердің периодтық жүйесін физикалық түсіндірілуіМенделеев кестесінің 1-ші және 2-ші периодтарының аумағында деңгейлердің толтырылу тәртібі сутегі атомындағы деңгейлердің үлгісімен сәйкес келеді. n=1 қабатта тек s-қабық толтырылады; n=2 қабаттың алдымен s-, онан кейін p-қабығы толтырылады.
Егер күрделі атомдар үшін де осы идеал желі қолдануға жарайтын болса, онда калийда 3d-қабық толтырыла басталар еді.
Бірақ калийдің 3d және 4d күйлеріндегі электрондардың энергиялары мынаған тең
Е3d= =
= ,
Е4d=
,
Е4d= =
=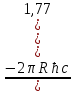 .
.
Осыдан Е3d> Е4d екендігі келіп шығады, сондықтан тереңірек орналасқан 4s деңгейі алдымен, одан кейін барып 3d деңгейі толтырылады. Демек үшінші период, екінші период сияқты, тек 8 элементтен тұрады және атомдардың 3s және 4р-қабықтары болады.
Кальцийдегі (z=20) 4s-қабық толтырылғаннан кейін, скандийде (z=21) 4р-қабықтың құрылуы басталады деп күтуге болады. Бірақ спектрлерді зерттеу кейінгі элементтерде алдымен 3d-қабық толтырылады, онан кейін барып 29Cu мыстан бастап 30Zn мырыштан аяқталатын, қабықтардың қалыпты толтырылуы жалғасады. Сонымен 4-период 18 элементтен тұрады және атомдардың 4s, 3d, 4p-қабықтары болады.
Келесі, бесінші период, 4-период сияқты, 18 элементтен тұрады, 5s, 4d, 5p-қабықтары толтырылады
Алтыншы период 32 элементтен тұрады, өйткені сыртқы 6s, 6p-қабықтармен қоса, бірінші ішкі 5d-қабық және екінші ішкі 4f-қабық толтырылады. Дәл осылай жетінші период та бүтіндей алтыншы периодты қайталауға , яғни 32 элемент (7s, 5f, 7p-қабықтары) болуға тиіс еді.
Сонымен, Бірінші период барлығы екі элементтен, екінші және үшінші периодтар 8 элементтен, төртінші және бесінші периодтар 18 элементтен, ал алтыншы және жетінші периодтар 32 элементтен тұрады.
Периодтық жүйенің әр периоды сілтілік металдан басталады; оның электрондық конфигурациясында тек жалғыз сыртқы s-электрон болады. Бірақ элементтер ішінен сілтілік металдар атомдарының иондану потенциалы ең төмен. Сондықтан бұл атомдар сыртқы s-электрондарын басқа элемент атомдарына оңай бере алады. Сілтілік металдардың жоғарғы химиялық активтлігі осыдан.
Әрбір период He, Ne, Ar, Kr, Xe, Rn инертті газдар атомымен аяқталады. Осы атомдардың сыртқы s-p- қабығы 8 электроннан тұрады, сондықтан инертті газдар атомдарының иондану потенциялы ең жоғары. Керісінше, периодтық жүйенің көршілес жетінші тобындағы элементтері-фтор, хлор, бром, иод – химиялық өте активті. Мұның себебі бұлардың s-p-қабығы жеті электроннан тұрады; сондықтан ол тұйықталған қабық болуға жетіспейтін сегізінші электронды қосып алу арқылы оңай толтырылуы мүмкін.
Ерекше назар аударатын цезийден бастап лютейцийға дейінгі 14 элемент лантанидтер немесе сирек жер элементтері деп аталады.
Лантанидтерге ұқсас актинидер деп аталатын 14 элементтерден тұрады.
