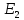- •1.Электромагниттік сәуленің табиғаты және оның негізгі сипаттамалары, эмс спектрі
- •3. Атомдық спектр. Спектрлік сызықтардың толқын ұзындықтарын анықтау әдістері.
- •4. Атомдық спектрларді заттың химиялық құрамын анықтау үшін қолдану.
- •5. Жылулық шығарылған сәуле және оның сипаттамалары. Қара дене.
- •7.Жарық кванттары жайындағы Эйнштейн гипотезасы
- •12.Фотондар. Фотонның энергиясы, импульсы,массасы.
- •14. Микробөлшектердің толқындық қасиеттерінің тәжірибелік расталуы ( Дэвиссон мен Джермер, Томсон, Тартаковский тәжірибелері).
- •1.Кванттық механикада бөлшек траекториясы ұғымы мағынасын жояды.
- •2. Микробқлшектің толық тыныштық күйде болуы мүмкін еместігі.
- •3.Анықталмағандықтар қатынастарынан шығатын тағы бір қорытынды:бөлшектің толқындық қасиеттерін ескергенде бөлшектің толық энергиясын кинетикалық және потенциалдық энергияға бөлудің мағынасы жойылады.
- •16. Резерфорд тәжірибелері. Атомның құрылысы.
- •17.Атомның ядролық моделі, оның классикалық физика заңдарымен үйлеспеуі.
- •20 Ғ бас кезінде ешқандай күмәнсыз бар екендігі мойындалды.
- •18. Атомдық спектрлер.Сериялық заңдылықтар. Спектрлік терм. Комбинация принципі.
- •25.Бор теориясының кемшілігі
- •26.Спектрлік сызықтардың изотоптық ығысуы. Сутегі атомы мен сутегі тәрізді иондардың жиіліктері үшін формулалар мына түрге келеді
- •31. Бір электрондық атомдық жүйелер үшін Шредингер теңдеуі және атомның квантталуы.
- •32.Бір электронды атомның кванттық сандары және бұлардың физикалық мағынасы.
- •1.Атомдық жүйелердің ең қарапайымы бір электрондық атомдар: н,,,…; мезоатомдар, позитроний.
- •33. Бір электронды атомның толқындық функциялары. Энергия деңгейлерінің азғындау дәрежесі.
- •34.Күйлердің белгіленуі. Сұрыптау ережелері і.
- •35. Сутегі атомының энергетикалық спектрі. Шығару және жұтылу спектрі.
- •45.Ядро спині.Атомның энергия деңгейлерінің және спектрлік сызықтарының аса нәзік түзілісі.
- •I және j берілген жағдайда векторының абсолют шамасы
- •49.Рентген түтікшесінің антикатодын электрондармен атқылағанда пайда болатын рентгендік спектрлердің екі түрі болады:тұтас және сызықтық.
- •53.Қарапайым Зееман эффекті.
- •57. Екі атомды молекуланың айналысы, айналыс спектрі.
- •58.Екі атомды молекуланың тербелісі
33. Бір электронды атомның толқындық функциялары. Энергия деңгейлерінің азғындау дәрежесі.
a)
Атомдық жүйенің ең қарапайымы—
бірэлектрондық атомдар: Н, 
 ,...
,...
Осындай
жүйедегі электронның ядромен
әсерлесуініңпотенциалдық энергиясы:


Осы жағдайда Шредингер теңдеуі былай жазылады:
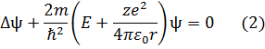
Электрон
қозғалысын өріс орталық-симетриялы,
яғни тек 
 -ге
тәуелді. Сондықтан (2) теңдеуін шешу
-ге
тәуелді. Сондықтан (2) теңдеуін шешу
 ,
,
 ,
,
 сфералық кординаттар жүйесінде
жүргізіледі.
сфералық кординаттар жүйесінде
жүргізіледі.















b) Энергия деңгейлердің азғындау дәрежесі.
Электрон
энергиясы n бас кванттық санға ғана
тәуелді, бірақ әрбір
 мәніне (
мәніне ( -ден
басқа)
l
және
-ден
басқа)
l
және
 мәндерімен өзгеше болатын бірнеше
мәндерімен өзгеше болатын бірнеше меншікті функциялар сәйкес келеді.
Сондықтан сутегі атомы және сутегі
тәрізді иондар бірнеше әр түрлі күйлерде
тұрғанымен, энергиясы бірдей бола алады.
Бұл электрон бірнеше әр түрлі күйлерде
тұрып, энергия мәндері бірдей бола
алатындығын көрсетеді.
меншікті функциялар сәйкес келеді.
Сондықтан сутегі атомы және сутегі
тәрізді иондар бірнеше әр түрлі күйлерде
тұрғанымен, энергиясы бірдей бола алады.
Бұл электрон бірнеше әр түрлі күйлерде
тұрып, энергия мәндері бірдей бола
алатындығын көрсетеді.

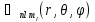
Бас кванттық сан: n=1, 2, 3…..
Орбиталық кванттық сан: l=0, 1, 2,…, n-1; n
Орбиталық
магниттік кванттық сан:
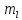 =0,
=0, ;2l+1
;2l+1
E<0

|
|
|
|
|
|
|
|
n=1,
l=0,
 =0
=0

n=2,
l=0,
 =0
=0

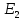
l=1,
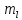 =
=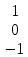

 энергияға
төрт күй сәйкес келеді. Энергиялары
бірдей күйлер азғындалған, ал
энергияға
төрт күй сәйкес келеді. Энергиялары
бірдей күйлер азғындалған, ал
 нақты
энергия мәні барәр түрлі күйлердің саны
осы энергетикалық деңгейлердің азғындалу
дәрежесі деп аталады.
нақты
энергия мәні барәр түрлі күйлердің саны
осы энергетикалық деңгейлердің азғындалу
дәрежесі деп аталады.
Бір
электронды атомның n–і деңгейінің
азғындалу дірежесі l
–дің және
 –дің
мүмкін мәндерінің санын ескеріп анықтауға
болады. Берілгенn
үшін әр түрлі күйлердің толық N
саны:
–дің
мүмкін мәндерінің санын ескеріп анықтауға
болады. Берілгенn
үшін әр түрлі күйлердің толық N
саны:

Электронның
меншікті моменті (спин) болатындықтан
осы санды екі еселеу керек. Сонымен n–і
энергетикалық деңгейдің азғындалу
дәрежесі
 болады.
болады.
34.Күйлердің белгіленуі. Сұрыптау ережелері і.
Атомдағы электронның әр түрлі күйлерінің l орбиталық кванттық санының мәніне байланысты латын альфавитінің кіші әріптерімен белгілеу қабылданған:
|
l кванттық саны |
0 |
1 |
2 |
3 |
4 |
5 |
|
Күй белгісі |
s |
p |
d |
F |
g |
h |
n бас кванттық сан мәні берілген l күй белгісінің алдында көрсетіледі: 1s,2s,3s... 2p,3p,... 3d,4d,... 4f,5f,...
|
Күйлер тобы (қабықтар) 1s,2s,3s... 2p,3p,... 3d,4d,... 4f,5f,... |
|
Қабықтағы күйлер саны 2 6 10 14 |
Сұрыптау ережесi. Атомдағы электрондардың электромагниттік сәулені (жарықты) шығаруы және жұтуымен байланысты мүмкін болатын кванттық ауысуларының шектейтін ережелері: l орбиталық кванттық сан б/ша: 1,яғни орбиталық кванттық сан 1-ге өзгеретін ауысулар ғана мүмкін б.ды.
 магниттік
кванттық сан б/ша:
магниттік
кванттық сан б/ша: ,яғни осы шарт орындалатын ауысулар
ғана мүмкін болады.
,яғни осы шарт орындалатын ауысулар
ғана мүмкін болады.
Ұрықсат етiлген ауысулар тек s-және p-күйлер арасында, p-және d-күйлер арасында d-және f-күйлер арасында болады деген мағына бередi. Бұл жағдайларда n бас кванттық сан кез-келген бүтін санға өзгере алады.
Кванттық теория тұрғысынан сұрыптау ережелерi бiр кванттық күйден басқа бiр кванттық күйге ауысу ықтималдығымен байланысты болады. Сонда сұрыптау ережелерi тиым салатын ауысулардың ықтималдығы iс жүзінде нөл болады екен.