
- •1.Электромагниттік сәуленің табиғаты және оның негізгі сипаттамалары, эмс спектрі
- •3. Атомдық спектр. Спектрлік сызықтардың толқын ұзындықтарын анықтау әдістері.
- •4. Атомдық спектрларді заттың химиялық құрамын анықтау үшін қолдану.
- •5. Жылулық шығарылған сәуле және оның сипаттамалары. Қара дене.
- •7.Жарық кванттары жайындағы Эйнштейн гипотезасы
- •12.Фотондар. Фотонның энергиясы, импульсы,массасы.
- •14. Микробөлшектердің толқындық қасиеттерінің тәжірибелік расталуы ( Дэвиссон мен Джермер, Томсон, Тартаковский тәжірибелері).
- •1.Кванттық механикада бөлшек траекториясы ұғымы мағынасын жояды.
- •2. Микробқлшектің толық тыныштық күйде болуы мүмкін еместігі.
- •3.Анықталмағандықтар қатынастарынан шығатын тағы бір қорытынды:бөлшектің толқындық қасиеттерін ескергенде бөлшектің толық энергиясын кинетикалық және потенциалдық энергияға бөлудің мағынасы жойылады.
- •16. Резерфорд тәжірибелері. Атомның құрылысы.
- •17.Атомның ядролық моделі, оның классикалық физика заңдарымен үйлеспеуі.
- •20 Ғ бас кезінде ешқандай күмәнсыз бар екендігі мойындалды.
- •18. Атомдық спектрлер.Сериялық заңдылықтар. Спектрлік терм. Комбинация принципі.
- •25.Бор теориясының кемшілігі
- •26.Спектрлік сызықтардың изотоптық ығысуы. Сутегі атомы мен сутегі тәрізді иондардың жиіліктері үшін формулалар мына түрге келеді
- •31. Бір электрондық атомдық жүйелер үшін Шредингер теңдеуі және атомның квантталуы.
- •32.Бір электронды атомның кванттық сандары және бұлардың физикалық мағынасы.
- •1.Атомдық жүйелердің ең қарапайымы бір электрондық атомдар: н,,,…; мезоатомдар, позитроний.
- •33. Бір электронды атомның толқындық функциялары. Энергия деңгейлерінің азғындау дәрежесі.
- •34.Күйлердің белгіленуі. Сұрыптау ережелері і.
- •35. Сутегі атомының энергетикалық спектрі. Шығару және жұтылу спектрі.
- •45.Ядро спині.Атомның энергия деңгейлерінің және спектрлік сызықтарының аса нәзік түзілісі.
- •I және j берілген жағдайда векторының абсолют шамасы
- •49.Рентген түтікшесінің антикатодын электрондармен атқылағанда пайда болатын рентгендік спектрлердің екі түрі болады:тұтас және сызықтық.
- •53.Қарапайым Зееман эффекті.
- •57. Екі атомды молекуланың айналысы, айналыс спектрі.
- •58.Екі атомды молекуланың тербелісі
45.Ядро спині.Атомның энергия деңгейлерінің және спектрлік сызықтарының аса нәзік түзілісі.
Ажыратқыштық
қабілеті аса жоғары құралдар арылы
сілтілік металл атомдарының спектрлік
сызықтарын зерттегенде бұлардың нәзік
түзілісі - дублетінің әрбір құраушысы
бірнеше сызыққа жіктеліп,күрделі
мультиплет түрінде көрінеді.Сонда
натрийдің сары дублетінің
 нм сызығы 6 құраушыға,ал
нм сызығы 6 құраушыға,ал нм сызығы 4 құрашыға жіктелетіндігі
анықталды(1- сурет).Сызықтардың осыған
ұқсас жіктелуі көптеген атомдарда
байқалады.Спектрлік сызықтардың осылай
жіктелуін бұлардың аса нәзік түзілісі
деп атайды.
нм сызығы 4 құрашыға жіктелетіндігі
анықталды(1- сурет).Сызықтардың осыған
ұқсас жіктелуі көптеген атомдарда
байқалады.Спектрлік сызықтардың осылай
жіктелуін бұлардың аса нәзік түзілісі
деп атайды.













²
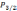
2
1
F
F
0
3
2
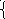

3²

1






0,2пм
0,2пм
2,3пм

2,1пм

1-сурет.
Аса нәзік түзіліс құраушыларының санын атомдық спектрдің нәзік түзілісіндегі сияқты табуға,яғни ядролық спин ескерілген атомның векторлық моделі көмегімен анықтауға болады.Осы жағдайды атом күйін атомның толық моментін
 (1)
(1)
анықтайтын F толық кванттық санымен сипаттайды.
I және j берілген жағдайда векторының абсолют шамасы
 =
= (2)
(2)
мұндағы

Ядроның спині болған жағдайда j кванттық санымен сипатталатын әрбір энергетикалық деңгей дәл осыншама жеке деңгейшелерге жіктеледі (1а-сурет).
Сутегі
және сутегі тәрізді иондар үшін А
тұрақтысының шамасы A= , (3)
, (3)
Мұнда
R- Ридберг тұрақтысы ; нәзік
түзіліс тұрақтысы.
нәзік
түзіліс тұрақтысы.
А тұрақтысы арқылы

формуланы ықшамдап жазуға болады
 .
(4)
.
(4)
Деңгейлер
арасындағы көшулер мына сұрыптау
ережелерін ΔF=0,±1 ( көшуден
басқа) қанағаттандырады.
көшуден
басқа) қанағаттандырады.
(4) өрнегіне сәйкес көрші деңгейлердің арақашықтығы мынаған

- (5)
(5)
тең болатындықтан,спектрлік сызықтардың аса нәзік түзіліске жіктелуі мына өрнекпен анықталады:
 (6)
(6)
Аса нәзік түзіліс құраушыларының арақашықтықтары аралықтар ережесін қанағаттандырады:
 …=(F+1):(F+2):(F+3):…
(7)
…=(F+1):(F+2):(F+3):…
(7)
Бұл ереже тәжірибеде өте дәл орындалады.Мұның өзі аса нәзік түзіліс табиғатының дұрыс түсіндірілгендігін көрсетеді және спектрдің аса нәзік түзілісі бойынша тікелей ядролық спиндерді анықтауға мүмкіндік береді.
Сутегінің
жеңіл изотопы үшін ядро спині I=1/2.Атомның
негізгі күйі 1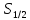 (n=1,l=0,j=1/2)
үшін F=I±j:
(n=1,l=0,j=1/2)
үшін F=I±j: болады.Сонымен,сутегі
атомының 1
болады.Сонымен,сутегі
атомының 1 деңгейі екі деңгейшеге жіктеледі(2-сурет).
деңгейі екі деңгейшеге жіктеледі(2-сурет).
Аса
нәзік түзіліс,әрине,сутегі атомының
1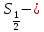 деңгейінде
ғана емес қозған деңгейлерінде де
бар.Бұл жағдайда n,l,j кванттық сандар
өскен жағдайда жіктелу шамасы тез
кемиді.Бір элемент изотоптары ядроларының
спиндері әр түрлі болатындықтан,әрбір
изотоп үшін өзінің,басқадан өзгеше аса
нәзік түзілісі болады.
деңгейінде
ғана емес қозған деңгейлерінде де
бар.Бұл жағдайда n,l,j кванттық сандар
өскен жағдайда жіктелу шамасы тез
кемиді.Бір элемент изотоптары ядроларының
спиндері әр түрлі болатындықтан,әрбір
изотоп үшін өзінің,басқадан өзгеше аса
нәзік түзілісі болады.





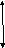
1²
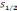
H1
F2=1
F1=0

ΔE=5,9·10-6эВ
2-сурет
46. Сипаттауыш рентгендік спектрлердің ерекшеліктеріӘрбір элементтің өзіне ғана тән сызықтық спектрі болады. Осындай спектрлерді сипаттауыш (сипаттамалық) деп атайды. Әр элемент жеке, немесе химиялық қосынды түрінде тұрғанына карамастан накиы тек өзіне тән спектр береді. Мәселен, І1йод атомының және І2 йод молекуласының сипаттамалық спектрі бірдей болады.
Сипаттауыш спектрлердің мынадай ерекшеліктері бар:
Әр қилы және курделі оптикалык сызыктык спектрлерге карағанда әртүрлі элементтердің рентгендік сипаттамалык спектрлері қарапайым әрі біркелкілігімен ерекшеленеді. Элементтің Z атомдық номері өскенде олар (рентгендік спектрлері) бірсыдырғы, кыска толкын жакка карай ығысады.(1- Сурет)
33 As
|
|
|
|
|
|
|
|
|
|
|
|
|
|
35 Br
37 Rb
38 Sr
41 Nb
45 Rh
→λ
Әртурлі элементтердің сипаттамалык спектрлері бір бірімен ұқсас және егер қарастырып отырған элемент спектрі баска элементтермен қосылыста турған болса да өзгермейді. Мұны сипаттауыш спектрлер атомның ішкі бөліктеріндегі электрондар кванттық ауысулар жасағанда пайда болады деп кана тусіндіруге болады.
Сипаттауыш спектрлер К, L, M,… бірнеше сериядан турады. Әрбір серия толкын ұзындығының кішіреюі бойынша орналаскан K
 Kβ,Kγ,
…, L
Kβ,Kγ,
…, L L
β,
Lγ,….және
т.б сызықтардың аз санынан тұрады.
L
β,
Lγ,….және
т.б сызықтардың аз санынан тұрады.
Сипаттауыш спектрлерді талдау нәтижесінде атомдардың К, L, M,… рентгендік термдері болатындығы анықталды.
Сонымен әрбір элементтің өзінің меншікті, тек өзіне тән сипаттамалық рентген сәулесінің спектрі болады.оптикалық спектрлерден өзгешелігі рентгендік спектрлер жеткілікті турде карапайым және бір элементтен екінші элементке жүйелі турде өзгеріп отырады. Рентгендік спектрлердің осы сипаты бір элементтен екінші элементке ауысканда ішкі электрондық кабыктар құрылымы емес, осы кабаттарды толтыратын электрондардың байланыс энергиясыөзгеретіндігімен тусіндіріледі.
47.Мозли заңы. Атомның әрбір электроны ядро мен “ішкі” және “сыртқы” электрондар тудыратын электр өрісінде болады. Сыртқы электрондар өрісінің ішкі электрондар энергиясына ешқандай әсері жоқ десе де болады. Сондықтан рентгендік деңгейлердің энергиясы бірінші жуықтауда сутегі тәрізді атомдар формуласына ұқсас формуламен есептеледі:
 .
(11.2)
.
(11.2)
Сутегі атомы формуласынан айырмашылығы бұл формулада nl түзетуі бар. Осы түзету тасалау (экрандау) тұрақтысы деп аталады; ол ядро өрісінің электрондармен экрандалуын ескереді. nl Z-ке тәуелді емес деуге болады, бірақ n мен -ге тәуелді. Жеңіл атомдардың К-қабығындағы электрондар үшін осы қабықтың негізінен екінші электроны экрандаушы әсер етеді; осы жағдайда 1. Жеңіл атомдардың L-қабығының электрондар үшін 8. nl-ның дәл мәндері тек тәжірибе жүзінде анықталуы мүмкін. Электронынан айрылған атом энергиясы оң таңбалы. Сондықтан, (11.2) формула мен сутегі атомы үшін формуланың таңбалары әр түрлі болады.
Энергияның сақталу заңына сәйкес рентген кванттарының энергиясы атомның алғашқы және соңғы күйлері энергияларының айырымына тең
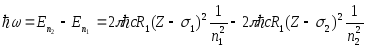 (11.3)
(11.3)
Экрандау тұрақтысын деңгейлер үшін емес, тікелей спектрлік сызықтар үшін енгізуге болады. Сонда (11.3) формула ықшамдырақ түрге келеді
 .
(11.4)
.
(11.4)
(11.3)
формуладан элемент неғұрлым ауыр болса,
оның шыға-ратын сипаттамалық рентген
сәуле-лерінің толқыны, соғұрлым қысқа
(жиіліктері үлкен) болатыны көрі-неді.
Сөйтіп
рентген сәулесінің толқынының ұзындығы
элементтің атомдық нөміріне тәуелді.
Осы заңдылықты 1913 ж. ағылшын физигі
Мозли тәжірибе жүзінде ашқан. Ол
К-серияның
берілген сызығы жиілігінің
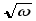 квадрат түбірінің элементтіңZ
атомдық нөміріне тәуелділігі сызықтық
байланыспен өрнектелетінін тағайындаған
(11.5-сурет):
квадрат түбірінің элементтіңZ
атомдық нөміріне тәуелділігі сызықтық
байланыспен өрнектелетінін тағайындаған
(11.5-сурет):

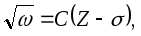 (11.5)
(11.5)
мұндағы С, – тұрақтылар. С мен -ның басқа мәндері бар осы формула L-серия үшін де, тағы басқа сериялар (М, N,...) үшін де дұрыс болады. Осы формула Мозли заңы деп аталады. Бір элементтен келесі элементке ауысқанда сипаттамалық рентгендік спектрлердің ығысуын осы формула анықтайды.
