- •Предмет и задачи биохимии. История биохимии
- •Краткая история развития биохимии
- •Белки как уникальный класс биополимеров
- •Физико-химические свойства белков
- •Элементный состав белков
- •Форма белковых молекул.
- •Функции белков.
- •Физико-химические свойства аминокислот
- •Цвиттер-ион
- •Экспериментальные доказательства полипептидного строения белков
- •Классификация белков
- •Структурная организация белков.
- •Определение первичной структуры белка (псб).
- •Вторичная структура белка (всб).
- •Беспорядочный клубок
- •Денатурация и ренативация белка
- •Гемоглобинозы
- •Методы выделения и очистки белков.
- •Методы определения Mr белков
- •Методы определения гомогенности белков
- •Нуклеиновые кислоты
- •Состав нуклеиновых кислот
- •Углеводная часть
- •Состав нуклеиновых кислот
- •Наиболее распространенные нуклеотиды клетки.
- •Вторичная структура днк. Правила Чаргаффа.
- •Синтез белка
- •1. Образование 40s-комплекса инициации
- •2. Образование 80s-комплекса инициации
- •Ферменты
- •Современная классификация ферментов и их номенклатура
- •Номенклатура ферментов.
- •Механизм действия ферментов
- •Кинетика ферментативных реакций
- •Специфичность действия ферментов
- •Регуляция активности ферментов.
- •Методы регуляции активности ферментов
- •Витамины
- •По механизму действия антивитамины делятся на 2 группы:
- •Пути метаболизма витаминов в организме.
- •Жирорастворимые витамины.
- •Водорастворимые витамины.
- •Витаминоподобные вещества.
- •Введение в метаболизм
- •Современные представления о дыхательной цепи переноса электронов. (эпц).
- •Общие и специфические пути катаболизма
- •Цикл трикарбоновых кислот.
- •Обмен углеводов
- •Амилопектин амилоза
- •Синтез и распад гликогена
- •Гликоген
- •Синтез глюкозы из глицерина
- •Механизм фосфорилитического отщепления остатка глюкозы от гликогена.
- •Гликолиз
- •1 Стадия
- •2 Стадия
Методы определения Mr белков
У большого числа белков химический состав и последовательность аминокислот не установлена (1010–1012 белков), поэтому у таких белков определяют Mr. При этом используются различные методы.
а) Седиментационный метод – определение Mr проводят в специальных центрифугах (первая центрифуга была предложена шведским биохимиком Сведбергом), в которых удается создать центробежное ускорение, которое больше в 200 тыс. и более раз ускорения земного притяжения. Mr определяют по V седиментации молекул. По мере перемещения молекул от центра к периферии образуется резкая граница белок-растворитель. Скорость седиментации выражают через константу седиментации (S):
![]()
где V – скорость перемещения границы белок-растворитель (см/с);
– угловая скорость ротора (рад/с);
– расстояние от центра ротора до середины ячейки с раствором белков (см).
Величина константы седиментации S, которая равна 110–13 С условно принята за 1 и называется 1 Сведбергом (S). S для белков лежит в пределах 1-50 S, иногда до 100 S.
Mr белков определяется по уравнению Сведберга:
![]()
где R – универсальная газовая постоянная;
Т – абсолютная температура по Кельвину;
S – константа седиментации;
Д – коэффициент диффузии;
– плотность растворителя;
V – парциальный удельный объем газа.
Этот метод дорогостоящий из-за применения аппаратуры.
Более просты и дешевы:
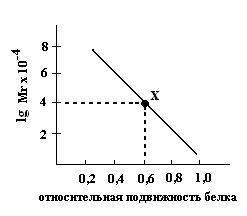
б) Гель-фильтрация в тонком слое сефадекса.
|
|
Длина пробега белка (в мм) находится в логарифмической зависимости от Mr. Х – Mr искомого белка на калибровочном графике. |
в) Диск-электрофорез в полиакриламидном слое – также существует зависимость между логарифмом Mr калибровочных белков и длиной их пробега.
Методы определения гомогенности белков
Степень чистоты выделенного белка определяется:
ультрацентрифугированием;
методом диск - электрофореза;
различными иммунохимическими методами;
определением растворимости белка (метод Нортропа) основан на правиле фаз, согласно которому растворимость чистого вещества при данных условиях опыта зависит только от температуры, но не зависит от концентрации вещества в твердой фазе.
|
|
Если белок гомогенный, то на графике получается один перегиб (а), если есть примеси белков (б, в), то получим несколько перегибов кривой насыщения. У всех белков свои индивидуальные кривые растворимости. |
ЛЕКЦИЯ 4
Нуклеиновые кислоты
В 1868 г. швейцарский ученый Ф. Мишер выделил из ядер лейкоцитов вещество, названное им нуклеином (от греч. nucleus – ядро). В 20-м столетии стало известно химическое строение нуклеина – его назвали ДНК. Позднее открыли и РНК. Мишер определил, что нуклеин содержит большое количество Р, нуклеин обладал выраженными кислыми свойствами. К середине 20 в. было обнаружено, что нуклеиновые кислоты в организме находятся в комплексе с белками, то есть в виде нуклеопротеидов и участвуют в передаче наследственных признаков.
Состав нуклеиновых кислот
|
АО | |
|
| |
|
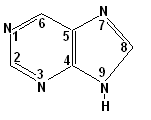
производные пурина |
производные 2-оксопиримидина |
|
|
|
|
Аденин А (6-аминопурин) Гуанин Г (G) (2-амино-6-оксопурин) |
Цитозин Ц, С (2-оксо-4-аминопиримидин) Урацил У, (U) (2,4-диоксопиримидин) Тимин Т (5-метил-2,4-диоксопиримидин) |
Кроме главных АО, в нуклеиновых кислотах встречаются минорные пуриновые и пиримидиновые АО (гидроксилированные и метилированные) – до 10% всех нуклеотидов – Т-РНК. В ДНК они встречаются реже.
|
|
|
|
дигидроурацил |
псевдоуридин |