
- •Лабораторные
- •2. Обязательные требования к технике безопасности при работе студентов в химической лаборатории
- •3. Правила оказания первой медицинской помощи
- •Лабораторная работа № 1 химическая посуда и обращение с нею
- •Лабораторная работа № 2 лабораторные нагревательные приборы
- •Лабораторная работа № 3 весы. Взвешивание. Фильтрование
- •Фильтрование
- •Лабораторная работа № 4 получение оксидов, кислот, оснований, солей
- •1. Получение нерастворимых оснований.
- •2. Получение оксидов.
- •3. Получение кислоты.
- •4. Получение средней соли.
- •Лабораторная работа № 5 общие приемы работы с газами
- •Лабораторная работа № 6 определение относительной молекулярной массы оксида углерода(IV)
- •Лабораторная работа № 7 приготовление раствора хлорида натрия заданной концентрации по навеске
- •2 % -------------------- 0,019 Г/мл.
- •Лабораторная работа № 8
- •Приготовление раствора
- •Хлорида натрия заданной концентрации
- •Смешением из двух растворов
- •4,5% 1 М.Ч.
- •7,5 % 2 М.Ч.
- •2,0 % ------------------ 0,019 Г/мл
- •Лабораторная работа № 10 реакции в растворах электролитов. Произведение растворимости
- •Лабораторная работа № 11
- •Ионное произведение воды.
- •Водородный показатель.
- •Гидролиз солей
- •Лабораторная работа № 12 химическая кинетика. Химическое равновесие
- •Лабораторная работа № 12 окислительно-восстановительные реакции
- •Лабораторная работа № 7 определение эквивалентной массы магния методом вытеснения
Лабораторная работа № 6 определение относительной молекулярной массы оксида углерода(IV)
Установка (рис. 1) состоит из аппарата Киппа 1, заряженного кусками мрамора и соляной кислотой, двух последовательно соединенных склянок Тищенко 2 и 3 (склянка 2 заполнена водой для очистки проходящего оксида углерода(IV) от хлороводорода и от механических примесей, склянка 3 — серной кислотой для осушки газа) и колбы 4 емкостью 250 мл для собирания оксида углерода(IV).
Вымыть и высушить колбу. Подобрать к ней пробку и отметить уровень, до которого входит пробка в горло колбы (надеть на горло колбы резиновое кольцо или сделать метку карандашом по стеклу). Взвесить колбу с пробкой с точностью до 0,01 г. Данные записать.
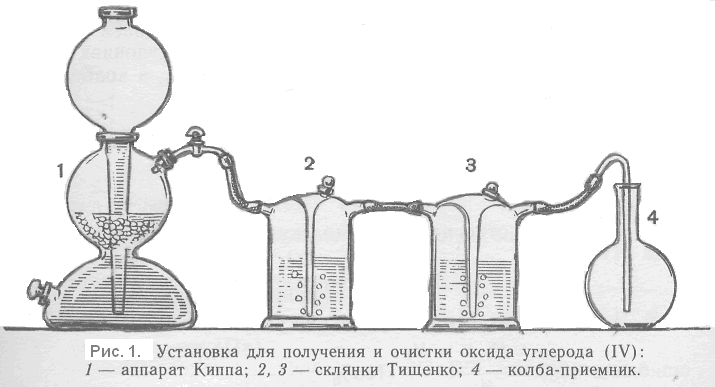
Наполнить колбу оксидом углерода(IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что и при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен и она целиком наполнена оксидом углерода(IV), надо, взвесив колбу, еще раз на несколько минут опустить в нее газоотводную трубку, пропустить газ и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы с газом. Значение массы колбы с оксидом углерода (IV) записать.
Определить объем колбы, наполнив ее водой до пробки, измерить затем объем воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
Форма записи наблюдений
1. Масса колбы (с пробкой) с воздухом — m1 (г).
2. Масса колбы (с пробкой) с оксидом углерода(IV) — m2 (г).
3. Объем колбы— V (мл).
4. Температура — t (°С).
5. Давление — р (кПа).
Обработка результатов
1. Объем воздуха в колбе V привести к нормальным условиям (T0 = 273К, р0 = 101,3 кПа) по формуле 1:
![]() (1)
(1)
где: V — объем колбы, л; р — атмосферное давление, кПа; Т — температура комнаты, К (ро - 101,3 кПа, Т0 - 273 К).
2. Вычислить массу воздуха m3, который находился в колбе, зная, что масса 1 л воздуха при нормальных условиях равна 1,29 г.
3. Вычислить массу оксида углерода(IV) m(СO2) в колбе:
m(CO2) = m2 - (m1 - m3)
4. Вычислить плотность оксида углерода(IV) по воздуху по формуле 2:
![]() (2)
(2)
5. Вычислить относительную молекулярную массу оксида углерода(IV):
Mr = 29 ∙ Dвозд
6. Вычислить относительную ошибку опыта (в %) по формуле 3:
![]() (3)
(3)
7. Сделать вывод.
Лабораторная работа № 7 приготовление раствора хлорида натрия заданной концентрации по навеске
Пример расчета и методика приготовления раствора.
Задание: Приготовить 100 мл 6,5 %-го раствора хлорида бария.
По таблице 1 определить или рассчитать плотность 6,5 %-ного раствора хлорида бария.
Таблица 1
Зависимость плотности раствора от массовой доли растворенного вещества
|
ω,%
|
ρ, г/мл |
ω, %
|
ρ, г/мл | ||
|
ВаСl2 |
NaCl |
ВаСl2 |
NaCl | ||
|
2.0 |
1.016 |
1.013 |
12.0 |
1.113 |
1.086 |
|
4.0 |
1.034 |
1.027 |
14.0 |
1.134 |
1.101 |
|
6.0 |
1.053 |
1.041 |
16.0 |
1.156 |
1.116 |
|
8.0 |
1.072 |
1.056 |
18.0 |
1.179 |
1.132 |
|
10.0 |
1.092 |
1.071 |
20.0 |
1.203 |
1.148 |
Плотности 6,5 %-ного раствора хлорида бария можно рассчитать методом интерполяции, предполагая, что зависимость плотности от концентрации в узком интервале линейная. Массовая доля 6,5 % находится между 6,0 % и 8.0% следовательно плотность 6,5 %-ного раствора находится между значениями 1.053 и 1.072 г/мл. 6.5% больше, чем 6,0% на 0.5 %. При увеличений концентрации на 2 % от 6,0 % до 8,0 % плотность увеличивается от 1.053 до 1.072. Пропорцией можно определить, на сколько г/мл плотность 6,5 %-ного раствора больше, чем плотность 6 % - ного раствора (х).
при изменении концентрации раствора на 2 % плотность изменяется на 0,019 г/мл (1,072-1,053)
при изменении концентрации раствора на 0,5 % плотность изменяется на х г/мл
х = 0.005 г/мл.
Плотность 6,5 %-ного раствора равна: сумме 6,0 %-ного раствора и х.
ρ6,5% = ρ6% + ρ0,5% = 1,053 + 0,005 = 1,058 г/мл.
2. Рассчитать массу заданного раствора:
mp-pa= V ∙ p = 100 ∙ 1,058 = 105,80 г.
3. Рассчитать массу растворенного вещества:
m(ВаС12) = mр-ра ∙ ω = 105,80 ∙ 0,065 = 6,88 г.
4. На технохимических весах взвесить 6,88 г ВаС12.
5. С помощью стеклянной воронки перенести соль в колбу, смыть дистиллированной водой остатки соли с воронки и довести объем до метки. Закрыть колбу пробкой и перемешать раствор, переворачивая колбу до исчезновения кристаллов соли.
6. С помощью ареометра измерить плотность полученного раствора (рис. 1). Для этого перелить раствор в цилиндр, подобрать ареометр по плотности раствора. Измерение плотности проводить под руководством преподавателя. Предположим, что плотность полученного раствора ρэксп = 1,059 г/мл.
7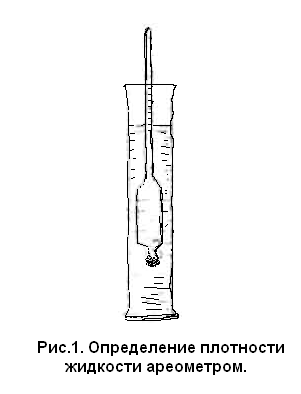 .
Определить концентрацию полученного
раствора ωэксп,
используя метод интерполяции (см. п. 1).
.
Определить концентрацию полученного
раствора ωэксп,
используя метод интерполяции (см. п. 1).
