
- •7. Элементарные частицы.
- •9. Функция распределения Ферми — Дирака.
- •10.Решение уравнения Шрёдингера для кристаллов. Волновая функция электронов в кристалле. Зона Бриллюэна.
- •13. Эффективная масса электрона в кристалле. Электроны и дырки.
- •14. Энергия Ферми. Поверхность Ферми. Заполнение энергетических зон: металлы, диэлектрики, полупроводники.
9. Функция распределения Ферми — Дирака.
В
квантовой теории вероятность заполнения
энергетических состояний
электронами определяется функцией
распределения Ферми- Дирака:![]() , (1.10)
где W -
энергия уровня, вероятность
заполнения которого определяется
при температуре T; k -
постоянная Больцмана.
Системы
микрочастиц, свойства которых
описываются распределением
Ферми-Дирака (1.10),
называются вырожденными.
При Т=0
график функции Ферми имеет вид,
изображенный на рис. 1.15, а.
Из
рис. 1.15, а и
формулы (1.10) при Т=0
вытекают следующие соотношения:
f(W,
0)=1 для W<WF, (1.11а)f(W,
0)=0 для W>WF,
(1.11б) f(W, 0)={0,1} для W=WF. (1.11в)
, (1.10)
где W -
энергия уровня, вероятность
заполнения которого определяется
при температуре T; k -
постоянная Больцмана.
Системы
микрочастиц, свойства которых
описываются распределением
Ферми-Дирака (1.10),
называются вырожденными.
При Т=0
график функции Ферми имеет вид,
изображенный на рис. 1.15, а.
Из
рис. 1.15, а и
формулы (1.10) при Т=0
вытекают следующие соотношения:
f(W,
0)=1 для W<WF, (1.11а)f(W,
0)=0 для W>WF,
(1.11б) f(W, 0)={0,1} для W=WF. (1.11в)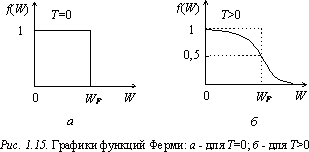 При нагревании металла электронам
сообщается тепловая энергия,
величина которой определяется
произведением kT.
Значение этой энергии невелико.
Например, при комнатной температуре
(около 300 К) значение тепловой энергии
электронов определяется
величиной Wт=0,026
эВ. Однако за счет теплового возбуждения
существует вероятность того, что
некоторые электроны с энергией,
близкой к энергии уровня Ферми, начинают
заполнять состояния
с более высокой энергией. В результате
график функции Ферми при Т=0
теряет ступенчатую форму и становится
более пологим, как это показано
на рис. 1.15, б.
Из формулы (1.10) для Т>0
вытекают следующие
соотношения:f(W, Т)
При нагревании металла электронам
сообщается тепловая энергия,
величина которой определяется
произведением kT.
Значение этой энергии невелико.
Например, при комнатной температуре
(около 300 К) значение тепловой энергии
электронов определяется
величиной Wт=0,026
эВ. Однако за счет теплового возбуждения
существует вероятность того, что
некоторые электроны с энергией,
близкой к энергии уровня Ферми, начинают
заполнять состояния
с более высокой энергией. В результате
график функции Ферми при Т=0
теряет ступенчатую форму и становится
более пологим, как это показано
на рис. 1.15, б.
Из формулы (1.10) для Т>0
вытекают следующие
соотношения:f(W, Т)![]() 1 для W<WF, (1.12а)f(W, Т)
1 для W<WF, (1.12а)f(W, Т)![]() 0 для W>WF,
(1.12б) f(W, Т)=1/2
для W=
WF.
(1.12в)Из соотношения (1.12в) следует, что
вероятность "нахождения" электрона
на уровне Ферми составляет 0,5.При
выполнении условия W-WF >>kT выражение
(1.10) для функции распределения Ферми-Дирака
переходит в закон распределения
Больцмана, т.е:
0 для W>WF,
(1.12б) f(W, Т)=1/2
для W=
WF.
(1.12в)Из соотношения (1.12в) следует, что
вероятность "нахождения" электрона
на уровне Ферми составляет 0,5.При
выполнении условия W-WF >>kT выражение
(1.10) для функции распределения Ферми-Дирака
переходит в закон распределения
Больцмана, т.е:![]() .
.
10. Строение кристаллов. Типы химических связей. Дефекты.Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места, Такие вещества называются кристаллическими. Атомы совершают относительно своего среднего положения колебания с частотой около 1013 Гц. Амплитуда этих колебаний пропорциональна температуре. Благодаря упорядоченному расположению атомов в пространстве, их центры можно соединить воображаемыми прямыми линиями. Совокупность таких пересекающихся линий представляет пространственную решетку, которую называют кристаллической решеткой. Кристаллические твердые тела состоят из кристаллических зерен - кристаллитов. В соседних зернах кристаллические решетки повернуты относительно друг друга на некоторый угол. Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью. Металлы имеют относительно сложные типы кубических решеток - объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки. Основу ОЦК-решетки составляет элементарная кубическая ячейка, в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы. У ГЦК-решетки элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы. Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная. ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями. Дефекты. В решетке реального металла могут находиться различные дефекты. Все дефекты кристаллической решетки принято делить на точечные, линейные, поверхностные и объемные. Точечные дефекты соизмеримы с размерами атомов. К ним относятся вакансии, т. е. незаполненные узлы решетки, межузельные атомы данного металла, примесные атомы замещения, т. е. атомы, по диаметру соизмеримые с атомами данного металла и примесные атомы внедрения, имеющие очень малые размеры и поэтому находящиеся в междоузлиях. Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера. Линейные дефекты имеют длину, значительно превышающую их поперечные размеры. К ним относятся дислокации, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей. Дислокации бывают двух видов. Наиболее характерной является краевая дислокация . Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости. Нижний ряд экстраплоскости собственно и принято называть дислокацией. Другим типом дислокации является винтовая дислокация, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости. Поверхностные дефекты включают в себя главным образом границы зерен. На границах кристаллическая решетка сильно искажена. В них скапливаются перемещающиеся изнутри зерен дислокации. Объемные дефекты кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность. Типы химических связей. Различают два вида связи. Один из них осуществляется в тех молекулах, в которых часть электронов движется около обоих ядер. Такая связь называется гомеополярной (или ковалентной, или атомной). Она образуется парами электронов с противоположно направленными спинами. Среди молекул этого типа следует различать молекулы с одинаковыми ядрами (Н2, N2, 02) и молекулы с разными ядрами (например, СN), В молекулах первого рода электроны распределены симметрично. В молекулах второго рода имеется некоторая асимметрия в распределении электронов, благодаря чему молекулы приобретают электрический дипольный момент. Второй тип связи имеет место, когда электроны в молекуле- можно разделить на две группы, каждая из которых все время находится около одного из ядер. Электроны распределяются так, что около одного из ядер образуется избыток электронов, а около другого — их недостаток. Таким образом, молекула как бы состоит из двух ионов противоположных знаков, притягивающихся друг к другу. Связь этого типа называется гетерополярной (или и о н н ой). Примером молекул с гетерополярной связью могут служить NаСl, КВг, НСl и т. д.
