
- •Свириденко о.Ф Конспект лекцій з фізики
- •Основи молекулярної фізики
- •Частина і. Основи молекулярно-кінетичної теорії
- •Тема 1. Основні положення і поняття мкт будови речовини
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 2. Властивості ідеального газу
- •3. Мікропараметри газу
- •2. Наслідки ор мкт іг
- •7. Види термодинамічних процесів
- •Приклади розв’язування задач
- •8. Методика розв’язування графічних задач на ізопроцеси
- •Питання для самоперевірки
- •Тема 3. Властивості пари
- •1. Властивості випаровування
- •2. Випаровування рідини у герметично закритій посудині
- •3. Властивості насиченої пари
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 4. Властивості рідин
- •1. Характеристика рідкого стану речовини
- •2. Поверхневий шар рідини
- •3. Спостереження явища поверхневого натягу
- •3. Поняття про в’язкість середовища
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 5. Властивості Твердого стану речовини
- •2. Ізотропія та анізотропія
- •3. Механічні властивості.
- •2. Класифікація твердих тіл і їх властивості
- •4. Типи кристалів
- •Характеристика різних типів кристалів за типами їх решіток
- •1. Види деформації
- •Пружні – зникають після зняття навантаження, внаслідок чого форма і розміри тіл повністю відновлюються.
- •2. Кількісна характеристика деформації
- •3. Закон пружних деформацій (закон Гука)
- •7. Плавлення і кристалізація
- •9. Теплове розширення тіл
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 1. Внутрішня енергія і способи її зміни
- •Термодинаміка (тд) вивчає теплові явища і процеси, не враховуючи молекулярну будову речовини.
- •Приклади розв’язування задач
- •ПЩо таке внутрішня енергія?Що називають тепловим двигуном?итання для самоперевірки
- •Тема 2. Закони термодинаміки
- •1. І закон термодинаміки (і зтд) – це закон збереження і перетворення енергії при теплових процесах.
- •3. Застосування і зтд до ізопроцесів
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 3. Теплові машини (двигуни)
- •3. Цикл Карно
- •4. Способи підвищення ккд тм
- •5. Застосування тм
- •6. Проблеми екології довкілля, пов’язані з використанням тм
- •7. Шляхи зниження шкідливого впливу роботи тм
- •Принцип дії холодильної машини
- •Приклади розв’язування задач
- •ПЩо таке внутрішня енергія?Що називають тепловим двигуном?итання для самоперевірки
- •Рекомендовані джерела інформації
Приклади розв’язування задач
Скільки атомів міститься у мідній деталі масою 6,4 кг?
|
Дано: t 1 = 727°C;m = 6,4 кг Nа = 6,022·1023 1/моль Мt 2 = 100°C;ММЬььььььь = 6,4 ·10-2 кг/моль |
Розв’язання:
|
|
N – ? |
Маса 1 кмоль водяної пари 18 кг. Визначити її густину за нормальних умов.
|
Дано: t 1 = 727°C;ν = 103 моль m = 18 кг V0 = 2,24·10-2 м3 |
Розв'язання:
|
|
ρ0 - ? |
Гранично допустима концентрація молекул пари ртуті у повітрі 3·1016 м-3. Визначити, при якій масі ртуті в одному кубічному метрі повітря виникне небезпека отруєння?
|
Дано: t 1 = 727°C;ппппппопопопп = 3·1016 м-3 V = 1 м3 М = 0,2 кг/моль |
Розв'язання:
|
|
тгр – ? |
Питання для самоперевірки
Які явища називають тепловими ?
Який рух називають тепловим? Чим він відрізняється від механічного руху?
Які об’єкти називають мікросистемами? макросистемами?
Який рух називають броунівським? Навести приклади.
Пояснити фізичний зміст дифузії?
Від чого і як залежить швидкість дифузії?
Дослід Штерна.
Які параметри відповідають нормальним умовам?
Пояснити фізичний зміст:
числа Авогадро;
числа Лошмідта;
температури;
абсолютної температури;
концентрації;
густини;
кількості речовини;
атомної маси;
молекулярної маси;
молярної маси;
тиску;
молярного об’єму.
Тема 2. Властивості ідеального газу
Ідеальний газ (ІГ) – модель реального газу, для якої приймаються такі умови:
молекули розташовані на значних відстанях (мала концентрація): r >> dеф

молекули – матеріальні точки;

відсутня міжмолекулярна взаємодія між молекулами
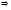

 Еn
=
0;
Еn
=
0;
молекули взаємодіють при ударах між собою і з стінками посудини пружно
 виконуються
закони збереження імпульсу і механічної
енергії.
виконуються
закони збереження імпульсу і механічної
енергії.
Введення цієї моделі газу зумовлене тим, що теоретично врахувати рух, взаємодію і розміри молекул вкрай складно. Реальні розріджені гази поводяться подібно до ідеального.
Основні макропараметри газу
Об’єм V газу визначається розмірами посудини, в якій він міститься
 ;
;
 ;
; ;
;
Тиск газу р – це сумарний імпульс, який передають молекули газу стінкам посудини за певний інтервал часу.
Закон Дальтона: тиск суміші газів, що не реагують = суміші їх парціальних тисків:
 .
(13)
.
(13)
Парціальний тиск – це тиск, який у суміші газів чинить кожний газ окремо, незалежно від дії інших газів.
Температура Т
T = t + 273; t = (Т – 273) 0C (14)
3. Мікропараметри газу
Середня кінетична енергія поступального руху молекул
 (15)
(15)
Середня квадратична швидкість молекул (~102
 103
м/с, практично визначив Штерн)
103
м/с, практично визначив Штерн)
 (16)
(16)
де
 –
універсальна газова стала;
–
універсальна газова стала;
 – стала Больцмана.
– стала Больцмана.
* 3. До поняття швидкості молекул газу
Статистичний розподіл Максвелла
Хаотичний рух молекул газу, який перебуває у рівноважному ТДСт вивчав англійський вчений Д. Максвелл. Виявилось, що швидкості руху молекул повинні мати досить різні значення. У 1850 р. зо допомогою теорії імовірності Максвелл знайшов математичний вираз закону розподілу молекул газу, який перебуває у рівноважному ТДСт, за швидкостями їх хаотичного руху, графік якого має вигляд, зображений на рис. 5 (по вертикальній осі відкладено кількість молекул, що мають певну швидкість).

Рис. 5
Значення розподілу Максвелла для МКТ газів – це перший приклад статистичного закону у науці; Дж. Максвелл усвідомив, що випадковий рух окремих молекул підпорядкований певному статистичному закону.
Висновки з розподілу Максвелла:
Крива розподілу Максвелла проходить через початок координат
 немає
молекул, які б не рухались.
немає
молекул, які б не рухались.Крива має максимум, після якого асимптотично наближається до осі абсцис
 дуже
великі швидкості мало імовірні.
Вони можливі тільки за умови, що молекула
при багатьох зіткненнях з іншими
молекулами діставатиме енергію, а не
віддаватиме її, що малоймовірно.
дуже
великі швидкості мало імовірні.
Вони можливі тільки за умови, що молекула
при багатьох зіткненнях з іншими
молекулами діставатиме енергію, а не
віддаватиме її, що малоймовірно.Крива розподілу швидкостей не є симетрична – в один бік спад кривої крутіший, ніж в інший.
При збільшенні температури крива зміщується вправо
 швидкості
молекул збільшуються при підвищенні
температури.
швидкості
молекул збільшуються при підвищенні
температури.Максимум кривої вказує на існування певної швидкості руху молекул
 ,
поблизу якої на даний інтервал швидкостей
,
поблизу якої на даний інтервал швидкостей припадає більша кількість молекул, ніж
поблизу будь-якої іншої швидкості. Ця
швидкість
припадає більша кількість молекул, ніж
поблизу будь-якої іншої швидкості. Ця
швидкість називається найімовірнішою швидкістю:
називається найімовірнішою швидкістю: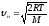 .
.
Дослід Штерна
Вивчення дифузії і броунівського руху дає змогу дістати деяке уявлення про швидкість хаотичного руху молекул газу. Одним з найпростіших наочних дослідів для її визначення є дослід Штерна (1920 р.).
Зміст досліду.
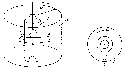
Рис. 6
На
горизонтальному столі розміщено жорстко
зв’язані між собою циліндри А (з вузькою
щілиною О вздовж твірної) і В (суцільний)
різних діаметрів (рис. 6), вздовж спільної
осі яких натягнуто платинова посріблена
дротина радіусом r; повітря з циліндрів
відкачано до високого вакууму (10-8
Па). По дротині пропускають струм
 вона нагрівається
вона нагрівається з її поверхні випаровуються молекули
срібла, які осідають в основному на
внутрішніх стінках циліндра А. Невелика
їх кількість вилітає через щілину і
осідає на поверхні циліндру В вузькою
смужкою 1, утворюючи зображення щілини.
При обертанні циліндрів навколо осі О
з постійною швидкістю ω за час t, протягом
якого молекули пролітають відстань R –
r від щілини до циліндра В, він встигає
повернутись на кут φ = ωt
з її поверхні випаровуються молекули
срібла, які осідають в основному на
внутрішніх стінках циліндра А. Невелика
їх кількість вилітає через щілину і
осідає на поверхні циліндру В вузькою
смужкою 1, утворюючи зображення щілини.
При обертанні циліндрів навколо осі О
з постійною швидкістю ω за час t, протягом
якого молекули пролітають відстань R –
r від щілини до циліндра В, він встигає
повернутись на кут φ = ωt атоми потрапляють в інше місце 2, розміщене
на відстані d від попереднього.
атоми потрапляють в інше місце 2, розміщене
на відстані d від попереднього.
Розрахунок швидкості молекул:
 ,
,




Висновки з досліду Штерна:
Наліт молекул на поверхні циліндру у місці 2 розмивається
 молекули
мають різну швидкість (молекули,
які рухаються повільніше, зміщуються
на більшу відстань).
молекули
мають різну швидкість (молекули,
які рухаються повільніше, зміщуються
на більшу відстань).При збільшенні сили струму в дротині зростає її температура
 наліт зміщується на більшу відстань
наліт зміщується на більшу відстань швидкості
молекул збільшуються.
швидкості
молекул збільшуються.Вигляд нальоту молекул на поверхні циліндру є точною копією теоретичної кривої Максвелла
 дослід
Штерна яскраво доводить правильність
теорії Максвелла.
дослід
Штерна яскраво доводить правильність
теорії Максвелла.
Значення
 молекул деяких газів при p0
і T0
молекул деяких газів при p0
і T0
|
Газ |
υ, м/с |
Газ |
υ, м/с |
|
Азот |
454 |
Гелій |
1200 |
|
Водень |
1693 |
Кисень |
425 |
|
Вуглекислий газ |
362 |
Водяна пара |
566 |
4. Довжина
вільного пробігу λ
– відстань, яку проходить молекула між
двома послідовними зіткненнями. Середня
довжина вільного пробігу

 ,
(17)
,
(17)
де
 –
середнє
число зіткнень
молекули
газу за 1 с, тоді сума в чисельнику цієї
формули визначає шлях, пройдений
молекулою за 1 с, тобто середню швидкість
руху молекули. Отже,
–
середнє
число зіткнень
молекули
газу за 1 с, тоді сума в чисельнику цієї
формули визначає шлях, пройдений
молекулою за 1 с, тобто середню швидкість
руху молекули. Отже,
 (18)
(18)
|
4.
Основне рівняння (ОР) МКТ ІГ
–
це рівняння, яке пов’язує мікро- і
макропараметри ІГ (а саме: встановлює
залежність тиску ІГ від його
мікропараметрів
|
|
(19) |
|
|
(20) |
* 1. Вивід основного рівняння МКТ ідеального газу (на основі законів механіки)
Візьмемо
посудину у формі куба з ребром l
(рис. 72). Концентрація молекул у кубі п.
Нехай молекула безперешкодно рухається
між лівою і правою стінками куба. При
взаємодії молекули зі стінкою посудини
вона передає останній імпульс
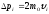 (
( –
швидкість і-тої молекули). Відповідно
до ІІ закону Ньютона, середня сила дії
молекули на стінку
–
швидкість і-тої молекули). Відповідно
до ІІ закону Ньютона, середня сила дії
молекули на стінку ,
де
,
де – час руху молекули від однієї стінки
до другої і назад, тобто
– час руху молекули від однієї стінки
до другої і назад, тобто ,
оскільки молекула наносить стінці удари
з таким проміжком часу. Отже,
,
оскільки молекула наносить стінці удари
з таким проміжком часу. Отже, .
Сила тиску на стінку посудини = силі
ударів окремих молекул об цю стінку:
.
Сила тиску на стінку посудини = силі
ударів окремих молекул об цю стінку:

Рис.7


 де
де
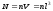 – загальна кількість молекул, які
літають між двома протилежними стінками
куба.
– загальна кількість молекул, які
літають між двома протилежними стінками
куба.
Внаслідок
повної хаотичності руху молекул для
кожної з них всі напрями руху рівноймовірні.
Тому можна вважати, що вздовж кожного
з трьох взаємно перпендикулярних
напрямів рухається 1/3 загального числа
молекул
 для обчислення тиску можна вважати, що
між двома протилежними стінками куба
вздовж перпендикуляра до них рухається
1/3 загального числа молекул, тобто
для обчислення тиску можна вважати, що
між двома протилежними стінками куба
вздовж перпендикуляра до них рухається
1/3 загального числа молекул, тобто

 .
.
Оскільки



Оскільки











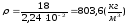
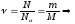





 і
і )
)
