
- •Свириденко о.Ф Конспект лекцій з фізики
- •Основи молекулярної фізики
- •Частина і. Основи молекулярно-кінетичної теорії
- •Тема 1. Основні положення і поняття мкт будови речовини
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 2. Властивості ідеального газу
- •3. Мікропараметри газу
- •2. Наслідки ор мкт іг
- •7. Види термодинамічних процесів
- •Приклади розв’язування задач
- •8. Методика розв’язування графічних задач на ізопроцеси
- •Питання для самоперевірки
- •Тема 3. Властивості пари
- •1. Властивості випаровування
- •2. Випаровування рідини у герметично закритій посудині
- •3. Властивості насиченої пари
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 4. Властивості рідин
- •1. Характеристика рідкого стану речовини
- •2. Поверхневий шар рідини
- •3. Спостереження явища поверхневого натягу
- •3. Поняття про в’язкість середовища
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 5. Властивості Твердого стану речовини
- •2. Ізотропія та анізотропія
- •3. Механічні властивості.
- •2. Класифікація твердих тіл і їх властивості
- •4. Типи кристалів
- •Характеристика різних типів кристалів за типами їх решіток
- •1. Види деформації
- •Пружні – зникають після зняття навантаження, внаслідок чого форма і розміри тіл повністю відновлюються.
- •2. Кількісна характеристика деформації
- •3. Закон пружних деформацій (закон Гука)
- •7. Плавлення і кристалізація
- •9. Теплове розширення тіл
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 1. Внутрішня енергія і способи її зміни
- •Термодинаміка (тд) вивчає теплові явища і процеси, не враховуючи молекулярну будову речовини.
- •Приклади розв’язування задач
- •ПЩо таке внутрішня енергія?Що називають тепловим двигуном?итання для самоперевірки
- •Тема 2. Закони термодинаміки
- •1. І закон термодинаміки (і зтд) – це закон збереження і перетворення енергії при теплових процесах.
- •3. Застосування і зтд до ізопроцесів
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 3. Теплові машини (двигуни)
- •3. Цикл Карно
- •4. Способи підвищення ккд тм
- •5. Застосування тм
- •6. Проблеми екології довкілля, пов’язані з використанням тм
- •7. Шляхи зниження шкідливого впливу роботи тм
- •Принцип дії холодильної машини
- •Приклади розв’язування задач
- •ПЩо таке внутрішня енергія?Що називають тепловим двигуном?итання для самоперевірки
- •Рекомендовані джерела інформації
Тема 2. Закони термодинаміки
1. І закон термодинаміки (і зтд) – це закон збереження і перетворення енергії при теплових процесах.
Кількість теплоти, отримана ТДС у ході теплового процесу, іде на збільшення її внутрішньої енергії і на виконання нею роботи.
Q = ΔU + A (77)
І ЗТД заперечує можливість створення вічного двигуна І роду:
Не можна створити машину, яка б необмежено виконувала роботу, не отримуючи енергію ззовні, бо якщо
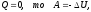 тобто робота виконуватиметься за
рахунок внутрішньої енергії, яка не є
безмежною.
тобто робота виконуватиметься за
рахунок внутрішньої енергії, яка не є
безмежною.2. Адіабатний процес – ТДП, який відбувається без теплообміну із зовнішнім середовищем (або ТДС – ізольована, або ТДП – дуже швидкий): Q = 0 (Q = const). (78)
Приклад: стиск повітря у дизельному двигуні розширення пари шампанського при вильоті корка, розширення нагрітого повітря при підніманні у верхні шари атмосфери.
3. Застосування і зтд до ізопроцесів
ТДП
Отримана газом Q
Здійснена газом А
Зміна U
І ЗТД
Формулювання І ЗТД
Ізотермічний
T = const
Q > 0
А > 0
ΔU = 0
Q = ΔA
Передана газом кількість теплоти витрачається на виконання ним роботи
Ізохорний
V = const
Q > 0
А = 0
ΔU > 0
Q = ΔU
Передана газом кількість теплоти йде на збільшення його внутрішньої енергії
Ізобарний
p = const
Q > 0
А > 0
ΔU > 0
Q =ΔU + А
Передана газом кількість теплоти йде на збільшення його внутрішньої енергії і виконання ним роботи
Адіабатний
Q = const
Q = 0
А < 0
ΔU < 0
ΔU = –А = А´
А = – ΔU
Під час розширення газу виконується робота за рахунок його внутрішньої енергії. Або: Внутрішня енергія газу збільшується за рахунок роботи зовнішніх сил
*4. Застосування І ЗТД до ізопроцесів
Ізотермічний процес
 (79)
(79)Вся кількість теплоти, отримана газом при ізотермічному процесі, іде на виконання ним роботи розширення газу.
 теплоємність
речовини при цьому процесі не має
фізичного змісту, оскільки не має
нагрівання.
теплоємність
речовини при цьому процесі не має
фізичного змісту, оскільки не має
нагрівання.
Ізохорний процес
 (80)
(80)Вся кількість теплоти, отримана газом при ізохорному процесі, іде на його нагрівання.
Теплоємність при ізохорному процесі (для 1-атомного газу)
 ;
(81)
;
(81)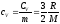 ;
;
 .
(82)
.
(82)
Ізобарний процес
 (83)
(83)Вся кількість теплоти, отримана газом при ізобарному процесі, іде на його нагрівання і на виконання ним роботи розширення газу.
Теплоємність при ізобарному процесі (для 1-атомного газу)
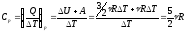 ;
(84)
;
(84) ;
;
 .
(85)
.
(85)Як видно, теплоємності при сталому тиску і сталому об’ємі відрізняються:
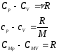 (86)
(86)
Рівняння Майєра встановлює зв’язок між теплоємностями при сталому тиску і сталому об’ємі.
Така різниця пояснюється тим, що Q, отримана газом при V = const, іде тільки на нагрівання, а при p = const, – ще і на виконання А.
Адіабатний процес – це ТДП, який відбувається у теплоізольованій системі.
0
 V
VРис. 38
