
Методы очистки веществ
.docxМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Башкирский государственный педагогический
университет им.М. Акмуллы»
(ФГБОУ ВПО БГПУ им.М. Акмуллы)
План-конспект урока на тему:
« Методы очистки веществ»
Выполнил: Маркова Е.
Проверил: к.х.н. Рашидова С.Т.
Уфа, 2013
Методы очистки веществ
Теоретическая часть
Методы очистки и разделения веществ основаны на использовании их различий в химических и физических свойствах. Примерами подобных способов разделения являются перекристаллизация, возгонка и поглощение.
Перекристаллизация - метод очистки, основанный на использовании зависимости растворимости веществ от температуры. Обычно перекристаллизация сводится к растворению вещества в подходящем растворителе при одной температуре и последующем выделении кристаллического осадка при другой температуре, когда раствор становится пересыщенным. Пересыщение одного раствора солей можно достигнуть также путем добавления различных добавок, например, спирта.
Возгонка или сублимация - непосредственное превращение твердого вещества в пар (обычно - при нагревании) минуя жидкое состояние. В дальнейшем пар может быть сконденсирован в кристаллы на охлаждаемой поверхности. Возгонка всегда происходит при температуре ниже температуры плавления вещества. Способностью к возгонке обычно обладают твердые вещества с молекулярной структурой (йод, нафталин, нашатырь, бензойная кислота). Очистка методом возгонки становится возможной в том случае, когда примеси не возгоняются.
Перегонка или дистилляция - метод очистки, основанный на превращении жидкости в пар с последующей конденсацией пара в жидкость. Метод обычно используют для отделения жидкости от растворенных в ней твердых веществ или других нелетучих примесей. Этим методом невозможно разделить компоненты с близкими способностями к парообразованию.
Вода, полученная в результате перегонки, называется дистиллированной.
Метод перекристаллизации основан на различной зависимости растворимости вещества и загрязняющих его примесей от температуры. Перекристаллизацию проводят следующим образом: при повышенной температуре (60 °С) готовят насыщенный раствор очищаемого вещества, полученный раствор фильтруют через воронку для горячего фильтрования для удаления нерастворимых примесей, затем раствор охлаждают. При понижении температуры растворимость вещества понижается и основная часть очищаемого вещества выпадает в осадок. Примеси остаются в растворе, поскольку полученный раствор относительно их остается ненасыщенным. Полученные кристаллы отфильтровывают. Метод позволяет очищать вещества, растворимые в воде, например: хлорид натрия, хлорид аммония, дихромат калия, сульфат меди и др.
Метод сублимации (возгонки) используется для очистки твердых веществ, способных при нагревании переходить из твердой фазы непосредственно в газовую, минуя жидкую фазу. Образующийся газ конденсируется в охлаждаемой части прибора. Возгонку проводят при температуре близкой к температуре плавления вещества. Возможна очистка только от примесей, не способных возгоняться. Метод позволяет очищать вещества, способные возгоняться, например: йод, сера, хлорид аммония и др.
Экспериментальная часть
Опыт 2.1. Очистка йода возгонкой
1. На технохимических весах взвесили 0,3 г кристаллического йода и 0,1 г йодида калия, поместили их в термостойкий стакан для возгонки.
2. Стакан накрыли круглодонной колбой с холодной водой.
3. Стакан осторожно нагревали на электроплите под тягой. Наблюдали возникновение фиолетовых паров и оседание йода на стенках круглодонной колбы.
4. После завершения возгонки нагрев прекратили, кристаллы йода осторожно перенесли на предварительно взвешенную бумагу.
5. Определили массу йода, полученного при возгонке. Она оказалась равной 0,23 г.
6. Определили практический выход йода при очистке по формуле:
Вывод:
Провели очистку йода методом возгонки. Практический выход очищенного йода составил
Опыт 2.2. Очистка воды перегонкой
Рисунок 1. Прибор для перегонки
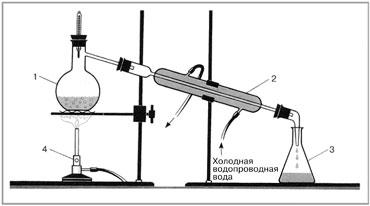
1. Собрали установку для перегонки воды, схема которой приведена на рисунке 1
Цифрами обозначены:
1 - колба Вюрца с очищаемой водой;
2 - термометр;
3 - холодильник Либиха;
4 - приемник для перегнанной жид-
кости;
5 - холодная вода из водопровода;
6 - слив охлаждающей воды
2. Нагревали воду в колбе Вюрца до кипения.
3. Отбросили первые порции дистиллированной воды.
4. Собрали 20 мл дистиллированной воды в коническую колбу.
5. Провели выпаривание на стекле дистиллированной воды и обычной водопроводной воды. Обнаружили, что при выпаривании водопроводной воды остается сухой остаток (белый налет), указывающий на наличие примесей в ней. При выпаривании дистиллированной воды никакого остатка не образуется.
Вывод:
Провели очистку воды методом дистилляции. Обнаружили, что в дистиллированной воде отсутствуют примеси нелетучих веществ.
Опыт 2.3. Очистка углекислого газа
Для получения углекислого газа использовали аппарат Киппа, снаряженный кусками мрамора и 20%-ной соляной кислотой. Образование CO2 происходит по реакции:
CaCO3(тв.) + 2HCl(вод.) CaCl2(вод.) + CO2(газ) + H2O
В качестве примесей к основному продукту могут выступать пары воды и хлороводород.
1. Получаемый в аппарате Киппа газ пропускали через воду в пробирке в течение 2 минут.
2. Проверили наличие хлорид-ионы в полученном растворе с использованием раствора азотнокислого серебра. Наблюдали возникновение помутнения, указывающее на образование AgCl. Данный результат подтверждает присутствие HCl в газообразных продуктах реакции.
3. Получаемый в аппарате газ пропускали через хлоркальциевую трубку, заполненную безводным сульфатом меди (II). Наблюдали возникновение синего окрашивания твердого вещества, указывающего на наличие паров воды в газообразных продуктах реакции.
4. Собрали установку по получению чистого углекислого газа согласно схеме, приведенной на рисунке 2.
5. Экспериментально подтвердили отсутствие примесей HCl и H2O в получаемом углекислом газе.
Опыт 2.4 Очистка твердых веществ.
Задача лабораторной работы: получить m г чистого дихромата калия методом перекристаллизации. Значение m указывается преподавателем каждому учащемуся. Перед выполнением лабораторной работы необходимо выполнить предварительные расчеты.
Предварительные расчеты (пример при m = 10 г):
Необходимо рассчитать количество соли (в г) и воды (в мл), которые потребуются для получения 10 г чистого вещества. Перекристаллизацию проводят при нагревании до 60 °С и охлаждении раствора до 20 °С.
1. Используя справочную литературу, по таблице растворимости солей при различных температурах определяем растворимость дихромата калия при 20 °С и при 60 °С. Растворимость при 20 °С составляет 11,1 г соли в 100 г раствора, при 60 °С – 31,2 г в 100 г раствора.
2. Вычислим количество соли, которое можно получить при охлаждении до 20 °С 100 г раствора, насыщенного при 60 °С: при 60 °С в насыщенном растворе содержится 31,2 г соли и 68,8 г воды (100 – 31,2), при охлаждении этого раствора до 20 °С количество воды останется неизменным – 68,8 г, а 31,2 г соли распределятся между раствором, насыщенным при 20 °С, и осадком. Определим количество соли, которое останется в растворе. При 20 °С насыщенный раствор массой 100 г содержит 11,1 г соли и 88,9 г воды. Составим пропорцию:
11,1 г соли растворятся в 88,9 г воды,
m г соли растворяется в 68,8 г воды, тогда
![]() (г);
(г);
следовательно, в растворе останется:
m (соли)р-р = m (соли)исх. - m (соли)осадок = 31,2 - 8,6 = 22,6 (г).
Таким образом, при охлаждении до 20 °С 100 г раствора, насыщенного при 60 °С, содержащего 31,2 г соли и 68,8 г воды, образуется 22,6 г осадка (чистой соли).
3. Вычислим количество соли и воды, необходимых для получения 10 г чистой соли. Составим пропорции:
если взять 31,2 г соли, образуется 22,6 г осадка,
если взять m1 г соли, образуется 10 г осадка, тогда
![]() (г);
(г);
если взять 68,8 г воды, образуется 22,6 г осадка,
если взять m2 г воды, образуется 10 г осадка, тогда
![]() (г).
(г).
Вычислим объем воды. Плотность воды равна 1 г/мл, следовательно:
![]() (мл).
(мл).
Таким образом, для получения 10 г чистой соли необходимо взять 13,8 г дихромата калия и 30,4 мл воды. К массе соли добавим 10 %, учитывая массу содержащихся примесей:
m (соли) = 13,8 + 0,1 · 13,8 = 15,2 (г).
Порядок выполнения работы
1. Наливаем в стакан отмеренное мерным цилиндром рассчитанное количество воды.
2. Взвешиваем на весах рассчитанное количество соли.
3. Растираем соль в фарфоровой ступке.
4. Помещаем растертую соль в стакан с водой и нагреваем раствор почти до кипения на электрической плитке с асбестовой сеткой, перемешивая стеклянной палочкой.
5. Полученный раствор отфильтровываем через складчатый фильтр, используя воронку для горячего фильтрования для удаления нерастворимых примесей.
6. Охлаждаем полученный раствор до 20 °С.
7. Выпавшие кристаллы отфильтровываем через предварительно взвешенный фильтр.
8. Несколько кристалликов полученной соли растворяем в 2 мл дистиллированной воды и добавляем 1–2 капли раствора нитрата серебра для определения наличия хлоридов.
9. Несколько кристалликов полученной соли растворяем в 2 мл дистиллированной воды и добавляем 1–2 капли раствора хлорида бария для определения наличия сульфатов.
10. Если образуются осадки хлорида серебра и/или сульфата бария, то проводим повторную перекристаллизацию, предварительно рассчитав количество воды, необходимое для приготовления насыщенного при 60 °С раствора, содержащего полученную массу соли.
11. Перекристаллизованный чистый дихромат калия на фильтре помещаем в фарфоровую чашку и высушиваем в сушильном шкафу при 60 °С до постоянной массы (взвешивание проводим каждые 15–20 минут, если после 2 взвешиваний масса не изменилась, то соль высушена).
12. Определяем массу полученной соли, отняв из массы соли с фильтром массу фильтра.
13. Рассчитываем практический выход:
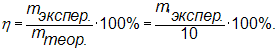
Выход должен составлять не менее 80 %.
