
- •Гидролиз и щелочное дегидрохлорирование хлорпроизводных
- •Получение эпихлоргидрина
- •Получение глицерина из эпихлоргидрина
- •Процессы гидратации и дегидратации
- •Механизм и кинетика реакций
- •Побочные реакции и селективность процесса
- •Прямая гидратация олефинов
- •Производство этанола
- •Гидратация ацетилена с ртутным катализатором
- •С нЕртутным катализатором
- •Гидратация ацетилена с нертутным катализатором
- •Процессы дегидратации Дегидратация с образованием соединений с ненасыщенной связью Получение изобутена
- •Дегидратация с образованием простых эфиров
- •Дегидратация карбоновых кислот
- •Технология процессов дегидрирования
- •Химия и теоретические основы процесса этерификации Процессы получения сложных эфиров (процессы этерификации)
- •Термодинамика реакций этерификации
- •Механизм и кинетика реакций
- •Получаемые продукты
- •Технология процесса этерификации. 4 вида процесса
- •Получение эфиров из хлорангидридов. Карбонаты и эфиры кислот фосфора Синтез хлоркарбонатов и карбонатов
- •Эфиры кислот фосфора
- •Синтез и превращения азотпроизводных кислот Азотпроизводные карбоновых кислот Амидирование
- •Дегидратация амидов и гидратация нитрилов
- •Гидролиз и этерификация нитрилов
- •Синтез и превращения азотпроизводных угольной кислоты
- •Синтез изоцианатов
- •Замещенные карбамиды
- •Технология производства меламина
- •Характеристика процессов алкилирования
- •Алкилирующие агенты и катализаторы
- •Энергетическая характеристика основных реакций алкилирования
- •Алкилирование по атому углерода, c-алкилирование Катализаторы
- •Последовательное алкилирование
- •Кинетика процесса
- •Побочные реакции: Смолообразование, Деструкция алкильных групп, Полимеризация олефинов
- •Термическая газификация топлив
- •Алкилирование фенолов
- •Получаемые продукты
- •Технология процесса
- •Алкилирование парафинов
- •Технология процесса
- •Алкилирование по атому кислорода, о-алкилирование
- •Синтез меркаптанов из олефинов и сероводорода
- •Алкилирование по атому азота (n-алкилирование)
- •Синтез аминов из хлорпроизводных
- •Получаемые продукты
- •Технология процесса
- •Синтез аминов из спиртов
- •Технология процесса
- •Синтез кремнийорганических соединений
- •Другие реакции алкилирования по атому кремния
- •Алюминийорганические соединения и синтезы на их основе
- •Алюминийорганический синтез Производство линейных α-олефинов
- •Синтез линейных первичных спиртов
- •Невошедшее
- •Реакционный узел
- •Т ехнологическая схема производства этил- и изопропилбензола
Термическая газификация топлив
Высокотемпературная конверсия углеводородов отличается высокой температурой (1350-1450 °C) и отсутствием катализаторов. Процесс состоит в неполном термическом окислении метана или жидких фракций нефти, причем главной первичной реакцией в случае метана явл. окисление его в смесь CO, H2O и H2:
![]()
В небольшом количестве образуются также СО2, и за счет реакций пиролиза углеводороды С3 и С2, в том числе ацетилен. В заключительной стадии процесса водяной пар конвертирует оставшиеся углеводороды до СО и Н2, причем устанавливается равновесие между оксидами углерода, которое при высокой температуре сильно смещено в пользу CО. Видимо, при разложении ацетилена выделяется углерод (сажа), также способный к конверсии водяным паром (С + H2O → CO + Н2). Выход сажи особенно значителен при высокотемпературной конверсии жидких углеводородов, и для его снижения в этом случае добавляют к исходному сырью водяной пар. Таким образом, этот процесс во многом аналогичен окислительному пиролизу углеводородов на ацетилен, отличаясь от него лишь относительно большим временем пребывания смеси при высокой температуре (≈1 с вместо 0,001-0,01 с). Суммарные уравнения реакций при высокотемпературной конверсии метана и жидких углеводородов таковы:
![]()
Следовательно, соотношение Н2 и СО зависимости от исходного сырья может меняться от 2:1 до 1:1. Кроме того, в газе находятся 2-3% (об.) СО2, 0,3-0,5% (об.) СН4 и до 1% (об.) N2 и Ar.
Лекция №12 (12 мая 2023)
Алкилирование фенолов
Фенолы образуют с AlCl3 неактивные соли ArOAlCl2, поэтому для алкилирования фенолов в качестве катализаторов применяют протонные кислоты
или металлоксидные катализаторы кислотного типа. Это позволяет использовать в качестве алкилирующих агентов только спирты и олефины. Наряду с продуктами замещения в ядре получается немного простых эфиров фенола, которые легко перегруппировываются в алкилфенолы:
![]()
Установлено, однако, что алкилфенолы преимущественно образуются путем прямого алкилирования в ядро. Механизм этой реакции аналогичен
рассмотренному ранее для ароматически; углеводородов, причем гидроксигруппа фенолов сильно активирует в особенности 4- и 2-положения при почти полном отсутствии в продуктах мета-изомеров.
Алкилирование протекает последовательно с образованием моно-, ди- и триалкилфенолов, но одновременно происходит катализируемая кислотами
перегруппировка с миграцией орто-алкильных групп с образованием параизомеров, которые в данном случае являются термодинамически наиболее стабильными. Т.о., схема превращений следующая:
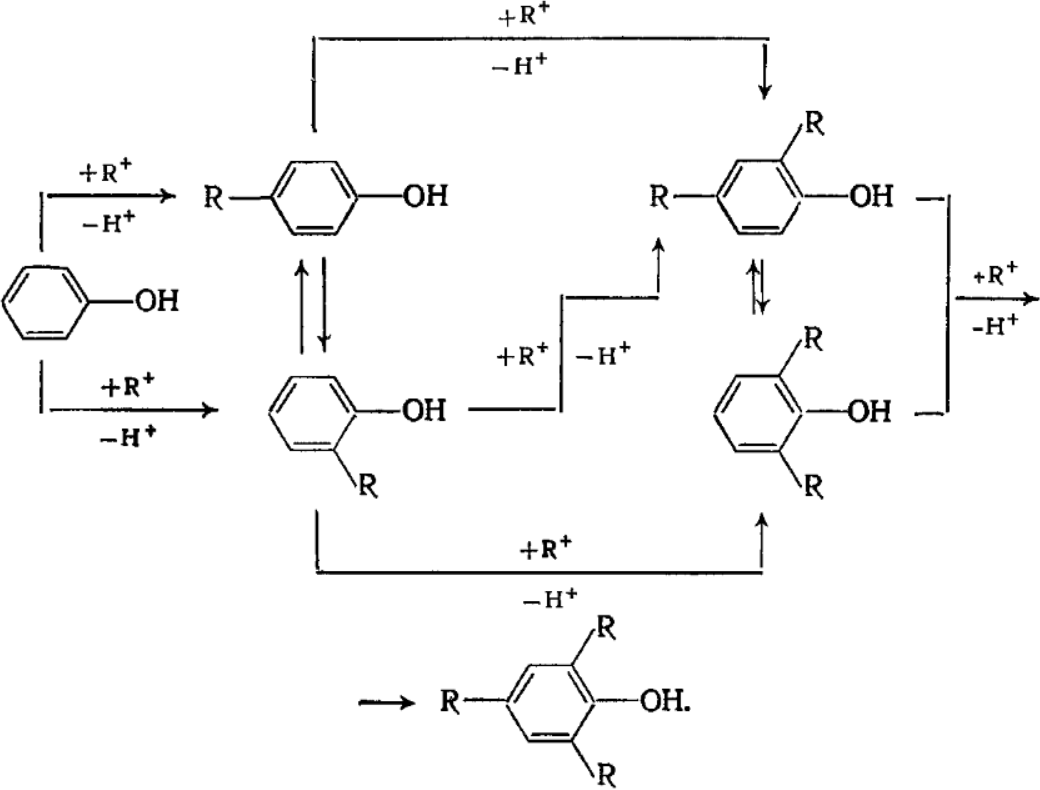
Кроме эфиров фенолов и полиалкилзамещенных фенолов побочными продуктами алкилирования являются полиолефины и образующиеся из них
алкилфенолы с более длинной цепью атомов углерода. Наоборот, при реакции с высшими, особенно с разветвленными олефинами наблюдается их деполимеризация с получением алкилфенолов, имеющих более короткую алкильную группу.
Общий метод подавления этих побочных реакций — понижение температуры, поскольку алкилирование имеет самую низкую энергию активации (≈20 кДж/моль). Во избежание полимеризации олефина необходимо также снижать его концентрацию в жидкости, что достигается постепенным введением олефина в реакционную массу. Реакции фенолов с изоолефинами в заметной степени обратимы.
В качестве катализаторов — протонных кислот — в промышленности чаще всего применяют серную кислоту. Она является наиболее активной среди других доступных и дешевых кислот, но в то же время сильнее катализирует и побочные реакции, приводя дополнительно к сульфированию фенола и сульфатированию олефина и образуя фенолсульфокислоты HOC6H4SO2OH и моноалкисульфаты ROSO2OH, которые также участвуют в катализе процесса. С серной кислотой алкилирование н-олефинами (кроме этилена) происходит при 100—120 °С, а с более реакционноспособными изоолефинами и стиролом — уже при 50 °С, однако для ускорения процесса и в последнем случае алкилирование проводят примерно при 100 °С, применяя H2SO4 в количестве 3—10%. Другим катализатором, не вызывающим побочных реакций сульфирования и более мягким по своему действию, является n-толуолсульфокислота CH3C6H4SO2OH. Однако она имеет меньшую активность и большую стоимость, чем серная кислота.
Общим их недостатком является необходимость в отмывке кислотного катализатора, вследствие чего образуется значительное количество токсичных
сточных вод. Поэтому получили практическое применение гетерогенные катализаторы, особенно катионообменные смолы. С катионообменной смолой КУ-2
алкилирование фенолов изоолефинами происходит при 120—140 °С, но медленнее, чем при катализе серной кислотой.
