
6 курс / Эндокринология / Эндокринология_и_метаболизм_Фелиг_Ф_,_Бакстер_Дж_Д_,_Бродус_А_Е
.pdf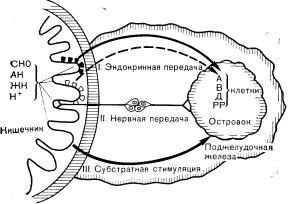
грузки увеличивалось значительно больше (2), чем при поддержании гипергликемии только за счет внутривен-
ного введения глюкозы (3) (по DeFronzo R. et al., Proc. Natl. Acad: Sci. USA, 1978, 75, 5173). на меньший или равный уровень глюкозы в плазме (рис. 10—16). Влияние желудочно-кишечного трактанасекрецию инсулина может осуществляться с помощью трех механизмов: 1) всасывания пищевых веществ и поступления их в системную циркуляцию; 2) высвобождения желудочно-кишечных гормонов; 3) нейрогенных сигналов, вызываемых приемом пищи (рис. 10—17). Точный характер желудочно-кишечного гормона (или гормонов) у повышающего глюкозозависимую секрецию инсулина, является предметом интенсивных исследований [43]. Среди пептидов, функция которых в качестве кишечных гормонов установлена, кандидатами на эту роль считают желудочный ингибиторный полипептид (ЖИП), гастрин, секретин, холецистокинин (ХЦК) и вазоактивный интестинальный полипептид (ВИН). Для того чтобы доказать роль пептида в качестве физиологического регулятора секреции инсулина, необходимо показать: 1) его прирост после-приема пищи; 2) стимуляцию им глюкозозависимой секреции инсулина в физиологических концентрациях (т. е. при уровне в плазме, сравнимом с тем, который наблюдается после приема пищи). Из различных кишечных гормонов только ЖИП полностью удовлетворяет необходимым критериям по отношению к приему глюкозы. После приема глюкозы внутрь не отмечается повышения уровня в плазме ни секретина, ни ХЦК, ни ВИП. Концентрация гастрина в плазме после приема глюкозы несколько увеличивается, од-
нако инфузия этого гормона лишь умеренно влияет на функцию -клеток в присутствии глюкозы. Гастрин может иметь большее значение для повышения реакции инсулина на белковую пищу (см. далее).
Что касается ЖИП, то уровень этого гормона в сыворотке повышается одновременно с увеличением содержания инсулина в
Рис. 10—17. Энтероинсулярная ось. Попадание пищевых веществ в кишечник влияет на секрецию гормонов островковыми клетками с помощью трех механизмов: 1) эндокринной передачи (высвобождения желудочного ингибиторного полипептида); 2) нервной передачи (возбуждение блуждающего нерва); 3) стимуляции субстратом (всасывание глюкозы, приводящее к гипергликемии).
ОНО — углеводы, АК — аминокислоты. ЖК — жирные кислоты (по Creutzfeldt W., Diabetologia, 1979, 16, 75). сыворотке или даже до этого. Внутривенная инфузия очищенного ЖИП в таких ко-
личествах, которые создают концентрацию в плазме, сравнимую с наблюдаемой после приема глюкозы внутрь (1 нг/мл), вызывает повышение глюкозозависимой секреции инсулина [44]. Кроме того, инсулинотропный эффект эндогенного ЖИП подтверждается данными о том, что прием кукурузного масла — мощного стимулятора секреции ЖИП — увеличивает реакцию инсулина на внутривенно введенную глюкозу. Возможно, однако, что инсулинотропным действием обладает не ЖИП, а другие факторы. Повышенная реакция инсулина на прием глюкозы внутрь сохраняется у больных, перенесших резекцию привратника желудка, двенадцатиперстной кишки, проксимальных отделов тощей кишки И. головки поджелудочной железы (операция Уиппла). Кроме того, введение активной антисыворотки к ЖИП снижает, но не снимает усиления инсулиновой реакции на глюкозу, вводимую в двенадцатиперстную кишку [43]. Эти данные свидетельствуют о возможности существования нескольких «инкретинов», продуцируемых участками кишечника, расположенными дистальнее тощей кишки.
Аминокислоты и другие субстраты
Прием белка или инфузия одной или многих аминокислот стимулирует секрецию инсулина. Как и в отношении глюкозы, стимуляция секреции инсулина аминокислота-
ми, принятыми внутрь, превышает таковую при внутривенном введении аминокислот, что указывает на повышение секреции инсулина под воздействием желудочно-кишечных гормонов [45]. Этот эффект может опосредоваться стимулируемой белком секрецией гастрина. Что касается механизма, с помощью которого аминокислоты стимулируют секрецию инсулина, то показано, что неметаболизируемые аналоги лейцина и аргинина сохраняют способность стимуляции секреции инсулина. Это свидетельствует о том, что триггером секреции инсулина может служить мембранное распознавание (взаимодействие с рецептором), а не внутриклеточный метаболизм аминокислот.
Что касается субстратов — производных жира, то у тучных людей одномоментная инъекция ацетоацетата вызывает небольшой подъем уровня инсулина в плазме, но у лиц, не страдающих ожирением, этого не наблюдается [46]. У здоровых лиц наблюдали небольшой прирост уровня инсулина после приема внутрь триглицеридов со средней длиной цепи жирных кислот. Однако все же не существует веских доказательств важной роли СЖК пли кетоновых тел в регуляции секреции инсулина у человека.
Нервная и нейрогуморальная регуляция
Катехоламины — адреналин и норадреналин — тормозят глюкозозависимую секрецию инсулина за счет действия, опосредуемого -рецепторами островковых клеток. На присутствие в этих клетках и -рецепторов указывает стимулирующее действие
изопротеренола (изадрин), которое, в свою очередь, ингибируется - адреноблокатором пропранололом (анаприлин). Несмотря на двойную систему рецепто-
ров в -клетках, преобладает -адренергический эффект адреналина, и «чистым» результатом его действия является торможение глюкозозависимой секреции инсулина, особенно в отношении остро высвобождаемого пула. Адренергические рецепторы островковых клеток опосредуют влияния на секрецию инсулина, по-видимому, путем изменения внутриклеточного уровня цАМФ [47].
Регуляторная роль автономной нервной системы и циркулирующих катехоламинов в контроле за секрецией инсулина проявляется физиологической гипоинсулинемией, сопровождающей физическую нагрузку, а также в патологических условиях, например при стрессорной гипергликемии. При умеренной или тяжелой физической нагрузке снижение уровня инсулина в плазме коррелирует с повышением содержания в ней катехоламинов. При стрессорной гипергликемии (например, при тяжелых ожогах тела или сложных переломах) отсутствие повышения исходного уровня инсулина на фоне увеличения содержания глюкозы в крови является, по всей вероятности, следствием действия катехоламинов. Катехоламины принимают участие также в снижении инсулиновой реакции, наблюдаемой у больных с феохромоцитомой. С другой стороны, весьма умеренный прирост уровня адреналина в плазме (в 2—3 раза, что наблюдают, например, при легкопротекающих вирусных заболеваниях) приводит к нарушению толерантности к глюкозе за счет препятствия эффекту инсулина, а не угнетения его секреции [48] (см. далее).
В отличие от действия адреналина стимуляция парасимпатической нервной системы (например, блуждающего нерва) приводит к увеличению секреции инсулина. Однако введение атропина слабо влияет на секрецию инсулина у человека.
Об участии ЦНС в регуляции секреции инсулина свидетельствуют реакции на стимуляцию или разрушение гипоталамических ядер. Стимуляция вентромедиальных ядер подавляет секрецию инсулина. Этот эффект не проявляется в условиях адреналэктомии, что свидетельствует о его/опосредовании катехоламинами мозгового слоя надпочечников. В отличие от этого разрушение вентромедиальных ядер приводит к гиперинсулинемии и гиперфагии [49].
К другим нейрогуморальным агентам, обнаруженным в островковой ткани и влияющим на секрецию инсулина, относятся серотонин и дофамин [50]. Реакция на серотонин видоспецифична: стимуляция или отсутствие влияния на секрецию инсулина у собаки и человека и угнетение ее у золотистого хомячка и кролика. В отношении дофамина показано, что он снижает высвобождение инсулина in vitro.
У собаки и человека наблюдали ингибиторное действие простагландина А на секрецию инсулина. В недавно опубликованной работе сообщается, что снижение секреции инсулина при инсулинонезависимом диабете может отчасти быть опосредовано синтезом простагландинов f[51].

Соматостатин
Соматостатин представляет собой тетрадекапептид, выделенный впервые из гипоталамуса в качестве фактора, ингибирующего высвобождение гормона роста, а впоследствии идентифицированный с помощью иммунофлуоресцентных методов в островковых клетках поджелудочной железы, а также в желудочно-кишечном тракте: клетках привратника желудка и тощей кишки [52]. Помимо своего тормозящего влияния на высвобождение гормона роста, соматостатин является мощным ингибитором секреции как инсулина, так и глюкагона. Этот эффект соматостатина на островковые гормоны служит проявлением его прямого действия, что показано в опытах in vitro. В островках Лангерганса соматостатин локализуется в D-клетках (A1-клетках), расположенных по периферии островков. У крыс со стрептозотоциновым диабетом, а также при некоторых формах генетического диабета у экспериментальных животных наблюдали увеличение содержащих соматостатин клеток.
Что касается механизма, с помощью которого соматостатин влияет на секрецию инсулина, то противоречивость имеющихся данных пока не позволяет решить, снижает
ли соматостатин концентрацию цАМФ в -клетках, изменяет ли он приток кальция или увеличивает -адренергическую активность [52].
Соматостатин не только изменяет секрецию островковых клеток, но и угнетает высвобождение различных гормонов желудочно-кишечного тракта, в том числе гастрина, панкреозимина и секретина [52]. Отмечалось также торможение всасывания глюкозы и белка, снижение кровотока в органах брюшной полости [53] и угнетение перистальтики кишечника. Кроме того, у больных с островковоклеточными опухолями, состоящими из содержащих соматостатин клеток (соматостатинома), ведущим симптомом является стеаторея [54].
Рис. 10—18. Мультисистемные ингибиторные эффекты соматостатина, угнетающего не только секрецию гормона роста, инсулина и глюкагона, но и различные функции желудочно-кишечного тракта, в том числе секрецию желудочно-кишечных гормонов, кровоток в брюшной полости, перистальтику и всасывание глюкозы и аминокислот.
Главный нерешенный вопрос касается физиологической роли соматостатина в регуляции секреции инсулина и глюкагона, а также всасывания пищевых веществ. Результаты проведенных до сих пор исследований трудно интерпретировать из-за отсутствия специфического радиоиммунологического метода определения соматостатина. Тем не менее сообщалось о повышении уровня соматостатина после приема глюкозы и жира, что рассматривалось как механизм модуляции всасывания пищевых веществ [55]. Предполагается также, что соматостатин является регулятором секреции инсу-
лина и глюкагона при выделении в интерстициальное пространство - и -клеток. Этот феномен был назван паракринным эффектом [52]. Несомненно, что многочисленные ингибиторные эффекты соматостатина на эндокринную секрецию и функцию желу- дочно-кишечного тракта (секреция, всасывание и перистальтика), по крайней мере частично, имеют фармакологический характер (рис. 10—18).
Другие гормоны

У карликов с дефицитом гормона роста наблюдается снижение исходной, глюкозо- и аргининзависимой секреции инсулина. Напротив, при акромегалии характерным признаком считают гиперинсулинемию. На перфузируемой поджелудочной железе был
продемонстрирован стимулирующий эффект глюкагона на секрецию -клеток. Однако небольшой прирост уровня инсулина в плазме, наблюдаемый при инфузии физиологических доз глюкагон» in vivo, является, вероятно, результатом сопутствующего повышения содержания глюкозы в плазме.
Гиперинсулинемию наблюдали при экзогенном введении или эндогенном повышении уровня адренокортикостероидов, эстрогенов, прогестинов и паратиреоидного гормона. Поскольку во всех этих случаях уровень глюкозы не снижался, можно полагать, что соответствующие гормональные нарушения сопровождаются резистентностью к инсулиновым эффектам. Не ясно поэтому, оказывают эти гормоны непосредственное влияние на секрецию инсулина или некий сигнал от инсулинорезистентных тканей по
механизму обратной связи оказывается инсулинотропным стимулом для -клеток. В отношении кортикостероидов, например, не удается показать прямого эффекта на ткань поджелудочной железы.
Ожирение
Ожирение — наиболее частое гиперинсулинемическое состояние у человека.. Повышенный уровень инсулина наблюдается как натощак, так и после приема пищи. О том, что гиперинсулинемия является следствием, а не причиной ожирения, свидетельствует тот факт, что уменьшение массы тела приводит к снижению уровня инсулина, тогда как увеличение ее сопровождается повышением уровня инсулина в плазме. К факторам, определяющим величину гиперинсулинемии при ожирении, относятся: 1) степень. ожирения; 2) калорическая ценность потребляемых пищевых продуктов и содержание углеводов в них; 3) степень физической активности. Между уровнем инсулина в плазме и массой тела наблюдается прямая корреляция, если только увеличение массы тела обусловлено ожирением, а не ростом мышечной ткани (например, у спортсменов-тяжеловесов). С другой стороны, уменьшение содержания углеводов в потребляемой пище или общее ограничение ее калоража приводит к нормализации уровня инсулина задолго до достижения идеальной массы тела (табл. 10—3). Кроме того, физические упражнения могут способствовать снижению. инсулина независимо от уменьшения массы тела [56].
Таблица 10—3. Исходный уровень инсулина в плазме у тучных лиц до уменьшения массы тела и после
|
Обследованные |
|
|
|
|
|
|
|
Г. А. |
М. М. |
Ф. С. |
Дата |
10/70 1/71 |
9/70 12/70 |
10/71 1/72 |
|
|
|
12/72- |
|
|
|
|
Масса тела, кг |
119,5 92,3 |
177,3 129,5 |
104,5 91,4 101,8 |
инсулин плазмы, |
70 20 |
58 22 |
56 19 37 |
мкЕД/мл |
|
|
|
Природа сигнала, определяющего гиперинсулинемию натощак и после еды при ожирении, точно не установлена. В качестве возможного механизма предполагали гипераминоацидемию [57]. Поскольку ожирение не сопровождается гипогликемией и, более того, связано с предрасположенностью к развитию диабета, оно, очевидно, представляет собой состояние инсулинорезистентности.
ДЕЙСТВИЕ ИНСУЛИНА
Инсулин представляет собой основной фактор, контролирующий накопление и метаболизм поступающих в организм энергетических субстратов. Секреция инсулина после еды облегчает поглощение, утилизацию и накопление глюкозы, жира и аминокислот. Напротив, снижение циркулирующего инсулина приводит к мобилизации эндогенных энергетических субстратов и снижает всасывание поступающих пищевых веществ. Действие инсулина затрагивает все главные энергетические субстраты — углеводы, белки и жиры и реализуется в основном в печени, мышцах и жировой ткани.

В каждой из них инсулин оказывает как антикатаболическое, так и анаболическое действие, усиливающее друг друга (табл. 10—4).
Таблица 10—4. Действие инсулина
Обмен углеводов
С количественной точки зрения, наиболее важным объектом действия инсулина в ликвидации гипергликемии, создаваемой перо-тральной нагрузкой глюкозой, является печень [58]. Поскольку глюкоза всасывается в воротной системе, постольку периферические ткани смогут поглотить только то ее количество, которое попадает из сосудов брюшной полости в системную циркуляцию. В течение 3 ч после приема 100 г глюкозы примерно 60 г ее поглощается печенью и используется на синтез гликогена и образование триглицеридов. Общее количество глюкозы, не захваченной за это время печенью (40 г), превышает исходную скорость выхода глюкозы из печени только на 15 г. Таким образом, общее количество глюкозы для инсулинозависимой утилизации на периферии (т. е. вне печени) составляет лишь 15% от принятой дозы.
В условиях потребления смешанной пищи уровень глюкозы в крови у здорового человека колеблется в течение 24 ч не больше чем на 30—40 мг/100 мл (см. рис. 10—13). Столь «тонкая настройка» регуляции глюкозы в крови обусловлена крайней чувствительностью печени к небольшим изменениям секреции инсулина. При повышении уровня глюкозы в крови всего на 10— 15 мг/100 мл уровень инсулина на периферии повышается на 60—100%, что приводит к полному прекращению выхода глюкозы из печени (т. е. экономии печеночного гликогена) без стимуляции утилизации глюкозы на периферии [33]. Таким образом,, по сравнению с печенью мышцы и жировая ткань играют относительно небольшую роль в элиминации глюкозы при значительных сахарных нагрузках и гораздо менее, чем печень, чувствительны к небольшим изменениям уровня инсулина в плазме. Однако при высокой периферической гиперинсулинемии поглощение глюкозы жировой и мышечной тканью способствует минимизации колебаний уровня глюкозы в системном кровотоке.
Ввиду проницаемости гепатоцитов для глюкозы поглощение сахара печенью не лимитирует скорость процесса. Первый потенциальный пункт контроля локализуется в начале метаболизма глюкозы, при ее фосфорилировании в глюкозо-6-фосфат. Как уже отмечалось, фосфорилирование в печени происходит под влиянием двух ферментов — гексо- и глюкокиназы. Гексокиназа при нормальных физиологических концентрациях глюкозы уже в значительной степени насыщена. С другой стороны, активность глюкокиназы достигает всего половины насыщения при увеличении глюкозы в крови до 180 мг/100 мл. Поглощение глюкозы печенью может «подстраиваться» к меняющимся концентрациям сахара в крови за счет изменения глюкокиназной активности. Активность этого фермента зависит от присутствия инсулина и относительна высокоуглеводной диеты.
Второй важнейший этап гликолиза — это фосфорилирование фруктозо-6-фосфата фосфофруктокиназой. В отсутствие инсулина активность этого фермента снижается, что имеет значение не только для гликолиза, но и для глюконеогенеза. Снижение фосфофруктокиназной активности способствует направлению гликолитической последовательности реакций в обратном направлении с образованием фруктозо-1-фосфата и в конце концов глюкозы (см рис. 10—4).
Содержание гликогена в печени больных с диабетическим ацидозом значительно снижено и быстро восстанавливается пocле введения инсулина. Этот эффект инсулина
обусловлен его способностью активировать гликогенсинтетазу уже через несколько минут после введения. Накоплению гликогена способствует также торможение инсулином фосфорилазы — фермента, катализирующего ограничивающий скорость этап разрушения гликогена (см. рис. 10—3).
Инсулин тормозит выход глюкозы из печени не только за счет своего влияния на синтез и распад гликогена, но и за счет ингибиторного действия на глюконеогенез. Ключевой промежуточный этап глюконеогенеза — превращение пирувата в фосфоенолпируват — зависит от пируваткарбоксилазы и фосфоенолпируваткарбоксикиназы (см. рис. 10—4). Последний фермент в? присутствии глюкозы и инсулина ингибируется. Активность пируваткарбоксилазы под действием инсулина также снижается, вероятно, вследствие торможения высвобождения и распада жирных кислот (см. далее), что ограничивает количество ацетил-СоА. аллостерического активатора пируваткарбоксилазы.
Уже давно предполагали, что влияние инсулина на глюконеогенез не ограничивается регуляцией содержания жирных кислот, а включает также снижение поступления аминокислотных предшественников. Более поздние исследования, однако, не сумели подтвердить эту гипотезу. Так, экзогенный инсулин не угнетает высвобождения аланина — главного аминокислотного предшественника глюконеогенеза из периферической мышечной ткани. Подобно этому при стимуляции секреции эндогенного инсулина уровень аланина в плазме также не обнаруживает закономерного снижения. Однако стимулируемая глюкозой секреция инсулина обусловливает снижение поглощения аланина печенью, несмотря на нормальный уровень этой аминокислоты в артериальной крови. Таким образом, большинство данных позволяет заключить, что инсулин регулирует глюконеогенез путем влияния прежде всего на внутрипеченочные процессы, а не на снабжение предшественниками [58]. Для торможения глюконеогенеза нужны большие количества инсулина, чем для торможения гликогенолиза. Так, увеличение концентрации инсулина в сыворотке на 60—100% полностью подавляет гликогенолиз, тогда как поглощение аланина, лактата и пирувата печенью и их превращение в глюкозу при таких небольших приростах уровня инсулина продолжается [33, 59].
Главный вопрос, касающийся общего контроля за метаболизмом глюкозы в печени, заключается в оценке относительного значения гиперинсулинемии и гипергликемии в качестве регуляторных сигналов. Более 30 лет назад Soskin и Levine постулировали, что основным стимулом, определяющим поглощение или высвобождение глюкозы печенью, является концентрация глюкозы в крови. Позднее были получены данные в пользу этой гипотезы, свидетельствующие о том, что, во-первых, гликогенсинтетаза и фосфорилаза крайне чувствительны к концентрации глюкозы [4]; вовторых, гипергликемия, даже в отсутствие изменений концентрации инсулина, тормозит выход глюкозы из перфузируемой печени [60], а также из печени человека in vivo [7]; в-третьих, в отсутствие гипергликемии гиперинсулинемия не вызывает поглощения глюкозы печенью [5]. Другие данные подчеркивают значение именно инсулина в регуляции высвобождения глюкозы печени: 1) у больных с инсулинозависимым диабетом гипергликемия, вызываемая инфузией сахара, не угнетает выход глюкозы из печени [61]; 2) в перфузируемой печени инсулин активирует гликогенсинтетазу даже в отсутствие глюкозы в перфузате [62]; 3) для эффективного подавления продукции глюкозы в печени в условиях повышения уровня инсулина требуются гораздо меньший прирост концентрации глюкозы в крови (на 10— 15 мг/100 мл), чем в условиях поддержания концентрации инсулина на постоянном уровне (60 мг/100 мл). Позднее было показано, что даже на фоне гипергликемии и гиперинсулинемии поглощение глюкозы печенью относительно невелико (менее 15% от общей утилизации сахара в организме), если только глюкоза не принята внутрь [5]. Эти наблюдения поднимают вопрос о возможности опосредования действия инсулина на печень гормонами желудочнокишечного тракта.
Таким образом, все эти данные свидетельствуют о том, что в регуляции баланса глюкозы в печени принимают участие гиперинсулинемия, гипергликемия и, возможно, сигналы из желудочно-кишечного тракта. Повышение уровня инсулина отчетливо увеличивает чувствительность печени к тормозящему влиянию глюкозы на ее печеночную продукцию. Подобно этому повышение концентрации глюкозы облегчает стимуляцию инсулином поглощения глюкозы печенью и, вероятно, играет существенную роль в этом эффекте. Преобладание поглощения глюкозы печенью становится еще более выраженным при приеме сахара внутрь, а не при внутривенном его введении [5].
В отличие от ситуации с гепатоцитами скорость поглощения глюкозы мышечными клетками при ее физиологических концентрациях в плазме наиболее медленная. Ос-
новной эффект инсулина на эту ткань заключается в регуляции транспорта глюкозы через клеточную мембрану. Кроме того, инсулин повышает активность фосфофруктокиназы, вероятно, вследствие своей способности увеличивать образование АДФ и АМФ, стимулирующих этот фермент, и снижать уровень АТФ, угнетающего его. Главным конечным продуктом глюкозы, поглощаемой неработающей мышцей, является гликоген. Следует подчеркнуть, что поглощение глюкозы работающей мышцей не зависит от увеличения секреции инсулина (см. далее).
Действие инсулина в жировой клетке также сводится прежде всего к стимуляции транспорта глюкозы через клеточную мембрану. Наблюдаются и эффекты в отношении гликогенсинтетазы и фосфофруктокиназы. Главными конечными продуктами метабо-
лизма глюкозы в жировой клетке являются жирные кислоты и -глицерофосфат. Последний играет важную роль в накоплении жира, так как обеспечивает присутствие молекулы глицерина, необходимой для синтеза триглицеридов. Как будет отмечено, у человека синтез жирных кислот из глюкозы происходит в основном не в жировой - ткани, а в печени (см. рис. 10—6).
Обмен аминокислот и белков
Инсулин увеличивает поглощение большинства аминокислот мышцей. Этот эффект отражает сочетанное стимулирующее действие на транспортные механизмы и синтез белка и тормозящее действие на катаболизм белка в мышце [63]. Инфузия физиологических количеств инсулина в плечевую артерию человека приводит к уменьшению выхода аминокислот из глубоких тканей предплечья. Этот эффект особенно выражен в отношении аминокислот с разветвленной цепью: лейцина и изолейцина, а также тирозина в фенилаланина. Влияние инсулина на обмен аминокислот в мышце, вероятно, лежит в основе его способности снижать уровень аминокислот в системной циркуляции. В отсутствие нужных количеств инсулина, например у больных диабетом с кетоацидозом наблюдают повышенное содержание в плазме валина, лейцина и изолейцина. Кроме того, в отсутствие адекватных количеств-инсулина снижается поглощение этих аминокислот мышцами после приема белковой пищи [24, 63]. Таким образом, стимулирующий эффект принятого с пищей белка на секрецию инсулина способствует поглощению и анаболической утилизации составляющих этот белок аминокислот.
Помимо влияния на синтез белка общий анаболический эффект инсулина определяется его способностью тормозить катаболизм белка. Инсулин угнетает также окисление аминокислот с разветвленной цепью в мышечной ткани, которое ускоряется при диабете. Таким образом, инсулин увеличивает белковые запасы организма, по меньшей мере, с помощью следующих механизмов 1) увеличивая поглощение аминокислот тканями; 2) стимулируя; синтез белка; 3) тормозя распад белка; 4) снижая окисление-аминокислот.
Обмен жиров
Повышение уровня инсулина в плазме стимулирует синтез жирных кислот в печени. Это действие складывается из нескольких эффектов инсулина: I) увеличение потока субстратов по пути гликолиза в цикл ТКК повышает уровень цитрата и изоцитрата, стимулирующих липосинтетические пути, особенно активность ацетил-СоА- карбоксилазы; 2) уменьшение доставки СЖК снимает тормозное действие их на этот фермент; 3) поскольку инсулин стимулирует утилизацию глюкозы по пентозному пути. увеличивается количество восстановленного НАДФ, который служит необходимым донором водорода для многих стадий синтеза жирных кислот; 4) инсулин может оказывать непосредственное стимулирующее действие на ацетил-СоА-карбоксилазу. Общая способность инсулина стимулировать синтез жирных кислот подчеркивается тем обстоятельством, что у человека липогенез происходит главным образом в печени, а не в жировой ткани. Жирные кислоты, синтезированные в печени, транспортируются затем (в составе
ЛПОНП) в жировую ткань, где они накапливаются в виде триглицеридов (см.
рис. 10—6).
Инсулин ускоряет поглощение жировой тканью циркулирующих в крови триглицеридов, образующихся из экзогенных или эндогенных источников, стимулируя липопротеиновую липазу. Кроме того, инсулин является мощным ингибитором гормончувствительной липазы в жировых клетках, которая катализирует гидролиз накопленных
триглицеридов и высвобождение жирных кислот. Это антилиполитическое действие инсулин оказывает в концентрациях, которые ниже необходимых для влияния на транспорт глюкозы. Кроме того, большая часть глюкозы, поглощаемой жировыми клетками
под влиянием инсулина, используется на образование -глицерофосфата, необходимого для эстерификации жирных кислот с синтезом триглицеридов. На синтез жирных кислот in situ расходуется меньшая часть глюкозы, поглощаемой жировой тканью под влиянием инсулина. «Чистым» результатом антилиполитического, стимулирующего синтез жира и глицерогенного эффектов инсулина является увеличение общего запаса жира в организме.
Помимо своего действия на метаболизм жирных кислот, инсулин оказывает выраженное действие на снижение уровня кетоновых тел в крови. Образование и накопление кетокислот (бета-оксибутирата и ацетоацетата) является следствием трех разных метаболических процессов: 1) доставки жирных кислот из жировой ткани; 2) окисления в печени СЖК до ацетил-СоА, превращающегося в кетоновые тела (кетогенная способность); 3) снижения утилизации кетоновых тел периферическими тканями. Как уже отмечалось, инсулин — мощный антилиполитический гормон. Кроме того, он снижает способность печени окислять жирные кислоты независимо от их количества. Это антикетогенное действие инсулина тесно связано, во-первых, с его регулирующим влиянием на уровень карнитина в печени и, во-вторых, его стимулирующим влиянием на синтез жирных кислот [15]. Окисление жирных кислот в печени усиливается при повышении уровня карнитина, необходимого для переноса жирных кислот через митохондриальную мембрану (с помощью ацилкарнитинтрансферазы) к месту лока-
лизации ферментов -окисления (см. рис. 10—8).
Однако карнитинтрансфераза угнетается малонил-СоА — первым промежуточным продуктом в процессе синтеза жирных кислот из ацетил-СоА. Эффект инсулина заключается в снижении уровня в печени карнитина с одновременным увеличением (в силу стимуляции синтеза жира) уровня малонил-СоА. Конечным результатом служит уменьшение кетогенной способности печени.
Эти эффекты инсулина на мобилизацию и окисление жира сопровождаются его влиянием на утилизацию кетоновых тел. В присутствии инсулина поглощение и окисление кетокислот мышечной тканью ускоряется [64].
Разнообразные влияния инсулина на метаболизм энергетических веществ в организме усиливают друг друга (см. табл. 10—4). Так, торможение глюконеогенеза сберегает аминокислоты для синтеза белка. Подобно этому угнетение липолиза снижает уровень ацетил-СоА, необходимого для стимуляции ферментов глюконеогенеза. Повышение синтеза жира увеличивает содержание малонил-СоА, который препятствует окислению жирных кислот. Окисление жирных кислот тормозится, кроме того, и антилиполитическим действием инсулина.
Обмен калия и натрия
Введение инсулина извне или стимуляция секреции эндогенного Инсулина приводит к снижению уровня калия в сыворотке. Этот гипокалиемический эффект инсулина является следствием стимуляции поглощения калия мышечной и печеночной тканью, что может происходить независимо от изменений метаболизма глюкозы. Регуляторная роль инсулина в обмене калия наглядно проявляется изменениями концентрации калия в сыворотке, сопровождающими снижение исходного уровня инсулина. При 50% снижении уровня инсулина натощак, вызываемом введением соматостатина, концентрация калия в сыворотке увеличивается на 0,5—1,0 мэкв/л [65]. Гиперкалиемический эффект инсулинопении не является следствием изменения обмена калия в почках. Чувствительность гомеостаза калия в организме к небольшим колебаниям секреции инсулина может отчасти объяснять наклонность у больных диабетом к развитию гиперкалиемии в отсутствие уремии или ацидоза [66].
Инсулин влияет и на обмен натрия, хотя этот эффект (в отличие от влияния на калиевый гомеостаз) является следствием изменения секреции катиона в почках. На фоне физиологического повышения уровня инсулина в плазме экскреция натрия с мочой уменьшается в отсутствие изменений скорости клубочковой фильтрации и экскреции альдостерона. Наоборот, угнетение исходной секреции инсулина соматостатином сопровождается 50% увеличением экскреции натрия с мочой [65]. Антинатрийуретический эффект инсулина может лежать в основе отеков, которые иногда появляются у больных диабетом с гипергликемией, при нормализации уровня глюкозы в крови с
помощью инсулинотерапии. Подобно этому отеки, наблюдаемые при восстановлении питания у голодающих или недоедающих лиц, а также диурез, сопровождающий голодание, отчасти могут быть опосредованы изменением секреции инсулина.
Рецепторы инсулина и механизм его действия
Первым этапом действия инсулина, как и других полипептидных гормонов, является его связывание со специфическими репепторами на плазматической мембране
клетки (рис. 10—19). Инсу 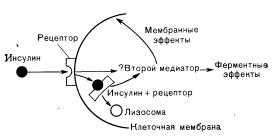
Рис. 10—19. Взаимодействие инсулина с рецептором. Первым этапом действия инсулина на клетку является его связывание рецептором на клеточной мембране. Это взаимодействие «запускает» один или более пока не идентифицированных внутриклеточных процессов (вторые медиаторы?), обусловливающих мембранные (увеличение транспорта глюкозы в адипоциты и мышечные клетки) и ферментные (повышение активности гликогенсинтетазы в печени) эффекты. Инсулинрецепторный комплекс проникает в клетку. где подвергается лизосомному разрушению. Необходимо ли проникновение инсулинрецепторного комплекса в клетку для «запуска» внутриклеточных эффектов инсулина (мембранных и ферментных) неизвестно.
линовый рецептор можно определить как компонент клеточной мембраны, который избирательно распознает и связывает инсулин и обладает характеристиками связывания (кинетика, оптимум рН, специфичность по отношению к аналогам), удовлетворяющими требованиям к возможности генерировать сигнал, обусловливающий биологическую реакцию [67]. Хотя химическая структура инсулинового рецептора точно не известна, считают, что он представляет собой гликопротеин с молекулярной массой от 75 000 до 300 000. Физиологической сущностью инсулинового рецептора является специфичность, с которой он связывает гормон, и тесная зависимость действия гормона от этого связывания. При изучении 40 аналогов инсулина была показана прямая зависимость между сродством аналога к инсулиновым рецепторам и его биологической активностью (рис. 10—20). Хотя показано, что число инсулиновых рецепторов на клетку колеблется от 50 000 (в адипоцитах) до 250000 (в гепатоцитах), максимальные биологические эффекты наблюдаются при занятости небольшого количества их (менее 10%). Функциональный смысл существования такого «запаса рецепторов» заключается в том, что в условиях снижения числа рецепторов (например, при ожирении) при адекватном увеличении концентрации инсулина число гормонрецепторных комплексов может достигать критического уровня, .необходимого для «запуска» биологической реакции (т. е. кривая доза — реакция для инсулина окажется сдвинутой вправо).

Рис. 10—20. Влияние инсулина и его аналогов на связывание 125I-инсулина с мембранами печеночных клеток (а); и окисление глюкозы жировыми клетками (б). Можно видеть близкую корреляцию между сродством к рецепторам (а) и биологическим эффектом (б) (по Freychet P.. et al. Ргос. Natl. Acad. Sci. USA, 1971, 68, 1833). а: 1 — инсулины свиньи, быка и-человека; 2 — рыбий инсулин: 3— проинсулин: 4 — дезоктапептид; 5
— дезала. дезаен; 6 — инсулин морской свинки,.
Взаимодействие между инсулином и его рецептором — это не простая обратимая реакция между двумя молекулами с одной константой сродства или равновесия, а процесс, имеющий более сложную природу и характеризующийся гетерогенностью сродства связывания. Указанная сложность проявляется криволинейной зависимостью, получаемой при скетчардовском анализе данных по связыванию инсулина [68]. Эти данные рассматриваются как указание на отрицательную кооперативность — феномен, при котором увеличение занятости рецепторов приводит к снижению сродства вследствие взаимодействий связывающих мест между собой [67, 68]. Можно, однако, дать и другое или дополнительное объяснение, особенно применительно к адипоцитам, которое сводится к признанию существования двух разных классов рецепторов: с высоким сродством и низкой емкостью и с низким срод-
