6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf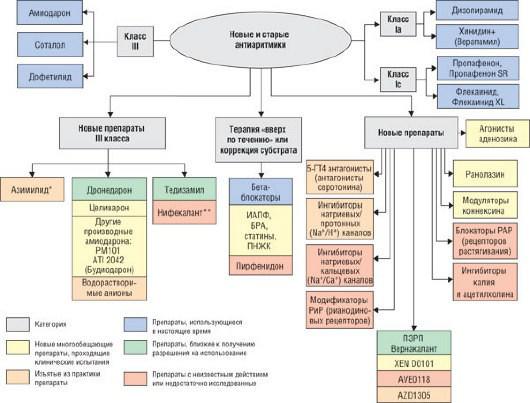
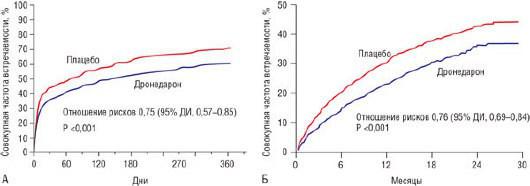
антиаритмические препараты сейчас находятся на стадии клинических испытаний (рис. 29.28) [107].
Рис. 29.28. Антиаритмические препараты при ФП. * АзимилидΡ не используется для лечения ФП, его использование у пациентов с ИКД еще изучается. ** НифекалантΡ используется в Японии главным образом для прерывания желудочковой тахикардии. ПЗРП - препараты замедляющие реполяризацию предсердий; ГТ - гидрокситриптаминΡ; ПНЖК - полиненасыщенные жирные кислоты; РиР - рецепторы рианодина; РАР - рецепторы активирующиеся при изменении объема. Источник (с разрешения): Savelieva I., Camm J. Antiarrhythmic drug therapy for atrial fibrillation: current anti-arrhythmic drugs, investigational agents, and innovative approaches // Europace. - 2008. - Vol. 10. - P. 647-665.
ВЫБОР АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА
Выбор антиаритмического препарата для кардиоверсии, а также для длительного лечения ФП зависит от фонового заболевания сердца (рис. 29.29) [1]. Антиаритмические препараты Iс класса (пропафенон и флекаинид) и III класса (соталол и ибутилид) рекомендованы для кардиоверсии ФП у пациентов с умеренными органическими заболеваниями сердца или артериальной гипертензией без гипертрофии миокарда ЛЖ. Эти препараты не рекомендованы пациентам с анамнезом СН, ИМ с дисфункцией ЛЖ и выраженной гипертрофией ЛЖ. Амиодарон и дофетилидΡ (дофетилидΡ недоступен за пределами США) могут использоваться у пациентов с симптомами СН и известным заболеванием сердца. Хотя для приема внутрь хинидин и для приема внутрь или иньекционный прокаинамид (Iа класс) все еще доступны, во всем мире их применение значительно снижается. Хинидин в виде фиксированной комбинации с верапамилом имеет ограниченное использование.
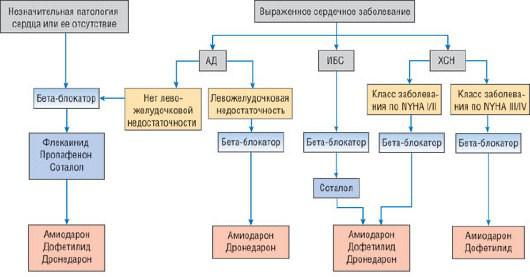
Рис. 29.29. Выбор антиаритмического препарата для предупреждения приступов ФП в зависимости от имеющейся сердечно патологии.
КОГДА НАЗНАЧАТЬ АНТИАРИТМИЧЕСКУЮ ТЕРАПИЮ
Чтобы ответить на вопрос, где начинать терапию антиаритмическими препаратами, необходимо взвесить риск и пользу лечения. У пациентов с ожидаемым риском побочных эффектов (например, пациент с врожденным удлинением интервала Q-T или пациент с синдромом тахикардиибрадикардии) не следует начинать антиаритмическую терапию вне стационара. Для некоторых антиаритмических препаратов, например дофетилидаΡ, существует формальное требование о начале терапии в стационаре.
Если не учитывать проаритмогенный эффект и формальные предписания, амбулаторное начало терапии более удобно и экономически выгодно. Например, это касается перорального пропафенона и флекаинида (обычно в комбинации с препаратами, замедляющими АВ-проведение для предотвращения частых сокращений желудочков при возникновении ТП) у пациентов с изолированной ФП или ФП, ассоциированной с гипертензией без значимой гипертрофии ЛЖ. Терапия амиодароном может быть безопасно начата амбулаторно, с учетом длительного периода полувыведения и низкой вероятностью возникновения двунаправленной ЖТ. Для контроля частоты ритма, интервалов P-R и Q-T (соталол, амиодарон, дофетилидΡ), длительности комплекса QRS (флекаинид, пропафенон) и оценки эффективности лечения должен быть организован амбулаторный контроль ЭКГ и/или транстелефонный контроль ЭКГ. В том случае, если терапия соталолом начата вне стационара, начальная доза должна быть небольшой, а при дальшейшей титрации следует ориентироваться на частоту ритма и интервал Q-T.
ФАРМАКОЛОГИЧЕСКАЯ КАРДИОВЕРСИЯ
Кардиоверсия с использованием антиаритмических препаратов обычно эффективна при условии раннего начала, то есть в пределах недели, а возможно даже 3 дней, от возникновения ФП. В пределах 24-72 ч около 45% пациентов с ФП могут самостоятельно восстанавливать ритм [245] при помощи антиаритмических средств в 70% [245-247].
Систематический анализ плацебо-контролируемых исследований по фармакологической кардиоверсии ФП показал, что среди пациентов с ФП длительностью ‹24 ч в 66% случаях ритм восстанавливается спонтанно, по сранению с 17% у пациентов с ФП большей длительности (отношение шансов 1,8) [246].
ПОДХОД К ЛЕЧЕНИЮ "ТАБЛЕТКА В КАРМАНЕ"
У пациентов без органических заболеваний сердца или с незначительной патологией и относительно нечастыми (реже чем 1 раз в месяц) сиптоматичными пароксизмами ФП с явным началом, которые не вызывают серьезных гемодинамических нарушений (например, гипотензии), однократная нагрузочная доза пропафенона или флекаинида может быть использована для кардиоверсии [248]. В доказательство концепции пациенты с пароксизмальной ФП, которые получали успешную терапию в стационаре пероральными препаратами пропафенона или флекаинида, были инструктированы на прием однократной дозы соответствующего препарата в
пределах 5 мин от начала сердцебиения. Такая стратегия "таблетка в кармане" привела к снижению количества посещений пациентами врача и количества госпитализаций, несмотря на сохранение частоты эпизодов аритмии [249].
Опыт применения данного подхода ограничен, и ни один препарат не лицензирован для самолечения приступов аритмии. Поскольку существует опасность развития ТП с АВ-проведением 1:1, расширения комплекса QRS и иногда дисфункции ЛЖ, необходимо сначала тестировать эффективность и безопасность препаратов в стационаре. Более того, рекомендуется комбинировать эти препараты с препаратами, замедляющими АВ-проведение, например β- адреноблокаторами, верапамилом или дилтиаземом. Возникновение ТП было отмечено в 5-6% случаев при приеме нагрузочной дозы перорального пропафенона или флекаинида с целью купирования ФП [250].
ПРЕПАРАТЫ ДЛЯ КАРДИОВЕРСИИ
В/в препараты пропафенона и флекаинида обладают высокой купирующей способностью при длительности ФП ‹72 ч. Частота восстановления ритма 80-90% в пределах часа после начала инфузии [251-253]. При пероральном приеме в качестве нагрузочной дозы (450-600 мг для пропафенона, 200-300 мг для флекаинида) восстановление синусового ритма происходит позже, но частота восстановления ритма (70-80% в течение 8 ч) сопоставима с таковой при в/в введении [250, 254-259]. Препараты менее эффективны для купирования ФП, продолжающейся >7 дней.
Препараты Iс класса неэффективны для купирования ТП. Они замедляют проведение в цикле reentry и увеличивают длительность цикла ТП, но редко купируют его. Купирующая способность этих препаратов находится на уровне 13-40% [260].
Ибутилид обладает умеренной эффективностью для кардиоверсии ФП и более эффективен для купирования ТП (31-44% против 56-70%) [261, 262]. Препарат доступен только для в/в применения и обычно вводится 1 мг болюсом в течение 10 мин. Для кардиоверсии могут потребоваться более высокие дозы ибутилида: однократный болюс 2 мг или два последовательных введения 1 мг [261, 263, 264]. Антиаритмический эффект ибутилида снижается, если аритмия персистирует более 7 дней.
Ибутилид удлиняет интервал Q-T и может индуцировать желудочковые нарушения ритма. В исследованиях по изучению ибутилида частота возникновения полиморфной или двунаправленной ЖТ, требующей электрической кардиоверсии, составила 0,5-1,7%, а частота возникновения ЖТ со спонтанным купированием - 2,6-6,7% [262, 265]. Недостаточно данных для рекомендации к применению у пациентов с выраженным органическим заболеванием сердца, так как многие контролируемые исследования ибутилида включали только пациентов с легкими или умеренными фоновыми заболеваниями.
Пероральная форма дофетилидаΡ интенсивно исследовалась и была расценена как безопасная и относительно эффективная для фармакологической кардиоверсии ФП, включая длительные формы аритмии >7 дней. Два проспективных исследования среднего размера, SAFIRE-D
(Symptomatic Atrial Fibrillation Investigative Research on Dofetilide / Исследование дофетилида при симптомной фибрилляции предсердий) и EMERALD (European and Australian Multicenter Evaluative Research on Dofetilide / Европейское и австралийское многоцентровое исследование оценки дофетилида) показали умеренную эффективность при кардиоверсии (30%) персистирующей ФП с использованием высоких доз (1000 мкг дважды в день) перорального дофетилидаΡ. Спонтанное купирование аритмии наблюдалось в 1,2% случаев на фоне плацебо [266] и в 5% случаев при терапии соталолом [267].
Объединенный анализ результатов исследований DIAMOND (Danish Investigations of Arrhythmia and Mortality ON Dofetilide, Датское исследования аритмии и смертности на дофетилиде) у пациентов с симптомной ХСН (DIAMOND-CHF) или ИМ со снижением функции ЛЖ (DIAMOND-MI) показал, что пероральная форма дофетилидаΡ не влияла на смертность. Была продемонстрирована большая частота купирования аритмии (44% против 14%) [236].
ДофетилидΡ вызывает удлинение интервала Q-T и некоторый риск развития двунаправленной ЖТ. Влияние на интервал Q-T зависит от дозы; проаритмия обычно возникает в пределах первых 2-3 дней от начала терапии. Таким образом, необходимо начинать терапию дофетилидомΡ в стационаре, и пациентов следует мониторировать как минимум 3 дня. Доза дофетилидаΡ должна быть подобрана в зависимости от клиренса креатинина (табл. 29.9).
Таблица 29.9. Антиаритмические препараты для фармакологической кардиоверсии при фибрилляции предсердий

Препарат |
Путь |
Доза |
Класс |
Уровень |
Класс |
Уровень |
Потенциальные |
|
|
введения |
|
|
доказа- |
|
доказа- |
побочные |
|
|
|
|
|
тель- |
|
тель- |
эффекты |
|
|
|
|
|
ности |
|
ности |
|
|
|
|
|
|
|
|
|
|
|
Флекаинид |
Для |
Нагрузочная |
I |
A |
IIb |
B |
ТП с быстрым |
|
|
приема |
доза 200- |
|
|
|
|
проведением; |
|
|
внутрь |
300 мг или 1,5- |
|
|
|
|
желудочковая |
|
|
или в/в |
3,0 мг/кг |
|
|
|
|
проаритмия у |
|
|
|
за 10-20 мин |
|
|
|
|
пациентов с |
|
|
|
|
|
|
|
миокардиальной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ишемией; возможно |
|
Пропа- |
Для |
Нагрузочная |
I |
A |
IIb |
B |
|
|
|
||||||||
ухудшение функции |
|
|||||||
фенон |
приема |
доза 450- |
|
|
|
|
желудочков при |
|
|
внутрь |
600 мг или 1,5- |
|
|
|
|
органическом |
|
|
или в/в |
2,0 мг/кг |
|
|
|
|
заболевании сердца |
|
|
|
за 10-20 мин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ибутилид |
В/в |
1 мг за 1 мин; |
IIa |
A |
IIa |
A |
Увеличение |
|
|
|
повтор, если |
|
|
|
|
интервала Q-T; |
|
|
|
требуется 1 мг |
|
|
|
|
двунаправленная |
|
|
|
|
|
|
|
|
ЖТ; гипотензия |
|
|
|
|
|
|
|
|
|
|
Соталол |
В/в |
1-1,5 мг/кг |
III |
A |
III |
B |
Увеличение |
|
|
|
|
|
|
|
|
интервала Q-T; |
|
|
|
|
|
|
|
|
|
|
|
Для |
80 мг |
IIb |
B |
III |
B |
двунаправленная |
|
|
ЖТ; брадикардия; |
|
||||||
|
приема |
начальная |
|
|
|
|
|
|
|
|
|
|
|
гипотензия |
|
||
|
внутрь |
доза; затем |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
160-320 мг в |
|
|
|
|
|
|
|
|
поделенных |
|
|
|
|
|
|
|
|
дозах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дофе- |
Для |
125-500 мг |
I |
A |
I |
I |
Увеличение |
|
тилидΡ |
приема |
дважды в |
|
|
|
|
интервала Q-T; |
|
|
внутрь |
день* |
|
|
|
|
двунаправленная |
|
|
|
|
|
|
|
|
ЖТ; |
|
|
|
|
|
|
|
|
противопоказан, |
|
|
|
|
|
|
|
|
если клиренс |
|
|
|
|
|
|
|
|
креатинина ‹2 |
|
|
|
|
|
|
|
|
мл/ мин |
|
|
|
|
|
|
|
|
|
|
Амио- |
Для |
В стационаре: |
IIa |
A |
IIa |
A |
Гипотензия; |
|
дарон |
приема |
1200-1800 мг в |
|
|
|
|
брадикардия; |
|
|
внутрь |
день в |
|
|
|
|
удлинение |
|
|
или в/в |
поделенных |
|
|
|
|
интервала Q-T; |
|
|
|
дозах до 10 г |
|
|
|
|
двунаправленная |
|
|
|
суммарно; |
|
|
|
|
ЖТ (риск ‹1%); |
|
|
|
затем 200- |
|
|
|
|
флебит (в/в); |
|
|
|
400 мг |
|
|
|
|
расстройства ЖКТ; |
|
|
|
ежедневно. |
|
|
|
|
запоры (при |
|
|
|
Амбулаторно: |
|
|
|
|
пероральном |
|
|
|
|
|
|
|
приеме); |
|
|
|
|
600-800 мг |
|
|
|
|
|
|
|
|
|
|
|
|
мультиорганная |
|
|
|
|
ежедневно до |
|
|
|
|
|
|
|
|
|
|
|
|
токсичность при |
|
|
|
|
10 г суммарно; |
|
|
|
|
|
|
|
|
|
|
|
|
длительном приеме |
|
|
|
|
затем 200- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
400 мг |
|
|
|
|
|
|
|
|
ежедневно |
|
|
|
|
|
|
|
|
5-7 мг/кг за 30- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
60 мин в/в; |
|
|
|
|
|
|
|
затем 1200- |
|
|
|
|
|
|
|
1800 мг |
|
|
|
|
|
|
|
ежедневно |
|
|
|
|
|
|
|
через рот до |
|
|
|
|
|
|
|
10 г суммарно; |
|
|
|
|
|
|
|
затем 200- |
|
|
|
|
|
|
|
400 мг |
|
|
|
|
|
|
|
ежедневно |
|
|
|
|
|
|
|
|
|
|
|
|
|
Проко- |
В/в |
1000 мг за |
IIb |
B |
IIb |
C |
Расширение |
аинамид |
|
30 мин |
|
|
|
|
комплекса QRS; |
(новока- |
|
(33 мг/ мин) с |
|
|
|
|
двунаправленная |
инамид)** |
|
последующей |
|
|
|
|
ЖТ; быстрое |
|
|
инфузией |
|
|
|
|
трепетение |
|
|
2 мг/ мин |
|
|
|
|
предсердий |
|
|
|
|
|
|
|
|
Примечания: * - доза зависит от клиренса креатинина: >60 мл/мин - 500 мг; 40-60 мл/мин - 250 мг; 20-40 мл/мин - 125 мг дважды в день; противопоказано при клиренсе креатинина ‹20 мл/мин; ** - ограниченное использование или отмена препарата.
В/в форма соталола (1-1,5 мг/кг) неэффективна для острой фармакологической кардиоверсии ФП. Частота купирования составляет 10-20% и не отличается от плацебо [261, 262, 268, 269]. Антифибрилляторный эффект соталола ограничен обратной зависимостью его действия от предсердной рефрактерности: соталол удлиняет эффективный рефрактерный период предсердий при нормальной или низкой частоте сокращений предсердий, но не во время быстрой ФП.
Доказано, что пероральная форма соталола способствует восстановлению синусового ритма и может контролировать частоту желудочковых сокращений у пациентов, ожидающих электрической кардиоверсии. В исследовании SAFE-T (Sotalol Amiodarone Atrial Fibrillation Efficacy /
Эффективность соталола и амиодарона при фибрилляции предсердий) у 24,2% пациентов с персистирующей ФП, получавших соталол, восстановился синусовый ритм в течение 28 дней, по сравнению с 27,1% при терапии амиодароном и только у 0,8%, получавших плацебо [19].
Неблагоприятные эффекты соталола включают гипотензию, брадикардию, удлинение интервала Q-T и желудочковые проаритмии (двунаправленная ЖТ). Бради-кардия и гипотензия были наиболее частыми проявлениями при в/в введении соталола [19]. Риск проаритмо-генного эффекта повышается при наличии гипертрофии ЛЖ и при ХПН. Препарат противопоказан в этих ситуациях.
Амиодарон принято считать относительно безопасным препаратом для острой фармакологической кардиоверсии, и это препарат выбора у пациентов с выраженными фоновыми заболеваниями сердца. Амиодарон не имеет негативного инотропного эффекта, он контролирует частоту желудочковых сокращений и ассоциирован с низкой частотой возникновения двунаправленной ЖТ. В метаанализе 13 рандомизированных контролируемых исследований, в сумме включавших 1174 пациентов, эффективность амиодарона (при вычитании эффекта плацебо) составляла 44%, но момент восстановления ритма был замедлен до 24 ч [270]. В/в введение амиодарона с последующим переходом на прием внутрь поддерживающей дозы повышает вероятность купирования аритмии [271].
Исследование смертности и заболеваемости CHF-STAT (Congestive Heart Failure Survival Trial of
Antiarrhythmic Therapy / Исследование выживаемости при застойной сердечной недостаточности на антиаритмической терапии) у пациентов со средней ФВ ЛЖ 25% показало, что длительное лечение амиодароном в дозе 400 мг в сутки в течение первого года и 300 мг в сутки в дальнейшем было ассоциировано с большей частотой купирования ФП по сравнению с плацебо (31% против
7,7%) [272].
В отличие от пропафенона и флекаинида, амиодарон сохраняет свою эффективность у пациентов с длительно существующей ФП. Таким образом, у пациентов со средней длительностью ФП почти 2 года, амиодарон в дозе 600 мг в сутки в течение 4 нед восстанавливал синусовый ритм в 34% случаев по сравнению с 0% в группе плацебо [373].
Амиодарон удлиняет интервал Q-T, но, в отличие от "чистых" препаратов III класса, имеет низкий проаритмогенный потенциал (‹1%) [274]. Наиболее частые побочные эффекты внитривенного введения амиодарона - гипотензия и относительная брадикардия.
Препараты Iа класса прокаинамид (для приема внутрь и в/в) и хинидин (для приема внутрь) широко использовались для купирования ФП в прошлом. При прямом сравнении эффективности в/в прокаинамида 1000-1200 мг была сопоставимой с таковой у пропафенона (69,5% против 48,7%) [275], флекаинида (65% против 92%) [276] и амиодарона (68,5% против 89,1%) [277] для купирования ФП длительностью ‹48 ч. Хинидин при приеме внутрь в кумулятивной дозе до 12002400 мг в течение 24 ч купировал ФП в 60-80% случаев при ФП малой продолжительности [278,
279].
По причине нецелевых эффектов (вазодилатация, гипотензия, антихолинергическое действие, ухудшение СН, а также гастроинтенстинальный дискомфорт и 6% риск двунаправленной ЖТ при использовании хинидина) данные препараты все меньше используются для кардиоверсии ФП.
Эффективность дизопирамида для острой фармакологической кардиоверсии ФП мало доказана. В одном исследовании дизопирамид при введении болюсом 2 мг/кг в течение 5 мин восстанавливал синусовый ритм у 71% пациентов с пароксизмальной изолированной ФП и у трех из семи пациентов (43%) с ТП [280]. Однако считается общепринятым, что неблагоприятные эффекты, такие как проаритмии, гипотензия, асистолия и нецелевые эффекты из-за антихолинергической активности дизопирамида, могут перевесить его умеренный антиаритмический потенциал.
Вернакалант (Vernakalant) - новый антиаритмический препарат [281]. Он имеет сродство с ионными каналами, участвующими в процессах реполяризации в предсердной ткани, в частности, ультрабыстром калиевом реполяризационом токе IKur, при этом оказывает малое влияние на основные ионные токи реполяризации желудочков. Однако он ингибирует входящий натриевый ток (INa) и замедляет проведение в миокарде, особенно на высоких частотах.
В рандомизированном двойном слепом плацебо-контролируемом исследовании ACT (Atrial arrhythmia Conversion Trials / Исследование купирования пред-сердных аритмий) вернакалант вводился в течение 10 мин в дозе 3 мг/кг (затем вторая инфузия 2 мг/кг, если ФП не купировалась в течение 15 мин). Препарат был значительно эффективнее, чем плацебо для кардиоверсии ФП длительностью ‹7 дней (52% против 3,6-4%) [282, 283]. Наиболее высокая эффективность наблюдалась в группе ФП длительностью ≤72 ч (70-80%). Вернакалант оказался неэффективным в отношении ФП длительностью >7 дней и не купировал ТП.
Препарат хорошо переносился; наиболее частыми побочными эффектами (>5%) были извращение вкуса, чихание и тошнота. Описывалось небольшое удлинение интервала Q-TC, однако проаритмогенный эффект не имел места или отмечался крайне редко.
Сульфат магния. Был проведен метаанализ восьми исследований (в сумме 476 пациентов) с в/в введением сульфата магния в начальной дозе 1200-5000 мг в течение 1-30 мин (в некоторых исследованиях затем вводилась вторая доза или проводилось длительное введение в течение 2- 6 ч). Сульфат магния лучше купировал ФП, чем плацебо, или же имел сравнимую эффективность (отношение шансов 1,6 [95% ДИ, 1,07-2,39]) [285]. Наиболее частым побочным эффектом было ощущение тепла и прилива. Магнезия удлиняет рефрактерные периоды предсердий и АВ-узла и, таким образом, в добавление к его антифибрилляторному эффекту, может замедлять частоту сокращения желудочков. Магнезия не используется рутинно для фармакологической кардиоверсии ФП, но может потенцировать эффект других антиаритмических препаратов.
Препараты наперстянки, β-адреноблокаторы и блокаторы медленных кальциевых каналов зачастую неэффективны для острого купирования ФП [286, 287]. Дигоксин может даже иметь профибрилляторный эффект из-за его холинергического эффекта, который может вызывать негомогенное замедление скорости проведения и неравномерное снижение эффективного рефрактерного периода в предсердиях [288]. Короткодействующие в/в β-адреноблокаторы (например, эсмолол) и недигидропиридиновые блокаторы медленных кальциевых каналов (Верапамил и дилтиазем) чаще используются для контроля частоты ритма, чем для восстановления синусового ритма.
ПРОФИЛАКТИКА ПАРОКСИЗМОВ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Протекторная антиаритмическая терапия рекомендуется пациентам с пароксизмальной ФП при частых пароксизмах с выраженными клиническими проявлениями или при ухудшении функции ЛЖ. Антиаритмическая терапия также показана пациентам с персистирующей ФП, когда вероятность удержания синусового ритма вызывает сомнения особенно у пациентов со структурными заболеваниями сердца и ремоделированным ЛП. После кардиоверсии приблизительно у 25-50%
β-Адреноблокаторы малоэффективны в профилактике ФП и чаще всего используются для контроля ЧСС. Некоторые исследователи пишут о том, что рецидивы в течение первого года у пациентов после кардиоверсии возникают немного реже на терапии β-адреноблокаторами (метопролол по 100 мг в сутки или бисопролол по 5 мг в сутки) по сравнению с плацебо (48% против 60%) [290] или по сравнению с соталолом (42% против 41%) [291]. Нет доказательств преимущества одного типа β-адреноблокаторов над другими в отношении предотвращения ФП [292]. Однако, учитывая их безопасность и эффект в отношении контроля АВ-проведения во время тахисистолической ФП, β-адреноблокаторы часто используются как начальная терапия у пациентов с впервые возникшим пароксизмом ФП.
Кроме того, β-адреноблокаторы могут назначаться пациентам с ФП, ассоциированной с ХСН: метаанализ 7 исследований (всего 1952 пациента) показал, что терапия β-адреноблокаторами была ассоциирована со статистически существенным уменьшением вероятности возникновения новых пароксизмов ФП на 27% за период наблюдения 1,35 лет. β-Адреноблокаторы считают препаратами первой линии у пациентов с тиреотоксикозом и реже у пациентов с симпатозависимой ФП [293, 294].
Пропафенон и флекаинид рекомендуются как препараты первой линии для лечения ФП у пациентов без значимой органической патологии сердца, то есть у пациентов без ХСН, дисфункции ЛЖ, выраженной гипертрофии миокарда, перенесенного ИМ или ИБС. Как пропафенон (300-900 мг в сутки в 2-3 приема), так и флекаинид (50-150 мг в сутки в 2 приема) снижают вероятность рецидивов приблизительно у двух третей пациентов [254, 289, 296-300], без преимуществ одного препарата над другим. В метаанализе исследований пропафенона частота рецидивов ФП в течение 1 года составила 56,8% (52,3-61,3%) [254]. Смертность по любой причине, ассоциированная с приемом пропафенона, составила 0,3%. Некоторые плацебо-контролируемые и сравнивающие исследования флекаинида в дозе 200-300 мг в сутки показали 60-70% эффективность в отношении удержания синусового ритма в течение года с допустимым соотношением "риск-польза" [296, 299, 300].
Пропафенон доступен в виде препарата медленного высвобождения в дозе 225, 325, или 425 мг 2 раза в сутки. Исследования RAFT (Recurrence of Atrial Fibrillation / Исследование рецидивов фибрилляции предсердий) [301] в Северной Америке и европейский эквивалент - ERAFT [302] показали, что пропафенон-SR по сравнению с плацебо продлевал время до возникновения первых симптомных пароксизмов ФП у пациентов с малыми структурными изменениями сердца. Флекаинид также выпускается в пролонгированной форме в некоторых частях Европы, однако работ по эффективности и безопасности этих форм препарата не было опубликовано.
В некоторых странах доступны другие препараты Iс класса: пилсикаинидΡ (доступен в Японии) и цибензолинΡ (доступен в Японии и Франции). Оба препарата малоэффективны для кардиоверсии (45% для пилсикаинидаΡ) и/или профилактики ФП (максимально 41% для пилсикаинидаΡ, 51% для цибензолинаΡ в течение одного года) и обладают побочными эффектами, характерными для других препаратов Iс класса [303, 304].
Хинидин использовался для лечения ФП со времен открытия его антиаритмических свойств в начале 1920-х. В метаанализе шести рандомизированных контролируемых исследований (всего 808 пациентов), опубликованном в 1990 г., 50% пациентов, получавших хинидин, удерживали синусовый ритм в течение года по сравнению с 25% в группе контроля [305]. Антиаритмическому эффекту хинидина противопоставлялся высокий риск внезапной смерти у пациентов, получавших этот препарат, по сравнению с группой контроля (2,9% против 0,8%; отношение шансов 2,98) [305]. В 2006 г. проводилось 2 масштабных исследования эффективности хинидина: PAFAC (Prevention of Atrial Fibrillation After Cardioversion /
Профилактика фибрилляции предсердий после кардиоверсии) и SOPAT (Suppression of Paroxysmal Atrial tachyarrhythmias / Подавление пароксизмальных предсердных тахиаритмий). Хинидин вызывал уменьшение количества рецидивов ФП на 49% [289]. В исследованиях PAFAC и SOPAT хинидин не увеличивал риск внезапной смерти, возможно, потому, что назначался в малых дозах (320-480 мг по сравнению с дозами 1000-1800 мг в сутки в предыдущих исследованиях [305]), в комбинации с верапамилом (одна комбинированная таблетка) и у пациентов с малыми структурными изменениями сердца. Однако самой главной особенностью хинидина является его способность вызывать желудочковые нарушения ритма, включая двунаправленную ЖТ даже в малых субтерапевтических дозах [234].
Дизопирамид редко используется в лечении ФП в связи с его отрицательным инотропным эффектом, проаритмогенной активностью (может вызывать двунаправленную ЖТ), плохой переносимостью из-за выраженной антихолинергической активности. Однако назначение дизопирамида рекомендуется пациентам с вагозависимой пароксизмальной формой ФП. Данных об эффективности этого препарата немного [305, 306].
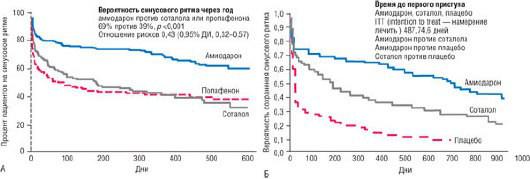
Соталол может предотвращать рецидивы ФП при отсутствии СН, инфаркта миокада, артериальной гипертензии с формированием выраженной гипертрофии ЛЖ [308-310]. Обладая β- адреноблокирующим эффектом, соталол вызывает урежение ЧСС во время пароксизмов ФП. Средняя доза для лечения ФП - 80-160 мг 2 раза в день. Метаанализ 9 рандомизированных контролируемых исследований показал, что соталол уменьшает вероятность рецидивов ФП на
47% [289]. В Канадском исследовании ФП CTAF (the Canadian Trial of Atrial Fibrillation), соталол показал себя менее эффективным по сравнению с кордароном в удержании синусового ритма (рис. 29.32) [311]. В исследовании SAFE-T соталол в дозе 160 мг в сутки оказался более эффективным по сравнению с плацебо, но менее эффективным по сравнению с кордароном в удержании синусового ритма после электрической кардиоверсии [19]. Через 2 года приблизительно 30% пациентов, получавших терапию соталолом, удерживали синусовый ритм по сравнению с 60% пациентов, получавших кордарон, и 10% пациентов из группы плацебо. Эффективность соталола была сходна с антиаритмическими препаратами I класса, и уступала эффективности кордарона в подисследовании AFFIRM (48, 45 и 66%, соответственно) [312].
Рис. 29.32. Вероятность отсутствия возвратной ФП при амиодароне и соталоле в исследовании Canadian Trial of Atrial Fibrillation (CTAF) (Канадское исследование ФП) (А) и
Sotalol Amiodarone Atrial Fibrillation Efficacy Trial (SAFE-T) (Эффективность соталола и амиодарона при ФП) (Б). ITT (intention to treat) - намерение лечить. Изменено: Roy D.,
Talajic M., Dorian P. et al.; for the Canadian Trial of Atrial Fibrillation Investigators. Amiodarone to prevent recurrence of atrial fibrillation // N. Engl. J. Med. - 2000. - Vol. 342. - P. 913-920 и Singh B.N., Singh S.N., Reda D.J. et al.; Sotalol Amiodarone Atrial Fibrillation Efficacy Trial (SAFE-T) Investigators. Amiodarone versus sotalol for atrial fibrillation // N. Engl. J. Med. - 2005. - Vol. 352. - P. 1861-1872.
Гипотензия и брадикардия были наиболее распространенными сердечно-сосудистыми побочными эффектами соталола и составляли около 6-10%, в то время как желудочковый проаритмогенный эффект, связанный с удлинением интервала Q-T, был описан у 1-4% пациентов и был дозозависимым [308, 310]. Желудочковый проаритмогенный эффект вызывает соответствующую озабоченность и чаще всего ассоциирован с удлинением интервала Q-T.
ДофетилидΡ относительно безопасен для лечения пациентов с перенесенными ИМ и/или с ХСН. В подисследовании DIAMOND исследований DIAMOND-CHF и DIAMOND-MI, 506 пациентов с ФП, получавших дофетилидΡ в дозе 500 мкг 2 раза в день, лучше удерживали синусовый ритм по сравнению с группой плацебо (79% против 42%) [236]. У пациентов, получавших дофетилидΡ, реже возникали новые эпизоды ФП по сравнению с группой плацебо (1,23% против 3,78%) [311, 312]; Этот эффект был более выраженным среди пациентов с ХСН III-IV ФК по NYHA, включенных в исследование DIAMOND-CHF (1,98% против 6,55%) [313]. ДофетилидΡ оказался почти в два раза эффективнее в отношении профилактики ТП по сравнению с ФП (73% против 40%) [266].
Большую важность имеет проаритмогенный дозо-зависимый эффект дофетилидаΡ, а именно его способ-ность вызывать двунаправленную ЖТ. Например, вероятность возникновения двунаправленной ЖТ варьирует от 0% в дозе менее 250 мкг 2 раза в сутки до 10% и более в дозе более 500 мкг 2 раза в сутки, и большая часть таких эпизодов приходится на первые 3-4 дня от момента назначения препарата [234]. ДофетилидΡ выводится преимущественно почками, и доза препарата должна быть подобрана в соответствии с клиренсом креатина (см. табл. 29.9); препарат не должен назначаться пациентам с выраженными нарушениями функции почек (клиренс креатина ‹20), гипокалиемией, гипомагниемией и удлинением интервала Q-T >500 мс. При увеличении Q-T >500 мс или при приросте Q-T более чем на 15% по сравнению с исходным значением необходимо снижать дозу препарата.
Амиодарон на сегодняшний день является лучшим антиаритмическим препаратом для поддержания синусового ритма у пациентов с органической патологией сердца и у пациентов,