
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdfусиливаться при физической нагрузке либо возникать только в определенной ситуации (например, ночью). Стандартная исходная ЭКГ в 12 отведениях завершает начальную диагностику и может быть совмещена с пробой Вальсальвы, массажем каротидного синуса и тилт-тестом, что позволяет получить более детальную информацию о состоянии вегетативной нервной системы [39]. Проба с физической нагрузкой часто бывает полезной, так как может выявить хронотропную недостаточность или обратимость АВ-блокады второй степени у молодых пациентов [19-21].
У пациентов с симптомами, вероятно обусловленными брадикардией, важным фактором, определяющим дальнейшие врачебные решения, будет установление причинной связи между имеющимися симптомами и эпизодами брадикардии. Иерархия диагностических тестов зависит от глубины клинического мышления, так как некоторые из них могут быть более предпочтительны, чем другие, для быстрой и точной диагностики.
ДЛИТЕЛЬНАЯ РЕГИСТРАЦИЯ ЭКГ
ХОЛТЕРОВСКОЕ МОНИТОРИРОВАНИЕ
Амбулаторная регистрация ЭКГ (см. главу 2) в течение 24-48 ч применяется у пациентов с предполагаемой преходящей клинически выраженной брадикардией с целью сопоставления симптомов с эпизодами брадикардии [65, 66]. Такие часто выявляемые формы брадикардии, как синусовая брадикардия, АВ-блокада первой степени и даже АВ-блокада второй степени типа Мобитц I (Венкебаха), могут считаться нормальными проявлениями у молодых и/или хорошо тренированных людей. Однако те же состояния считаются патологическими, если, например, их появление усиливает левожелудочковую декомпенсацию, проявляющуюся симптомами СН. Напротив, признаки СССУ, синдрома брадикардии-тахикардии, АВ-блокады второй степени типа Мобитц II и АВ-блокады третьей степени с паузами желудочков >3 с, хотя встречаются и менее часто, всегда являются патологическими. Паузы до 2,8 с в дневное время и до 4,0 с в ночное время при ФП могут быть допустимыми, если хорошо переносятся пациентом [23].
РЕГИСТРАТОРЫ СОБЫТИЙ И ИМПЛАНТИРУЕМЫЕ ЗАПИСЫВАЮЩИЕ УСТРОЙСТВА
При ХМ, даже при увеличении его длительности до 48 ч, часто не удается выявить причину жалоб пациента, особенно, если эпизоды брадикардии преходящие, с длительными периодами нормального синусового ритма и/или минимальными симптомами. В таких случаях поможет использование двух других диагностических устройств.
•Регистраторы транзиторных событий можно носить в течение месяца или более, они позволяют проводить цифровую регистрацию ЭКГ длительностью до 30 с при инициации пациентами в то время, когда они испытывают симптомы. Учитывая, что пациент остается в сознании к моменту начала симптомов, показано, что процедура более эффективна и экономична, чем ХМ у пациентов с периодическим ощущением сердцебиения [67]. Самые современные регистраторы ЭКГ с петлевой памятью (loop recorders) дают возможность регистрировать до 3 каналов ЭКГ и также запускать сохранение брадикардии и аритмии с автоматической передачей данных посредством мобильной связи через Bluetooth-соединение.
•Имплантируемые мониторы (см. главу 26) могут быть особенно полезными в изучении нечасто повторяющихся симптомов, особенно если не удается установить диагноз с помощью ХМ или регистратора преходящих событий. Имплантируемые мониторы позволяют проводить мониторирование пациентов в течение продолжительного периода времени, увеличивая диагностическую результативность до 85% при трудно диагностируемых причинах обмороков [68]. В связи с возможным продолжительным периодом наблюдения, в некоторых случаях превышающим 3 года, имплантируемый монитор стал ключевым фактором в установлении временной связи с обмороком у пациентов с подозрением на редкие эпизоды аритмии (рис. 27.4). Показано, что они наиболее полезны у пациентов с нечастыми, необъяснимыми обмороками, если неинвазивные тесты отрицательны [69].

Рис. 27.4. Записи имплантируемых мониторов, демонстрирующие АВ-блокаду третьей степени у пациентки 68 лет с 3-летним анамнезом повторных обмороков и отрицательным результатом электрофизиологического исследования.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Необъяснимые обмороки могут быть результатом дисфункции синусового узла или АВ-блокады и считаются показанием к ЭФИ (см. главы 28 и 30), если неинвазивной оценкой не удалось установить этиологию заболевания [70]. Хотя более чем у 50% пациентов причину обморока диагностируют неинвазивным путем (анамнез, физикальный осмотр, ЭКГ, ХМ, регистратор ЭКГ), ЭФИ могут быть показаны с целью установления причины у остальных пациентов, особенно при наличии известного заболевания сердца [71]. Однако по своей природе преходящие нарушения проведения трудно идентифицировать даже при ЭФИ [72], и диагноз иногда может быть установлен путем исключения других потенциальных причин обмороков кардиального происхождения.
При ЭФИ функции синусового узла измеряют время восстановления синусового узла, которое потом корригируется по частоте спонтанного синусового ритма вычитанием длины синусового цикла. Нормальные значения корригированного времени восстановления функции синусового узла составляют ‹550 мс, а более продолжительное время восстановления наблюдают у пациентов с дисфункцией синусового узла. Прогностическая значимость удлиненного времени восстановления функции синусового узла неизвестна. Однако принято, что если корригированное время восстановления функции синусового узла превышает 800 мс, то СССУ может быть причиной обморока [53]. У всех пациентов для оценки АВ-проведения следует зарегистрировать электрограмму пучка Гиса, а также измерить основные интервалы А-Н (предсердия-пучок Гиса) и H-V (пучок Гиса-желудочки), поскольку часто встречаются сопутствующие нарушения проведения. Нормальные значения интервалов A-H и H-V у взрослых варьируют в пределах 60-125 мс и 35-
55 мс соответственно.

ЭФИ можно использовать для уточнения характера АВили внутрижелудочковых нарушений проведения, когда уровень блокады не может быть установлен по ЭКГ. ЭФИ помогают диагностировать пациентов с высоким риском прогрессирования в полную АВ-блокаду, которым может потребоваться имплантация стимулятора. Таким образом, у асимптомных пациентов с двухили трехпучковой блокадой постоянную стимуляцию считают целесообразной только в случае выявления АВ-блокады второй или третьей степени или признаков тяжелого нарушения проведения ниже уровня АВ-узла (HV >100 мс, а также внутригисиальная или инфрагисиальная блокада во время частой стимуляции предсердий) при ЭФИ (рис. 27.5).
Рис. 27.5. Записи электрофизиологического исследования, демонстрирующие интрагисиальную блокаду, вызванную частой стимуляцией предсердий. В каждом блоке представлены четыре поверхностных отведения и внутрисердечные электрограммы, зарегистрированные в высоких отделах ПП (HRAd), области пучка Гиса [проксимальной (HISp), срединной (HISm), дистальной (HISd)] и в верхушке ПЖ (RVAp). Обозначены потенциалы H (зеленая стрелка) и H′ (синяя стрелка). PCL - продолжительность цикла стимуляции. А - при продолжительности цикла стимуляции предсердий 900 мс наблюдают расщепление потенциала Гиса (H-H′) c интервалами A-H 75 мс, H-H′ 60 мс и H′-V 42 мс. Б - при длине цикла стимуляции предсердий 700 мс, расщепленные потенциалы пучка Гиса наблюдают во время проведенных комплексов, но только начальный компонент (Н) присутствует во время блокированных комплексов, свидетельствуя об
интрагисиальной АВ-блокаде. Источник (с разрешения): Bilchick K.C., Rade J.J., Marine J.E. Change in H-H′ interval during intrahisian block: What is the mechanism? // Heart Rhythm. - 2007. - Vol. 4. - P. 104-105.
ЭФИ считается нормальным при отсутствии нижеперечисленного:
•патологическое время восстановления синусового узла;
•исходный интервал H-V ≥70 мс;
•блокада в системе Гиса-Пуркинье второй или третьей степени, выявляемая во время учащающейся стимуляции предсердий, или блокада в системе Гиса-Пуркинье высокой степени, вызванная в/в введением аймалина;
•индукция устойчивой мономорфной ЖТ при программированной электрической стимуляции;
•индукция быстрой НЖТ, приводящей к нестабильности гемодинамики, особенно если воспроизводятся спонтанные симптомы.
ЭФИ связано с низким риском осложнений. Однако возможны повреждение артерий, тромбофлебит, системные артериальные эмболии, легочные эмболии, прободение сердца. Кроме того, могут появляться индуцированная катетером полная АВ-блокада, ФП и другая тахиаритмия, иногда требующая проведения кардиоверсии [73]. Следовательно, как и при любой инвазивной процедуре, обязательны тщательная оценка вероятной пользы исследования для диагностики и получение полного информированного согласия.
ЛЕЧЕНИЕ БРАДИКАРДИИ
Первый шаг лечения - выявление обратимой или ситуационной брадикардии, отмена вызывающих ее ЛС либо других провоцирующих факторов во всех случаях. При отсутствии устранимой причины могут потребоваться медикаментозная терапия или лечение с применением временной или постоянной стимуляции.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Обычно не требуется лечение пациентов с синусовой брадикардией, синусовой брадиаритмией, синусовыми паузами или остановкой синусового узла длительностью менее 3 с. При более значимой брадикардии в острых случаях могжно использовать в/в атропин (0,5 мг, при необходимости повторно) или изопреналин для острого ускорения сердечного ритма и улучшения работы сердца. Однако в ряде случаев могут возникать парадоксальные реакции [74, 75]. Некоторые пациенты с клинически выраженной брадикардией могут чувствовать улучшение при приеме внутрь теофиллина [76], хотя это редко дает эффект при длительном применении. Пациентов с СССУ и/или нарушениями АВ-проведения необходимо рассматривать и оценивать на предмет имплантации временного или постоянного искусственного водителя ритма.
УСТАНОВКА ВРЕМЕННОГО КАРДИОСТИМУЛЯТОРА
Как правило, временную стимуляцию осуществляют трансвенозно, хотя процедура может также выполняться через пищевод, чрескожно или эпикардиально. Трансвенозную стимуляцию проводят под местной анестезией и всегда в строго асептических условиях. После чрескожной пункции подключичной, внутренней яремной или бедренной вены катетеры-баллоны (без рентгеновского контроля) или жесткие катетеры (под рентгеновским контролем) продвигают в правые камеры сердца. Временную трансвенозную стимуляцию считают относительно безопасной процедурой. Однако как инвазивная процедура она приводит к таким осложнениям, как инфекция, местная гематома, венозный тромбоз, перфорация артерии, пневмоторакс, гемоторакс и перфорация миокарда.
Чреспищеводная стимуляция считается простой и безопасной, но этим способом можно достоверно выполнить только стимуляцию предсердий, но не желудочков. Чрескожная стимуляция желудочков может быть выполнена с помощью электродов для наружных дефибрилляторов большой площади и с высоким импедансом. Кроме того, такую стимуляцию можно использовать в неотложных случаях при выраженной брадикардии или асистолии. Однако этот вид стимуляции плохо переносится некоторыми пациентами, поскольку вызывает болезненную стимуляцию скелетной мускулатуры. Временная эпикардиальная стимуляция сердца требует хирургического введения электродов и используется у кардиохирургических пациентов в послеоперационном периоде.
ИМПЛАНТАЦИЯ КАРДИОСТИМУЛЯТОРА
Если в начале 1950-х годов стимуляторы были большими наружными устройствами, которые использовались, главным образом, по жизненным показаниям, то в настоящее время имплантируемые водители ритма стали "золотым стандартом" лечения брадикардии с выраженными клиническими проявлениями при наличии определенных показаний. Первая имплантация стимулятора у человека была выполнена в 1958 г. Элмквистом (Elmqvist) и Сеннингом (Senning) [77], вскоре после имплантации первого эндокардиального электрода Фурманом (Furman) и Робинсоном (Robinson) [78]. Через два десятилетия после первой успешной имплантации объектом исследований стала разработка более надежных источников питания и электродов. В настоящее время миллионы пациентов по всему миру имеют имплантируемые стимуляторы, которые выполнены по усовершенствованным технологиям. Согласно данным опубликованного всемирного наблюдения по кардиостимуляции, в 2005 г. в 43 странах было
зарегистрировано >540 000 новых имплантаций стимулятора, и их число увеличивается [79]. Однако существует разнообразие частоты имплантаций на национальном и региональном уровне. В США в 2007 г.
было примерно 880 новых имплантаций на 1 млн населения, в то время как в Западной Европе эти цифры колебались от 419 на миллион (Ирландия) до 1200 на миллион (Германия) [80]. Этот разброс может частично отражать различия в распределении по возрасту и заболеваемости в соответствующих популяциях, но, возможно, связан с наличием ресурсов, финансовыми параметрами и разными вариантами реализации опубликованных методических рекомендаций.
Имплантированные кардиостимуляторы производят локальную электрическую стимуляцию сердечной ткани, которая, распространяясь, активирует миокард, приводя к мышечному сокращению. Распространение инициированного стимулятором электрического импульса продолжается нефизиологическим путем, что может иметь важные электрические и механические последствия, особенно при длительной стимуляции. Следовательно, искусственную стимуляцию следует применять только в тех случаях, когда это действительно требуется, при этом следует имитировать или сохранять естественную последовательность активации при любой возможности. Именно поэтому необходимо разработать индивидуально адаптированные показания к установке стимулятора.
Достижения микроэлектроники позволили выпускать очень маленькие устройства с повышенным сроком службы и широким диапазоном опций программирования, а электроды для стимуляции стали тоньше и более долговечными. Это способствовало достижению первичной цели, которой считается проведение адекватной коррекции дефектов формирования и проведения импульса таким путем, чтобы как можно точнее симулировать естественную, присущую организму электрическую функцию сердца, а также удовлетворение потребностей пациента при минимизации побочных эффектов. Данная концепция физиологической стимуляции привела к разработке сложных двух-, трех- и четырехкамерных стимуляторов, предназначенных для сохранения или восстановления АВ- и/или внутрижелудочковой синхронии [81-83], а также модуляции ЧСС с помощью сенсорного управления, предназначенного для устранения хронотропной недостаточности. В последние годы электрическая стимуляция применяется в области ресинхронизации сердца как дополнительного способа лечения пациентов с рефрактерной к медикаментозной терапии СН и замедлением желудочкового проведения.
СОВРЕМЕННАЯ КЛАССИФИКАЦИЯ КАРДИОСТИМУЛЯТОРОВ
Пятибуквенный код для идентификации кардиостимуляторов и режимов стимуляции (NBG код)
был создан North American Society of Pacing and Electrophysiology (NASPE, Североамериканским обществом стимуляции и электрофизиологии) и British Pacing and Electrophysiology Group (BPEG, Британской группой стимуляции и электрофизиологии) в 1987 г. [84] и пересмотрен в 2002 г. [85].
Первая буква обозначает стимулируемую (-ые) камеру (-ы) сердца (A - предсердие, V - желудочек, D - обе), вторая буква - воспринимающую (-ие) камеру (-ы), а третья буква - ответ кардиостимулятора на восприятие [T - триггер (запуск); I - подавление; D - обе функции]. Таким образом, кардиостимулятор AAI стимулирует предсердия, воспринимает в предсердиях и подавляет стимуляцию, если наблюдается спонтанная электрическая активность. В стимуляторе DDD стимуляция и восприятие происходят и в предсердиях, и в желудочках, а реагирование идет двояким способом: импульс, воспринятый в предсердиях, подавляет стимуляцию предсердий и вызывает стимуляцию желудочков после задержки, имитируя физиологическую последовательность АВ-проведения. Четвертая буква обозначает наличие (R) или отсутствие (O) частотно-адаптивного механизма (реактивность частоты ритма), который модулирует ЧСС независимо от внутренней активности сердца (например, во время физической нагрузки). Пятую букву используют для обозначения мультисайтовой стимуляции, присутствует ли она в предсердиях (А), желудочках (V), в предсердиях и желудочках (D) или ни в предсердиях, ни в желудочках (O; табл. 27.2).
Таким образом, модифицированный код обеспечивает описание трехкамерных стимуляторов, используемых для бивентрикулярной стимуляции или РСТ. В отличие от одноили двухкамерных кардиостимуляторов, которые имеют только один или два электрода (предсердный и/или правожелудочковый электрод), трехкамерные устройства имеют дополнительный электрод для стимуляции ЛЖ, наиболее часто расположенный внутри одной из вышележащих вен сердца, доступ к которым осуществляется через коронарный синус. В то время как стимуляция ПЖ может приводить к внутрижелудочковой диссинхронии, имитируя картину проведения, обусловленную БЛНПГ, бивентрикулярная стимуляция может сохранить синхронную активацию и сокращение обоих желудочков, улучшая сердечную гемодинамику. Примеры ЭКГ во время одно- и

двухкамерной стимуляции приведены на рис. 27.6 и 27.7 соответственно. На рис. 27.8 показаны ЭКГ-особенности при РСТ.
Рис. 27.6. ЭКГ при однокамерной стимуляции желудочков.

Рис. 27.7. ЭКГ при двухкамерной стимуляции. А - ЭКГ с одновременной регистрацией действий кардиостимулятора, демонстрирующая сенсинг в предсердиях синусового ритма (AS) и синхронизированную стимуляцию желудочков (VP). Б - ЭКГ, демонстрирующая синхронизированную стимуляцию предсердий и желудочков.
Рис. 27.8. Особенности ЭКГ при ресинхронизирующей терапии (CRT), демонстрирующие укорочение длительности комплекса QRS.
ТЕХНИКА ИМПЛАНТАЦИИ
Большинство кардиостимуляторов имплантируют под местной анестезией и всегда в строго асептических условиях. В начале процедуры необходимо тщательное очищение хирургического поля, как и дооперационная дезинфекция рук хирурга путем повторной обработки рук подходящим антисептиком. Как правило, используют периоперативную системную антибиотикопрофилактику, которая может снизить число серьезных инфекционных осложнений [86]. У пациентов с протезированными клапанами сердца или клапанными пороками сердца обязательно профилактическое применение антибиотиков (подробности см. в главе 22). Кардиостимулятор помещают в подкожный карман, который формируют в передней верхней части грудной стенки над большой грудной мышцей. У пациентов без выраженного развития жировой ткани, окружающей большую грудную мышцу, для имплантации стимулятора могут использовать область, расположенную под грудной мышцей [87]. Электроды кардиостимулятора имплантируют трансвенозно с использованием либо выделения головной вены с венесекцией или слепой пункции подключичной вены, если размер головной вены недостаточен для размещения всех электродов стимулятора. Метод слепой пункции подключичной вены потенциально более рискованный, чем венесекция головной вены [88]. При данной процедуре требуется первоначальное введение гибкого проводника, вслед за которым вводят интродюсер. Затем используют специальные канюли для введения электродов стимулятора. Подключичный доступ позволяет легко имплантировать два электрода и уменьшает длительность процедуры имплантации. Однако если электроды стимулятора вводят путем срединной подключичной пункции, существует вероятность компрессионного повреждения вследствие малого реберноключичного угла. Другими возможными осложнениями слепой пункции подключичной вены могут быть пневмоторакс или гемоторакс (‹2% имплантаций), воздушные эмболии, подкожная эмфизема, повреждение грудного протока и повреждение нервов [89, 90].
Tаблица 27.2. Код кардиостимуляторов NBG (Североамериканского общества стимуляции и электрофизиологии, Британской группы стимуляции и электрофизиологии и Generic)
I: стимулируемая (- |
II: воспринимающая (- |
III: ответ на |
IV: |
V: мультисайтная |
ые) камера (-ы) |
ие) камера (-ы) |
восприятие |
модуляция |
стимуляция |
|
|
|
частоты |
|
|
|
|
|
|
O, нет |
O, нет |
O, нет |
O, нет |
O, нет |
|
|
|
|
|
A, предсердие |
A, предсердие |
T, запускает |
R, модуляция |
A, предсердие |
|
|
стимуляцию |
частоты |
|
|
|
|
|
|
V, желудочек |
V, желудочек |
I, подавляет |
- |
V, желудочек |
|
|
стимуляцию |
|
|
|
|
|
|
|
D, обе камеры (A и |
D, обе камеры (A и V) |
D, обе |
- |
D, обе камеры (A и |
V) |
|
функции (T и I) |
|
V) |
|
|
|
|
|
S*, однокамерный (A |
S*, однокамерный (A |
- |
- |
- |
или V) |
или V) |
|
|
|
|
|
|
|
|
Примечание: * - используется только производителями и означает, что устройство может быть использовано в предсердии или в желудочке.
Другой способ трансвенозного введения электрода кардиостимулятора - подмышечный: доступ в подмышечную вену выполняют у медиального края малой грудной мышцы. Поскольку подмышечная вена расположена вне грудной клетки, то отсутствует риск пневмоторакса или гемопневмоторакса. В некоторых случаях, когда трансвенозный доступ к ПЖ невозможен (например, из-за врожденной аномалии или при наличии протеза трикуспидального клапана), можно использовать эпикардиальные электроды.
После имплантации электродов кардиостимулятора необходимо проведение некоторых внутриоперационных измерений. Наиболее важным считают определение порога предсердной и желудочковой стимуляции и измерение сопротивления электрода, а также амплитуд электрограмм предсердий и желудочков. Кроме того, следует использовать стимуляцию с высоким напряжением
(10 V) для оценки возможной стимуляции диафрагмы от предсердных и желудочковых электродов. Важно измерять АД с целью диагностики развития синдрома кардиостимулятора.
Для подтверждения правильного расположения стимуляционных электродов и исключения пневмоторакса после имплантации кардиостимулятора обязательно выполняют рентгенографию грудной клетки в прямой и боковой проекциях в вертикальном положении (рис. 27.9). Перед выпиской из стационара необходимо выполнить регистрацию ЭКГ в 12 отведениях и полное тестирование кардиостимулятора для подтверждения адекватной стимуляции и восприятия в предсердиях и желудочках.
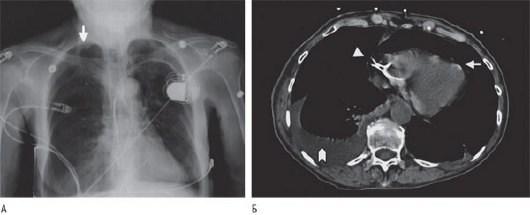
Рис. 27.9. А - рентгенограмма грудной клетки, демонстрирующая правосторонний пневмоторакс (стрелка) через 8 ч после установки левостороннего постоянного двухкамерного кардиостимулятора по поводу брадикардии с выраженными клиническими проявлениями. Б - срез грудной клетки, полученный при КТ, демонстрирующий выбухание спирали предсердного электрода через ушко ПП (стрелка-указатель), ставшее причиной пневмоперикарда (стрелка). Также наблюдается плевральный выпот справа. Источник (с
разрешения): Srivathsan K., Byrne R.A., Appleton C.P. et al. Pneumopericardium and pneumothorax contralateral to venous access site after permanent pacemaker implantation //
Europace. - 2003. - Vol. 5. - P. 361-363.
ПОКАЗАНИЯ К ИМПЛАНТАЦИИ КАРДИОСТИМУЛЯТОРА
Хотя временные и наружные стимуляторы могут использоваться временно для начальной стабилизации состояния при обратимых или потенциально обратимых эпизодах брадикардии, терапевтической задачей считают выявление пациентов, которым имплантация постоянного кардиостимулятора принесет пользу. Показания к постоянной стимуляции подробно рассматриваются в руководствах по кардиостимуляции и РСТ, опубликованных рабочей группой Европейского общества кардиологов (ESC) и разработанных в сотрудничестве с Европейской ассоциацией ритма сердца [53] (табл. 27.3-27.5). Подобные рекомендации также были опубликованы объединенной рабочей группой Американского кардиологического колледжа
(American College of Cardiology, ACC) и Американской ассоциации кардиологов (American Heart
Association, AHA) [91].
Таблица 27.3. Рекомендации по кардиостимуляции при синдроме слабости синусового узла согласно методическим рекомендациям Европейского общества кардиологов по кардиостимуляции и сердечной ресинхронизирующей терапии [53]
Класс |
Клиническое показание |
Уровень |
|
|
доказательности |
|
|
|
I |
СССУ проявляется клинически выраженной брадикардией с |
C |
|
брадизависимой тахикардией или без нее. Связь симптомов и ритма |
|
|
должна быть возникающей спонтанно либо вызывающейся ЛС, если |
|
|
альтернативная медикаментозная терапия отсутствует. |
|
|
Обмороки при СССУ, возникающие либо спонтанно, либо во время |
|
|
ЭФИ. |
|
|
СССУ проявляется клинически выраженной хронотропной |
|
|
|
|
|
недостаточностью: |
|
|
возникающей спонтанно; |
|
|
вызывающейся медикаментозными препаратами, если |
|
|
альтернативная медикаментозная терапия отсутствует |
|
|
|
|
IIa |
СССУ, протекающий с симптоматикой, возникающей спонтанно или на |
C |
|
фоне медикаментозного влияния при отсутствии альтернативной |
|
|
медикаментозной терапии, но связь ритма и симптоматики не |
|
|
документирована. Частота ритма в покое должна быть ‹40 уд/мин. |
|
|
Обмороки, которым нет другого объяснения, но имеются |
|
|
отклоняющиеся от нормы электрофизиологические данные |
|
|
(корригированное время восстановления функции синусового узла |
|
|
>800 мс) |
|
|
|
|
IIb |
Пациенты с минимальной симптоматикой СССУ, с частотой ритма в |
C |
|
покое ‹40 уд/мин в состоянии бодрствования и при отсутствии |
|
|
доказательств хронотропной недостаточности |
|
|
|
|
III |
СССУ без симптоматики, включая применение препаратов, |
C |
|
вызывающих брадикардию. |
|
|
ЭКГ-признаки дисфункции синусового узла с симптоматикой, не |
|
|
обусловленных напрямую или косвенно брадикардией. |
|
|
Дисфункция синусового узла с симптоматикой, когда симптомы можно |
|
|
с большой долей вероятности объяснить препаратами, применение |
|
|
которых не является важным |
|
|
|
|
Примечание. Когда установлено заболевание синусового узла, предсердные тахиаритмии также могут диагностироваться с достаточной частотой, если уже к этому времени не выявлены. Следовательно, должна быть рассмотрена возможность проведения антикоагулянтной терапии.
Источник (с разрешения): Vardas P.E., Auricchio A., Blanc J.J. et al. Guidelines for cardiac pacing and cardiac resynchronization therapy: The Task Force for Cardiac Pacing and Cardiac Resynchronization Therapy of the European Society of Cardiology. Developed in Collaboration with the European Heart Rhythm Association // Eur. Heart J. - 2007. - Vol. 28. - P. 2256-2295.
Таблица 27.4. Рекомендации по кардиостимуляции при приобретенной атриовентрикулярной блокаде согласно методическим рекомендациям Европейского общества кардиологов по кардиостимуляции и сердечной ресинхронизирующей терапии [53]
Класс |
Клиническое показание |
Уровень |
|
|
доказательности |
|
|
|
I |
Хроническая АВ-блокада третьей или второй (Мобитц I или II) |
C |
|
степени с симптоматикой. |
|
|
Нейромышечные заболевания (например, миотоническая мышечная |
|
|
дистрофия, синдром Кернса-Сэйра и т.д.) с АВ-блокадой третьей или |
|
|
второй (Мобитц I или II) степени.; |
|
|
|
|
|
АВ-блокада третьей или второй (Мобитц I или II) степени: |
B |
|
||
|
после катетерной аблации АВ-соединения |
|
|
|
|
|
|
|
|
после хирургического вмешательства на клапанах, если не |
C |
|
||
|
ожидается, что блокада разрешится |
|
|
|
|
IIa |
Бессимптомная АВ-блокада третьей или второй (Мобитц I или II) |
C |
|
степени. |
C |
|
|
|
|
|
|
