
5 курс / Акушерство и гинекология / Учебник. Акушерство
.pdf452 |
Chapter 15. Нemolytic disease of fetus and newborn |
ния за изменениями в состоянии плода, за нарастанием или исчезновением признаков ГБП.
УЗ-маркеры ГБП. К УЗ-маркерам ГБП относят:
•утолщение плаценты более 50 мм при умеренной или тяжелой форме ГБП, структура плаценты — гомогенная;
•многоводие (индекс амниотической жидкости >24) при легкой и умеренной форме ГБП нехарактерно, сочетание многоводия и водянки свидетельствует о неблагоприятном прогнозе;
•гидроперикард — один из самых ранних признаков ГБП;
•увеличение размеров сердца сопутствует нарастанию сердечной недостаточности при тяжелой форме ГБП, при отношении диаметра сердца к диаметру грудной клетки больше 0,5 правомочен диагноз кардиомегалии;
•выявление асцита свидетельствует о наличии выраженной степени ГБП;
•гепатоспленомегалия, развивающаяся вследствие усиленного экстрамедуллярного эритропоэза;
•отек подкожной жировой клетчатки, особенно выраженный на головке плода.
Впоследние годы предложено при допплерометрии оценивать скорость кровотока в средней мозговой артерии плода (повышение максимальной скорости — признак анемии) (рис. 15.3).
Кордоцентез. Еще более точную информацию о состоянии плода может дать непосредственное исследование фетальной крови, полученной при кордоцентезе. Это позволяет, в частности, определить Rh-принадлежность крови плода (если плод оказывается Rh(–), дальнейшее комплексное исследование не требуется), уровень гемоглобина, гематокрит, рутикулоцитоз, количество билирубина и белка сыворотки крови плода, т.е. основные диагностические показатели степени гемолиза.
Особенности ведения беременности при ГБП. Беременной с неосложненным акушерским анамнезом и титром антител >1:16, выявленным до 26-й недели беременности, показан амниоцентез с последующей спектрофотометрией.
•Если ΔOD450 соответствует I зоне по Liley, это свидетельствует о том, что плод Rh(–) или имеется слабая степень ГБП.
•Уровень ΔOD450, соответствующий середине II зоны по Liley, указывает на вероятность средней или тяжелой формы ГБП. В этой ситуации обычно показано досрочное родоразрешение.
•При ΔOD450, соответствующей III зоне, или при выявлении водянки плода при УЗИ требуются экстренное родоразрешение или внутриматочная гемотрансфузия плоду. План ведения зависит от срока беременности, состояния плода и уровня неонатальной службы в данном учреждении.
Пациентке с отягощенным акушерским анамнезом или с титром антител >1:16 при сроке беременности до 26 нед требуется УЗИ. Для решения вопроса о дальнейшем ведении беременности показана консультация перинатолога или перинатальный консилиум. При выявлении тяжелого поражения плода показан кордоцентез для определения гематокрита и Rh-генотипирования плода, особенно если отец гетерозиготен по данному антигену.


454 |
Chapter 15. Нemolytic disease of fetus and newborn |
15.6.1. Классификация Classification
Классификация ГБН предусматривает установление:
•вида конфликта (Rh, АВ0, другие эритроцитарные антигены);
•клинической формы (отечная, желтушная, анемическая);
•степеней тяжести при желтушной и анемической формах (легкая, средней тяжести и тяжелая);
•осложнений:
–билирубиновая энцефалопатия — ядерная желтуха, другие неврологические расстройства;
–геморрагический или отечный синдром;
–поражение печени, сердца, почек, надпочечников;
–синдром сгущения желчи;
–обменные нарушения — гипогликемия и др.;
•сопутствующих заболеваний и фоновых состояний (недоношенность, ВУИ, асфиксия и др.).
NB! Разделение ГБН по клиническим формам на отечную, желтушную и анемическую условно. На самом деле при ГБН во всех случаях имеется анемия как первичный фактор. Затем, уже как следствие массивного разрушения эритроцитов, сразу после родов начинает нарастать билирубинемия.
Оценка степени тяжести ГБН представлена в табл. 15.2.
Таблица 15.2. Критерии степени тяжести гемолитической болезни новорожденных
Основные клинические |
Степень тяжести ГБН, баллы* |
|||
признаки |
1 |
2 |
3 |
|
Анемия (Hb,г/л) |
>150 |
149–100 |
<100 |
|
Желтуха (билирубинемия, |
<85,6 |
85,6–136,8 |
>136,8 |
|
мкмоль/л) |
||||
|
|
|
||
Отечный синдром |
Пастозность подкож- |
Пастозность |
Анасарка |
|
|
ной клетчатки |
и асцит |
|
|
*1–3 балла — легкая форма; 4–6 баллов — средняя форма; 7–9 баллов — тяжелая форма.
15.6.2. Диагностика Diagnostics
План обследования при подозрении на ГБН включает:
•определение группы крови и Rh-принадлежности матери и ребенка;
•анализ периферической крови ребенка с подсчетом количества ретикулоцитов;
•динамическое определение концентрации билирубина в сыворотке крови ребенка;
•иммунологические исследования (определение титра антител путем постановки прямой реакции Кумбса).

Глава 15. Гемолитическая болезнь плода и новорожденного |
455 |
При оценке уровня гемоглобина следует знать, что при рождении у здорового доношенного ребенка отмечается относительная полицитемия с уровнем гемоглобина 170±20 г/л. Это связано с особенностями внутриутробного кровообращения, но является избыточным для внеутробного существования. По обратной связи снижается функция костного мозга, количество ретикулоцитов уменьшается. По мере разрушения эритроцитов в процессе естественного старения (30–40 дней) содержание гемоглобина к 8–10 нед жизни составляет в норме приблизительно 120 г/л. Это снижение более выражено и наступает раньше у недоношенных детей. При низком уровне гемоглобина начинается усиленный ретикулоцитоз, который обычно приводит к восстановлению нормального содержания гемоглобина. Уровень гемоглобина, при котором следует начинать активное лечение анемии, зависит от возраста новорожденного. В первую неделю жизни желательно, чтобы содержание гемоглобина превышало 130 г/л. Затем вполне приемлемо снижение на 1 г в неделю до 80 г/л. При уровне ниже 70–80 г/л следует в зависимости от клинического состояния решать вопрос о переливании крови.
При ГБН уровень гемоглобина уже в первые сутки жизни может соответствовать 130 г/л и ниже, поэтому не следует ждать снижения гемоглобина до 80 г/л и соответствующие действия предпринимают гораздо раньше (см. табл. 15.2).
NB! При рождении у здорового доношенного ребенка отмечается относительная полицитемия с уровнем гемоглобина 170±20 г/л. При ГБН уровень гемоглобина уже в первые сутки жизни может соответствовать 130 г/л и ниже.
Содержание билирубина в сыворотке крови здорового новорожденного близко к его уровню у матери. К 4-му дню жизни оно повышается до 140 мкмоль/л, к 10-му дню постепенно уменьшается, составляя менее 25 мкмоль/л. Подъем и последующее снижение уровня билирубина проявляются физиологической желтухой. Существует метод клинической оценки степени желтухи по Крамеру (рис. 15.4).
NB! Желтуха становится видимой при уровне билирубина, превышающем 140 мкмоль/л. Для нормального доношенного ребенка подъем содержания билирубина в сыворотке крови выше 205 мкмоль/л в первые 48 ч жизни считают патологическим.
При уровне непрямого билирубина 428–496 мкмоль/л у 30% доношенных детей развивается ядерная желтуха, а при уровне 518–684 мкмоль/л — у 70%.
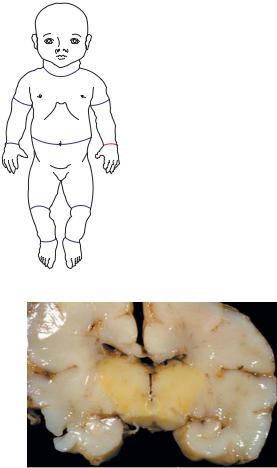
По предложению Г. Шморля (1904), термином «ядерная желтуха» (нем. — kernicterus) принято обозначать билирубиновую энцефалопатию, при которой имеет место повреждение ядер основания мозга непрямым билирубином. На вскрытии у таких детей отмечают прокрашивание базальных ганглиев в ярко-оранжевый цвет (рис. 15.5).
456 |
Chapter 15. Нemolytic disease of fetus and newborn |
100
Желтуха ограничена шеей – 100 мкмоль/л
150Желтуха доходит до пупка и захватывает верхнюю треть
плеча – 150 мкмоль/л
250 |
250 |
Желтуха захватывает область |
|
|
|
200 |
|
от пупка до колен – 200 мкмоль/л |
|
|
|
>270 |
>270 |
Желтуха захватывает руки и ноги |
до запястья |
||
|
|
и щиколотки – 250 мкмоль/л |
250 250 |
|
Желтуха от макушки до кончиков |
|
|
пальцев рук |
>270 |
>270 |
и ног – более 250 мкмоль/л |
Рис. 15.4. Система визуальной оценки степени желтухи по Крамеру (Kramer, 1969)
Рис. 15.5. Прокрашивание подкорковых ядер при ядерной желтухе (нем. — kernicterus). Макропрепарат
Даже при выраженном Rh-конфликте (ГБП) плод рождается с нормальным или несколько повышенным уровнем билирубина в крови. Однако при ГБН нарастание билирубинемии может быть таким быстрым, что правильным будет не ежедневное определение уровня билирубина, а слежение за почасовым приростом. На основании данных почасового прироста активные действия могут быть предприняты даже при значениях, не достигших критического уровня, что хорошо видно на графике, предложенном в свое время чешским исследователем К. Полачеком (рис. 15.6).
План лабораторного исследования ребенка включает также регулярное определение уровня гликемии (не менее 4 раз в сутки в первые 3–4 дня жизни), количества тромбоцитов, активности трансаминаз (хотя бы однократно) и другие исследования в зависимости от особенностей клинической картины.

Глава 15. Гемолитическая болезнь плода и новорожденного |
457 |
Рис. 15.6. Допустимая концентрация билирубина в крови новорожденных (Polacek K., |
|
1961). ЗПК — заменное переливание крови |
|
15.6.3.Лечение Treatment
NB! При ГБН все мероприятия нацелены на решение трех главных задач:
лечение анемии;
выведение неконъюгированного билирубина;
удаление анти-Rh-антител.
Для этого в арсенале у неонатолога имеются следующие средства:
•фототерапия;
•инфузионная терапия;
•адсорбенты непрямого билирубина в кишечнике;
•фенобарбитал;
•заменное переливание крови.
Внастоящее время фототерапия (phototherapy) — наиболее широко используемый метод лечения ГБН. С момента предложения фототерапии для лечения ГБН в 1958 г. Р.Дж. Кремером и соавт. установлено, что это практически совершенно безопасный и эффективный метод лечения.
Обычно фототерапию начинают при величинах непрямого билирубина
всыворотке крови на 85–110 мкмоль/л меньше тех, при которых делают заменное переливание крови. Доношенным новорожденным фототерапию начинают при уровне непрямого билирубина в крови 205 мкмоль/л и более, а недоношенным — при уровне 171 мкмоль/л и более.
Положительный эффект фототерапии заключается в увеличении экскреции билирубина из организма со стулом и мочой, уменьшении токсичности

458 |
Chapter 15. Нemolytic disease of fetus and newborn |
непрямого билирубина и риска ядерной желтухи. Чем больше площадь и интенсивность излучения, тем эффективнее фототерапия. Длительность фототерапии — 72–96 ч, но она может быть и меньшей, если уровень непрямого билирубина достиг физиологических для ребенка соответствующего возраста величин (рис. 15.7).
Рис. 15.7. Фототерапия «синим» светом
Эффективность фототерапии повышается при сочетании с инфузионной терапией, поскольку стимуляция диуреза ускоряет выведение водорастворимых фотодериватов и фотоизомеров билирубина. Применяют 5% раствор декстрозы (Глюкозы♠) и солевые растворы. Добавление растворов Альбумина♠ показано лишь при доказанной гипопротеинемии.
В меконии новорожденного содержится 100–200 мг билирубина, тогда как в крови при рождении — всего 10–15 мг. Считают, что очистительная клизма в первые 2 ч жизни или свеча с глицерином, поставленные в это время, приведшие к раннему отхождению мекония, достоверно уменьшают выраженность максимального подъема уровня непрямого билирубина крови. Эти мероприятия следует проводить всем детям с желтухой при рождении. Однако после 12 ч жизни такое лечение эффекта не имеет.
Фенобарбитал, назначенный после рождения, способствует активации образования билирубиндиглюкуронида и улучшению оттока желчи, а значит, и уменьшению интенсивности желтухи. Однако этот эффект отчетлив лишь с 4–5-го дня терапии.
Ни один из консервативных методов лечения, включая и фототерапию, не может полностью ликвидировать необходимость заменного переливания крови при очень высоких уровнях неконъюгированного билирубина.
Показания к заменному переливанию крови (exchange blood transfusion) — величины гипербилирубинемии, представленные на рис. 15.6 и в табл. 15.3. Применяя заменное переливание крови, неонатолог одновременно решает и две другие основные задачи, т.е. добивается повышения уровня гемоглобина и снижает титр циркулирующих антител (период полураспада Rh-антител составляет 28 дней).

460 |
Chapter 15. Нemolytic disease of fetus and newborn |
Биопсия ворсин хориона может стать причиной материнско-плодового кровотечения; показано назначение 50 мкг анти-Rh-Ig.
Амниоцентез также может стать причиной Rh-сенсибилизации. У Rh(–)- несенсибилизированных беременных применяют стандартную дозу анти- Rh-Ig (300 мкг), если перед этим анти-Rh-профилактика не проводилась. Однако это не исключает необходимость послеродовой профилактики.
При кордоцентезе у Rh(–)-несенсибилизированной беременной следует определить Rh-принадлежность плода. Если плод Rh(+) или определить Rh-принадлежность не удалось, матери вводят 300 мкг анти-Rh-Ig.
При маточном кровотечении у Rh(–)-несенсибилизированной беременной необходимо введение анти-Rh-Ig. Для определения величины плодово-материнского кровотечения проводят пробу Клейхауэра–Бетке. Если в кровяное русло матери попало более 15 мл фетальных эритроцитов, помимо стандартной дозы (300 мкг) требуется введение дополнительного количества анти-Rh-Ig. Показана непрямая реакция Кумбса у беременной спустя 72 ч после введения иммуноглобулина для выявления свободных Rh-антител.
Анти-D-профилактика (согласно рекомендациям Британского общества трансфузии крови, 2014)
•Профилактика анти-D-иммуноглобулином должна проводиться женщинам анти-D-негативным, с отсутствием анти-D-антител и подписавшим информированное согласие на введение анти-D-иммуноглобулина.
•В сроке беременности менее 12 нед (при кровотечении, выскабливании полости матки, хирургическом или медикаментозном аборте и внематочной беременности) вводят 250 МЕ анти-D-иммуноглобулина в течение 72 ч.
•В сроке беременности 12–20 нед при потенциально сенсибилизирующих событиях вводят 250 МЕ анти-D-иммуноглобулина в течение 72 ч.
•В сроке беременности от 20 нед и до доношенного срока при потенциально сенсибилизирующих событиях нужно провести пробу Клейхауэра (FMH Test) и введение 500 МЕ анти-D-иммуноглобулина в течение 72 ч после родов. Для рутинной антенатальной анти-D-профилактики (независимо от введения анти-D-иммуноглобулина при потенциально сенсибилизирующих событиях) вводят 1500 МЕ анти-D-иммуноглобулина
всроке 28–30 нед или 500 МЕ в сроке 28 нед и 500 МЕ в сроке 34 нед беременности.
•После родов требуется провестии пробу Клейхауэра (FMH Test). Если плод RhD-положительный или образцы пуповинной крови недоступны,
втечение 72 ч вводят 500 МЕ анти-D-иммуноглобулина. В случае если проба Клейхауэра показала необходимость дальнейшей профилактики, необходимо дополнительное введение анти-D-иммуноглобулина.
Самая частая значимая причина Rh-изоиммунизации — сами роды. При рождении Rh(+)-плода у Rh(–)-несенсибилизированной женщины требуется назначение анти-Rh-иммуноглобулина. В табл. 15.4 приведены сводные данные о вероятности сенсибилизации при различных возможных ситуациях.

Глава 15. Гемолитическая болезнь плода и новорожденного |
461 |
Таблица 15.4. Оценка анамнестических факторов риска резус-иммунизации, % |
|
|
|
Факторы риска иммунизации |
Риск иммунизации |
Самопроизвольный аборт |
3–4 |
Искусственный аборт |
2–5 |
Внематочная беременность |
<1 |
Беременность доношенного срока до родоразрешения |
1–2 |
Роды (при совместимости по AB0-системе) |
16 |
Роды (при AB0-несовместимости) |
2–3,5 |
Амниоцентез |
1–3 |
Переливание Rh-положительной крови |
До 70 |
При гемотрансфузиях следует всегда проверять донорскую кровь на Rh-принадлежность. Rh-антиген встречается только на мембране эритроцитов, поэтому теоретически переливание плазмы не может вызывать Rh-иммунизацию. Однако тромбоциты и гранулоциты теоретически могут содержать примесь эритроцитов. Если по ошибке введен Rh-антиген, следует помнить, что для блокирования 1 мл Rh(+)-эритромассы требуется 20 мкг анти-Rh-Ig.
Анти-Rho(D)-Ig производят из плазмы сенсибилизированных доноров, у которых титр антител не ниже 1:128–256. Необходимое количество препарата обеспечивается благодаря сенсибилизированным по Rho(D)-фактору беременным, а также лицам, по ошибке получившим при гемотрансфузии несовместимую по Rho(D)-фактору кровь, а в последнее время — благодаря Rho(D)-отрицательным донорам-добровольцам (мужчины и женщины, завершившие репродуктивную функцию).
Благодаря широкому применению анти-Rh(D)-профилактики, частота Rh(D)-сенсибилизации значительно снизилась по сравнению с недалеким прошлым. Сегодня на первое место в роли этиологического фактора изоиммунизации и ГБН вышли другие эритроцитарные антигены.
В системе CDE (Rh)-антигенов антиген-Е занимает после антигена-D первое место по способности вызывать ГБП. Антитела к Kell-антигену образуются в ответ на трансфузию Kell(–)-пациентке Kell(+)-крови. Антитела-Kell могут быть причиной выраженной ГБП. Около 90% населения планеты — Kell(–), поэтому вероятность ГБП невысока. К более редким антигенам, способным вызвать изоиммунизацию и ГБП, относят антигены Duffy, Kidd, MNSs, Lutheran, Diego, Xg, Public и Private. Атипичные антитела обнаруживают приблизительно у 2% женщин при скрининговом исследовании. Только незначительная часть из этих антител может стать причиной ГБП.
NB! Чаще всего несовместимость матери и плода бывает по AB0-системе. Однако АВ0-несовместимость, в отличие от Rh-несовместимости, — почти исключительно проблема не для плода, а для новорожденного, хотя имеются крайне редкие сообщения о водянке плода при АВ0-несовместимости.
