
- •4 Пространственная изомерия, конфигурация и конформация.
- •5. Ассимметрический атом углерода как центр хиральности. Стереоизомерия молекул с одним центром хиральности. Оптическая активность.
- •7. Электронное строение атома углерода. Типы гибридизаций атомных орбиталей.
- •8. Сопряженные системы с открытой и замкнутой цепью на примерах бутадиента 1,3 и бензола.
- •9. Ароматичность. Критерии ароматичности.
- •10. Электронные эффекты заместителей: индуктивный и мезомерный. Электродонорные и электроакцепторные заместители и их влияние на реакционную способность соединений.
- •11. Гомо/гетеролитические разрывы ковалентной связы в органических соединениях, образующиеся при этом частицы.
- •12. Радикальные, электрофильные, нуклеофильные реагенты, классификация хим реакций по типу реагента.
- •13. Классификация хим реакций по результату: замещенеие, присоединение, элиминирование, перегруппировка, овр
- •14. Кислоты и основания по бренстеду, их классификация.
- •15. Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16. Спирты и фенолы. Многоатомные спирты.
- •17. Химические свойства спиртов и фенолов.
- •19. Классификации карбоновых кислот по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
- •21. Высшие жирные карбоновые кислоты: классификация, номенклатура, структура, физические свойства.
- •22.Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме. Соли щавелевой кислоты - оксалаты.
- •23. Оксо- гидроксикарбоновые кислоты: пировиноградная и молочная, яблочная и щавелевая, лимонная, ацетоуксусная и β-гидроксимасляная, α-кетоглутаровая, функции в организме.
- •24. Общее представление о липидах, классификация липидов.
- •25. Простые липиды: таг, состав, номенклатура, свойства, гидролиз таг, биологическая роль.
- •27. Соединения стеройдной группы: холестерин, желчные кислоты, представление о химическом строении и биологической роли.
- •28. Углеводы, классификация углеводов, функции углеводов в организме.
- •29. Классификация и химические свойства моносахаридов, (см выше) овр моносахаридов.
- •30. Стереоизомерия моносахаридов d- и l- ряды, открытые и циклические формулы (фишера, колли-толленса, хеуорса), пиранозы и фуранозы, α и β аномеры, циклоцепная таутомерия, явление мутаротации.
- •33. Классификация полисахаридов, функции в организме.
- •34. Дисахариды, структура и свойства основных биологически важных дисахаридов: мальтозы, лактозы, сахарозы, целлобиозы.
- •35. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза, строение, свойства, биологическая роль.
- •36. Гетерополисахариды, гиалуроновая кислота, хондроитинсульфаты, строение, биологическая роль.
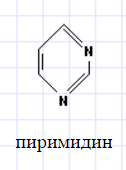
- •37. Азотистые основания пиримидиновые (тимин, урацил, цитозин) и пуриновые (аденин, гуанин), строение, лактим-лактамная таутомерия.
- •38. Нуклеозиды, строение, номенклатура, гидролиз, характер связи нуклеинового основания с углеводным остатком.
- •39. Нуклеотиды, строение, номенклатура, гидролиз, характер связей между компонентами нуклеотида.
- •40. Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над, строение, функции в организме.
- •41. Первичная структура нуклеиновых кислот, нуклеотидный состав днк/рнк.
- •42. Понятие о вторичной структуре днк. Комплементарность азотистых оснований, водородные связи в комплементарных парах.
- •43. Аминокислоты, номенклатура, классификация по полярности радикала и пищевой ценности, примеры.
- •44. Стереоизомерия аминокислот.
- •45. Кислотно-основные свойства аминокислот. Биполярные ионы, изоэлектрическая точка.
- •46. Химические свойства аминокислот, биологически важные свойства аминокислот.
- •47. Физиологически активные пептиды, примеры.
- •48. Уровни организации белковой молекулы: первичная структура белка, электронное строение пептидной связи и ее характеристика, зависимость свойств белка от первичной структуры.
- •49. Вторичная структура белков, α-спираль, β-складчатый слой, беспорядочный клубок, связи, стабилизирующие вторичную структуру белка.
- •50. Третичная и четвертичная структуры белков, связи, их стабилизирующие, особенности строения и функционирования олигомерных белков на примере гемоглобина.
- •51. Классификации белков.
- •52. Физико-химические свойства белков, растворимость, ионизация, гидратация, денатурация, ренатурация.
- •56. Классификация сложных белков.
- •57. Гемопротеины, сравнительная характеристика структур и функций миоглобина и гемоглобина.
- •53. Кооперативное связывание кислорода гемоглобином, эффект бора, влияние 2,3-бфг на сродство гемоглобина к кислороду. Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
1 КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПО ЧИСЛУ И ТИПУ ФУНКЦИОНАЛЬНЫХ ГРУПП
БИОЛОГИЧЕСКИ ВАЖНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, ПРИМЕРЫ.
Название класса соединений: |
Функциональная группа или наличие кратной связи: |
Пример соединения: |
Название соединения: |
Алканы, СпН2п+2 |
Все связи С-С одинарные |
СН3-СН3 |
Этан |
Алкены, СпН2п |
Одны двойная связь С=С |
СН2=СН2 |
Этен (этилен) |
Алкины, СпН2п-2 |
Одны тройная связь С≡С |
СН≡СН |
Этин (ацетилен) |
Алкадиены, СпН2п-2 |
Две двойные связи |
СН2=СН-СН=СН2 |
Бутадиен-1,3 |
Спирты |
-ОН гидроксильная |
СН3-СН2-ОН |
Этанол |
Простые эфиры |
-О- оксигруппа |
СН3-СН2-О-СН2-СН3 |
Диэтиловый эфир, этоксиэтан |
Альдегиды |
-СОН карбонильная |
СН3-СОН |
Уксусный альдегид, этаналь |
Кетоны |
-(С=О)- |
СН3-(С=О)-СН3 |
Ацетон, пропанон |
Карбоновые кислоты |
-СООН карбоксильная |
СН3-СООН |
Уксусная кислота, этановая кислота |
Сложные эфиры
|
-(С=О)-О- |
СН3-(С=О)-О-СН3 |
Метиловый эфир уксусной кислоты, метилацетат
|
Аминокислоты — биологически важные соединения. Аминокислоты образуются при гидролизе белков.
2. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПО РАДИКАЛУ, НОМЕНКЛАТУРА.
Органические вещества:
1. Ациклические: алканы (предельные), алкены и алкины (непредельные)
2. Гетероциклические:
 3.
Карбоциклические
3.
Карбоциклические
По радикалу 2
По строению углеродного скелета органические соединения делятся на: а) ациклические (алифатические), в которых цепь атомов углерода может быть неразветвленной и разветвленной: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
CH3
б) карбоциклические соединения, в составе циклов которых только атомы углерода
В) гетероциклические соединения, которые кроме атомов углерода в циклическом скелете содержат один или несколько гетероатомов (лат. гетерос – иной, другой): азот, кислород, серу
3 ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, СТРУКТУРНАЯ ИЗОМЕРИЯ, ЕЕ ВИДЫ
4 Пространственная изомерия, конфигурация и конформация.
Изомеры – соединения с одинаковым составом, но отличающиеся природой или последовательностью связей между атомами и расположением их в пространстве.
Структурные изомеры отличаются по химическому строению – бутан/изобутан(2 метил пропан), пентен 1/циклопентан.
Структурные изомеры:
*Цепи (бутан/изобутан)
*Положения кратных связей (бутен1/бутен2)
*Положения ф-циональных групп (пропанол1/пропанол2)
*Изомеры ф-циональных групп (пропаналь/пропанон(ацетон)
Конфигурация – определенное пространственное расположение атомов в молекуле. Например, метан имеет форму тетраэдра.
Конформация (от лат. conformatio — форма, построение, расположение) молекул, геометрические формы, которые могут принимать молекулы органических соединений при вращении атомов или групп атомов (заместителей) вокруг простых связей при сохранении неизменными порядка химической связи атомов (химического строения), длины связей и валентных углов. Молекулы, отличающиеся только своими конформациями, называются конформерами, или поворотными изомерами. Существование конформации обусловлено пространственным взаимодействием (например, отталкиванием, притяжением, образованием водородных связей) не связанных между собой заместителей, в т. ч. и атомов водорода. Примером могут служить несколько плоских конформации молекул пентана: CH3—CH2—CH2—CH2—CH3
Стереоизомерия
Стереоизомерами называются изомеры, различающиеся только расположением атомов и групп атомов в пространстве, отличия обусловены различной конфигурацией/конформацией молекул.
Конфигурационные изомеры – стереоизомеры с различным пространственным расположением атомов или групп атомов в пространстве без учета возможных конформаций.
Конформационные изомеры – стереоизомеры, различие между которыми вызвано поворотом отдельных участков молекулы вокруг одинарных связей.
Хиральность - свойство молекулы не совмещаться в пространстве со своим зеркальным отражением.
Энантиомеры – стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение, имеют одинаковые физ/хим свойства.
Диастереомеры – стереоизмеры, не являющиеся зеркальным изображением один другого и имеющие различные физ/хим свойства.
5. Ассимметрический атом углерода как центр хиральности. Стереоизомерия молекул с одним центром хиральности. Оптическая активность.
Хиральный центр -это атом в молекуле, замещенный таким образом, что он становится несовместимым со своим зеркальным отражением. Атом углерода является центром хиральности только в том случае, когда имеет четыре различных заместителя.
Энантиомеры способны вращать плоскость поляризации света, т.е. обладают оптической активностью
Типичным примером пары энантиомеров с 1 центром хиральности является 2-гидроксипропановая кислота – CH3-*CHOH-COOH. В молекуле этого соединения содержится 1 асимметрический атом углерода.
6. ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА. АБСОЛЮТНАЯ КОНФИГУРАЦИЯ СТЕРЕОИЗОМЕРОВ. D/L
СТЕРЕОХИМИЧЕСКИЕ РЯДЫ.
Для изображения конфигурационных изомеров на плоскости можно пользоваться стереохимическими формулами. Однако удобнее применять более простые в написании проекционные формулы Фишера (проще - проекции Фишера). Рассмотрим их построение на примере молочной (2-гидроксипропановой) кислоты.
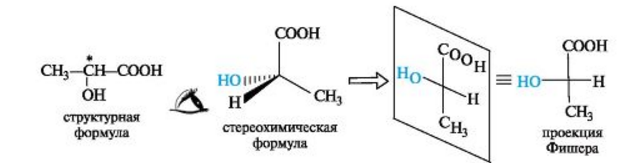
D.L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с позиций стереоизомерии) молекул, таких, как α-аминокислоты, α-гидроксикислоты и им подобные. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой L. Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой D. Отнесение к D- или L-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией D- или L-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у l-глицеринового альдегида, поэтому энантиомер (I) относят к L-ряду. Из тех же соображений энантиомер (II) относят к D-ряду. Так из сравнения проекций Фишера определяют относительную конфигурацию.
Установление абсолютной конфигурации стало возможным только благодаря развитию физико-химических методов, особенно рентгеноструктурного анализа, с помощью которого в 1951 г. впервые была определена абсолютная конфигурация хиральной молекулы.
