
- •Классификация аминокислот.
- •Окисление жирных кислот с четным числом углеродных атомов
- •Физико-химические свойства аминокислот.
- •Пути превращения углеводов. Реакции гликолиза.
- •Первичная структура белка. Характеристика пептидной связи.
- •Пентозофосфатный путь и его значение.
- •Вторичная структура белка. Альфа- спираль и бета – складчатый слой.
- •Мобилизация гликогена при мышечной работе.
- •Третичная структура белка и силы ее стабилизирующие.
- •Работа пируватдегидрогеназного комплекса.
- •Четвертичная структура белка. Понятия о денатурации и деструкции.
- •Работа цикла трикарбоновых кислот.
- •Моносахариды. Структура и функция.
- •Синтазная система синтеза жирных кислот.
- •Кооперативный эффект связывания кислорода гемоглобином.
- •Окисление жирных кислот с нечетным числом углеродных атомов.
- •Реакции глюконеогенеза.
- •Отличия ферментов от неорганических катализаторов.
- •Классификация ферментов с примерами реакций на каждый класс.
- •Биохимия мышечного сокращения. Характеристика белков мышц.
- •Влияние температуры, pH и концентрации фермента на скорость ферментативной реакции.
- •Реакции трансаминирования, их биологическая роль.
- •Пути превращения аминокислот в организме человека. Глюкогенные и кетогенные аминокислоты.
- •Влияние концентрации субстрата на скорость ферментативной реакции. Уравнение Михаэлиса-Ментен.
- •Ингибирование ферментов. Конкурентное ингибирование. Использование конкурентного ингибирования для лечения заболеваний.
- •Синтез кетоновых тел, их роль для организма человека.
- •Ингибирование ферментов. Неконкурентное ингибирование.
- •Цикл мочевины.
- •Аллостерические ферменты.
- •Глюкозо-аланиновый путь, его важность для спортсмена.
- •Активный центр фермента и его свойства.
- •Биохимия мышц. Источники энергии для мышечного сокращения.
- •1 Кофакторы и коферменты. Классификация.
- •Гормоны гипоталамуса и гипофиза.
- •Способы определения активности фермента. Единицы измерения. Понятие об удельной и молярной активности.
- •Гормоны надпочечников (коркового и мозгового слоя)
- •Изоферменты.
- •Биосинтез белка. Стадии активации и инициации.
Вторичная структура белка. Альфа- спираль и бета – складчатый слой.
Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O. HN. При этом пептид стремится принять конформацию с образованием максимального числа водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет характер частично двойной связи и вращение вокруг нее затруднено, поэтому пептидная цепь приобретает не произвольную, а строго определенную конформацию (рис. 7). Известны несколько способов укладки полипептидной цепи в пространстве:
1) альфа-спираль — образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка (рис. 7А);
2) бета-структура (складчатый лист) — формируется водородными связями между пептидными группами полипептидных цепей, расположенными параллельно или антипараллельно (рис. 7Б), или связями между участками одной полипептидной цепи, образуя складки (рис. 7 В);
3) беспорядочный клубок — это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также обусловлена аминокислотной последовательностью.
Содержание альфа-спиралей и бета-структур в разных белках различно: у фибриллярных белков — только спираль или только складчатый лист; а у глобулярных белков — отдельные фрагменты полипептидной цепи: организованы в виде спирали либо складчатого листа, либо беспорядочного клубка.
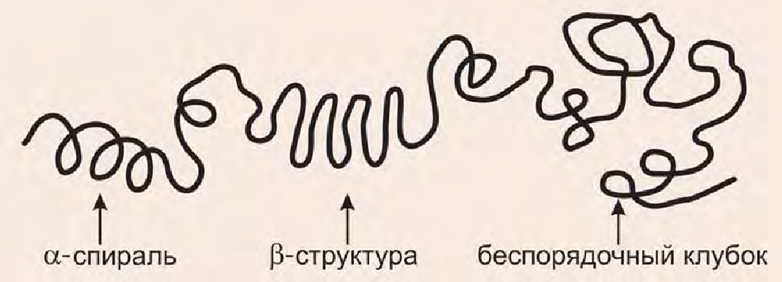
Рис. 7. Конформация полипептидных цепей:
А — α-спираль; Б — β-структура межцепочечная; В — структура в пределах одной пептидной цепи
Мобилизация гликогена при мышечной работе.
Контроль метаболизма гликогена осуществляется через регуляцию активности гликогенфосфорилазы (ключевой фермент распада гликогена) и гликогенсинтазы (ключевой фермент синтеза гликогена). Активация одного фермента сопровождается ингибированием другого.
В ответ на снижение концентрации глюкозы в крови синтезируется глюкагон, который стимулирует распад гликогена в печени. Запускается аденилатциклазный каскад реакций, приводящий к фосфорилированию и активации гликогенфосфорилазы и ингибированию гликогенсинтазы. Так же действует адреналин, связываясь с β2-рецепторами. Однако, если он связывается с α1-рецепторами, то запускается инозитолфосфатный механизм передачи сигнала. Результат действия обеих систем идентичен.
Гликогенолиз в скелетной мышце связан с участием Ca2+ в процессе мышечного сокращения. Кальций связывается с кальмодулином. Он активмрует гликогенфосфорилазу, и глюкозо-6-фосфат вступает в гликолиз, и обеспечивает образование АТФ, необходимого для мышечного сокращения.
При умеренной физической нагрузке и в состоянии покоя активатором гликогенфосфорилазы в мышцах является АМФ, образующийся при распаде АТФ.
В период пищеварения повышается концентрация глюкозы в крови, что является сигналом для синтеза и секреции инсулина. Под его влиянием ускоряется транспорт глюкозы в клетки инсулинзависимых мышечной и жировой тканей, активируется фосфопротеинфосфатаза, которая дефосфорилирует гликогенфосфорилазу, замедляя распад гликогена, и гликогенсинтазу, активируя её. Под действием инсулина индуцируется синтез глюкокиназы в печени, тем самым ускоряется фосфорилирование глюкозы. Глюкозо-6-фосфат аллостерически активирует гликогенсинтазу.
Так регуляция метаболизма гликогена в мышцах обеспечивает энергией интенсивную работу и энергозатраты в покое, а в печени поддерживает постоянство концентрации глюкозы в крови.
