
учебное пособие химия цемента
.pdf- 79 -
клинкера, тонкостью помола цемента. Внедрение в кристаллическую решетку С3S примесных ионов Ва2+, Сd2+, Mn3+, Mg2+, Na+, Ti+ и др., а также
наличие в твердом растворе трехкальциевого силиката оксидов Cr2O3, NiO увеличивает количество активных центров, а внедрение в анионную подрешетку клинкерных минералов ионов S6+, Ti4+, Al3+ вызывает дополнительные количества катионных и анионных вакансий и, соответственно, повышает концентрацию «дырок» и электронных носителей
зарядов. |
|
|
|
|
Концентрация |
дефектов |
экспоненциально |
увеличивается |
с |
уменьшением размера частиц цемента, поэтому высокие скорости гидратации тонких фракций цемента связаны не только с их высокой удельной поверхностью, но и с более высокой концентрацией активных центров на этой поверхности. По ряду оценок различных ученых на 1 см2
поверхности высокой активностью обладают 1012-1013 атомов (из имеющихся
1014-1015).
Активные центры имеют не только электростатическую ненасыщенность, но и особую структуру, для которой характерны «болтающиеся» на поверхности атомные орбитали. Они могут появляться в результате разрыва ковалентной компоненты связей в кремнекислородных тетраэдрах [SiO4]4-, которые составляют основу силикатных материалов.
Характеризуя поверхность цементных частиц, необходимо обратить внимание также на их полиминеральность. С химической точки зрения она представлена атомами кальция, кремния, железа, алюминия и кислорода. Причем, общее количество атомов кислорода оказывается больше суммы остальных атомов у C2S или равным у C3S; для C3A это отношение меньше единицы.
Если учесть тот факт, что размеры атомов кремния и алюминия существенно меньше, чем атома кислорода, становится ясным, что в основном твердая поверхность будет «покрыта» атомами кислорода и в меньшем количестве – атомами кальция. Соотношение между ними обычно составляет 0,5-0,75 в пользу атомов кислорода. Отсюда следует вывод, что поверхность цементных зерен заряжена отрицательно. Такая роль кислорода приводит к «забиванию» донорных уровней, снижает концентрацию адсорбированных молекул воды и тормозит развитие процессов гидратации, прежде всего, белита, который является самым медленно твердеющим минералом цементного клинкера.
Плотность «посадки» молекул и ионов адсорбированной воды на локализованной поверхности цементного зерна можно повысить за счет изменения количества воды в твердеющей системе, введения химических добавок, в том числе - поверхностно-активных веществ, изменения температуры всей системы, электрических, магнитных, ультразвуковых воздействий.
Для вяжущих гидратационного твердения возможны два случая их взаимодействия с водой: первый, когда твердая фаза растворяется в воде не-

- 80 -
посредственно (например, гипс), и второй, относящийся к вяжущим, полученным обжигом до спекания (клинкерные минералы). Последний представляется учеными как перевод в жидкость (растворение) продуктов взаимодействия жидкости с минералами клинкера на поверхности (и в порах) зерна цемента, то есть во втором случае растворение идет за счет промежуточных топохимических реакций. Отстаивая возможность топохимического механизма растворения, известный ученый в области вяжущих веществ Ф.М.Ли приводил в свое время следующую достаточно убедительную мысль: «Нельзя говорить, например, о растворимости в воде трехкальциевого или двухкальциевого силикатов, так как она не представляет собой определенной физической величины: не существует водного раствора, в котором эти соединения могли бы находиться, оставаясь в равновесии, или из которого они могли бы выделяться».
Перевод вяжущего вещества в раствор в первом случае осуществляется за счет реакции растворения, основой которой является взаимодействие растворителя (обычно полярная жидкость – вода) с частицами твердой фазы
– так называемая поверхностная гидратация ионов. При этом происходит разрыв связи катион-кислород (например, Са-О) за счет ион-дипольного взаимодействия полярных молекул воды.
Во втором случае процессу растворения (разрыву связей) предшествует топохимическая реакция перевода нерастворимого вещества в растворимое в воде. Здесь уже поляризационного воздействия молекул воды недостаточно для разрыва более сильных связей с большей долей ковалентности. Поэтому в действие вступает механизм протонизации поверхности клинкерных минералов. Появление протона Н+, имеющего среди всех известных ионов самый минимальный заряд и самую минимальную массу, вызвано незначительной, но достаточной диссоциацией молекул воды на границе раздела твердой и жидкой фаз. Способность воды к передаче протона Н+ определяется, прежде всего, степенью ионности связи Ме-О в кристалле, которую можно оценить значением электроотрицательности металла, и в меньшей степени это зависит от структуры кристаллической решетки. Миграция протона Н+ внутрь кристалла с заменой О2- на ОН- получила название протонизации.
В настоящее время считается признанным тот факт, что начальной стадией растворения при гидратации клинкерных минералов является топохимическое взаимодействие протона с ионами кислорода в кристаллической решетке с образованием гидроксидного иона ОН- или молекулы воды (работы В.В.Данилова, Л.Г.Шпыновой и др.). Схематично это можно записать так
МеО + Н+ |
Ме(ОН)+пов. или |
|
МеО + 2Н+ |
Ме2+пов. + Н2О. |
(24) |

- 81 -
Иными словами, протонизация оксидного иона нарушает связи в кристаллической решетке, и ионы металла (например, Са2+) переходят под влиянием сил гидратации в раствор. Установлено, что такой характер растворения (с использованием протонизирующего агента) справедлив для соединений магния (электроотрицательность катиона Mg2+= 1,2), кальция (электроотрицательность Са2+= 1,0) и бария (электроотрицательность Ва2+= 0,9). Оксиды алюминия и кремния водой не протонизируются (их электроотрицательности соответственно равны 1,5; 1,8) и растворяются не ионно, а молекулярно (их ионное растворение имеет место в водных растворах щелочей).
Таким образом, как металлы образуют ряд по способности к окислению, так и оксиды металлов образуют ряд по способности к присоединению протона. Эта способность характеризуется минимальным значением рН, необходимым для разрыва связи Ме-О, что в равной степени относится как к оксидам, так и к их соединениям типа силикатов, алюминатов (двойных оксидов). В случае MgO, CaO, двойных оксидов концентрация протона в системе, оцениваемая рН = 10-11, достаточна для разрыва связи Ме-О, и здесь протонизирующим фактором может служить вода. В других случаях (например, для фосфатных вяжущих) перевод оксида в раствор возможен только при более высоких концентрациях протона. Для этого в воду необходимо добавлять кислоту. Так, например, затворителем для фосфатных вяжущих служит ортофосфорная кислота.
Схему передачи протона двойному оксиду – -С2S можно представить
как:
2СаО . SiO2 (или Са2SiO4) + H+ |
Ca2SiO3OH+пов. |
(25) |
Втаких оксидах существует более сложная связь Са-О-Ме1, где Ме1 – более электроотрицательный металл, чем кальций. Степени ионности здесь
взаимосвязаны: с увеличением электроотрицательности Ме1, начиная с кальция, электроотрицательность которого равна единице, степень ионности связи Са-О возрастает. Но, несмотря на это, способность оксидного иона к протонизации будет уменьшаться, так как с увеличением
электроотрицательности Ме1 одновременно возрастает ковалентность связи Са-О-Ме1 и поэтому анион переходит в раствор в неизменном виде.
Вряду Са-О-Са, Са-О-Al, Ca-O-Fe, Ca-O-Si при ионном механизме растворения активность двойного оксида по отношению к воде должна возрастать, в то время как для топохимической реакции передачи протона активность должна падать. С этой точки зрения С3S гидравлически более
активен, чем -С2S, поскольку для первого более характерна связь Са-О-Са. Поэтому некоторые ученые считают возможным конгруэнтное
растворение С3S в первые моменты его контакта с водой по схеме:
С3S + 3H2O |
3Ca2+ + H2SiO42- + 4OH-. |
(26) |

- 82 -
Для перевода ионов Са2+ в раствор не требуется протонизация всех оксидных ионов, так как при гидратации клинкерных минералов появление на поверхности гидроксидного иона, связанного с кремнием, вызывает перестройку других кремнекислородных связей, которая состоит в их поляризации и упрочнении. В результате это приводит к образованию двойных связей Si = O. Перестройке способствует также отсутствие прочных силоксановых связей Si-O-Si и искаженность силикатных тетраэдров в кристаллических решетках минералов - силикатов.
При гидратации С3А топохимическая реакция протонизации должна идти глубже, поскольку электроотрицательность алюминия меньше, чем кремния, и поэтому межфазный процесс протекает легче. Отмечено также, что в случае гидратации С3А, помимо топохимической передачи протона Н+, идут процессы образования гидроксилалюминатных комплексов, что обуславливает автокаталитический характер гидратации этого минерала.
Таким образом, можно говорить о гидролизе С3S и других клинкерных
минералов, разрыве связей типа Са-О-Si, |
развития ионного обмена, |
приво- |
Са2+ |
2Н+ , |
(27) |
дящего к переходу части структурных единиц кристаллов (Са2+, Al3+, Mg2+, Na+, K+ и др.), а также гидратированных ионов Са(ОН)+, (H2SiO4) 2- в водный раствор, к его насыщению и пересыщению.
Сам процесс растворения может рассматриваться как разрушение поверхности клинкерных частиц, как многостадийный процесс, состоящий из подвода растворителя к твердой поверхности, собственно химической реакции на границе раздела «твердое тело-жидкость» и отвода в объем жидкости молекул или ионов, образующих раствор.
Подводя итог вышесказанному, можно представить механизм гидратации клинкерных минералов, как включающий в себя следующие процессы:
адсорбцию полярных молекул воды на поверхности кристаллов с частичным электролитическим разложением молекул воды на ионы Н+ и ОН-;
взаимодействие этих ионов и молекул воды с активными центрами поверхности кристаллов с образованием хемосорбционных связей;
развитие ионного обмена типа Са2+  2Н+ (протонизация), приводя-
2Н+ (протонизация), приводя-
щего к переходу определенной части структурных единиц кристаллов (Са2+, Al3+, Mg2+, Na+, K+ и др.) в водный раствор;
присоединение Н+ и ОН- , а также полярных молекул воды к другим
структурным единицам кристаллов с образованием первичных зародышей новой фазы – гидратов (СaO)х . (SiO2)y. ( H2O)z , Са(ОН)2 и др.;
интенсивный переход в раствор, наряду с обменными ионами,
гидратированных ионов Са(ОН)+, (Н2SiO4)2- и т.п., приводящий сначала к насыщению, а затем к пересыщению водного раствора соответствующими ионами, в результате чего осуществляется выкристаллизовывание новой фазы в объеме и на поверхности.
- 83 -
6.3.1.2. Общие представления о механизме образования новых фаз при взаимодействии цемента с водой
Переход в раствор ионов кальция Са2+, гидратированных ионов кальция Са(ОН)+ приводит к образованию в поверхностном слое клинкерного зерна гидроксилированного, обогащенного кремнеземом слоя. Переход ионов Si4+ в раствор под влиянием «захвата» гидроксильного иона маловероятен при тех значениях рН, которые свойственны процессам гидратации (рН 11,5), поэтому на поверхности алита, белита всегда сохраняется «скелет» из кремнекислородных ионов (кремнегель). Однако, протонизация оказывает свое влияние и на силу связей в кремнекислородных тетраэдрах, ослабляя их. В результате происходит перестройка слоя силикатных ионов кремнегеля, которые начинают вступать во взаимодействие с ионами Са2+. Продуктом такого взаимодействия является новая фаза С-S-H, представляющая собой гидросиликаты кальция.
Учитывая то, что в составе жидкой фазы кроме ионов кальция находятся ионы алюминия, железа и др., можно принять, что образование гидроалюминатов, гидроферритов кальция протекает по механизмам, близким к вышеописанному, как результат химического взаимодействия продуктов гидролиза и гидратации.
Исследования ионной силы раствора в твердеющей системе «цементвода» показывают, что она изменяется циклически. Это указывает на определенный порядок образования новых фаз. В целом этот процесс должен идти в направлении понижения значений термодинамического потенциала так, что вероятность более устойчивого существования каждой последующей фазы должна быть выше, чем предыдущей.
6.3.1.3. Термодинамический аспект образования новых фаз
При соприкосновении тонкоизмельченных, находящихся в метастабильном состоянии, компонентов вяжущих веществ с водой (или с водным раствором) создаются условия для физико-химической диспергации частиц, собственно химической реакции гидратации, появления пересыщенных систем и образования термодинамически более устойчивых соединений –
гидратов.
Последовательность и продолжительность появления новых структур определяется термодинамической вероятностью взаимодействия исходных фаз. В тот момент, когда вода соприкасается с неустойчивой решеткой минералов вяжущего вещества, решетка претерпевает перестройку, которая в одних случаях происходит достаточно интенсивно (когда вещество растворяется), в других случаях этот процесс осуществляется ограниченно – с поверхности.
Обширные исследования по термодинамическому анализу, выполненные О.П.Мчедловым-Петросяном, показали, что при переходе

- 84 -
соединений из безводного состояния в гидратированное изменяется средняя энергия связи (Са-О) и в целом наблюдается выигрыш в энергии. Кроме того, расчеты показали, что реакциям гидратации соответствует отрицательное значение свободной энергии Гиббса - G, что говорит о больших движущих силах, обеспечивающих самопроизвольный характер этих процессов. В табл.13 представлены данные термодинамических расчетов при условии получения в качестве продуктов реакций взаимодействия вяжущих с водой наиболее устойчивых соединений. Для сравнения представлены также характеристики соединений, не обладающих вяжущими свойствами или проявляющих их слабо в обычных условиях твердения ( -СS, -С2S).
Таблица 13
Расчетные значения свободной энергии G и выигрыш энергии на связи Са-О
Безводные |
|
Гидраты |
G, |
Выигрыш |
|||
соединения |
|
|
|
|
кДж/моль |
энергии на связи |
|
|
|
|
|
|
|
|
Са-О, кДж/моль |
3СаО . SiO2 |
2CaO . SiO2 |
. |
1,17H2O |
- 78,3 |
31,6 |
||
-2СаО . SiO2 |
2CaO . SiO2 |
. |
1,17H2O |
- 5,86 |
20,27 |
||
3CaO . Al2O3 |
3CaO . Al2O3 |
. 6H2O |
- 234,6 |
58,24 |
|||
|
CaO |
Ca(OH)2 |
|
|
- 55,3 |
54,6 |
|
CaSO4 |
. 0,5H2O |
CaSO4 |
.2H2O |
|
- 5,74 |
42,7 |
|
-2СаО . SiO2 |
2CaO . SiO2 |
. |
1,17H2O |
- 2,93 |
19,2 |
||
-СаО . SiO2 |
2CaO . SiO2 |
. |
1,17H2O |
+ 20,5 |
5,86 |
||
Из табл.13 следует, что способность соединений к гидратации зависит как от величины и знака G , так и от выигрыша в энергии, который получается в результате реакции и который в какой-то мере позволяет судить
оспособности веществ создавать устойчивое пересыщение, необходимое для зарождения новой фазы.
Расчеты изменения энтропии – меры энергетического беспорядка в системе, по которой можно судить о направлении процесса, свидетельствуют
отом, что реакции гидратации вяжущих веществ сопровождаются ее уменьшением. Следовательно, можно сделать вывод о том, что процессы гидратации приводят к получению более устойчивых, более упорядоченных
соединений. В среднем значение энтропии, приходящееся на 1 моль воды, составляет для вяжущих гидратационного твердения – 36,45 кДж/(моль.К).
Эта величина по своему значению близка к значению энтропии при переходе воды в лед, то есть в твердое состояние (- 34,1 кДж/(моль.К)).
Отмеченное позволяет судить о силе связи воды в гидратированных соединениях и сделать вывод о том, что в энтропийном отношении процесс гидратации является процессом связывания воды и превращения ее в составе новообразований в псевдотвердую фазу.
- 85 -
Краткие обобщения по процессам гидратационного твердения цемента на атомно-молекулярном уровне
Выполненный нами анализ процессов гидратационного твердения на атомно-молекулярном уровне, а также другие, не приведенные здесь (из-за ограниченного объема пособия) результаты исследования влияния других факторов, дают основание для следующих обобщений.
Непосредственным объектом анализа явилась неравновесная химически активная система, представленная минералами цементного клинкера в контакте с водой. Атомно-молекулярный уровень иерархии твердеющей системы характеризуется взаимодействиями между атомами, свободными радикалами, молекулами, ионами, ионами-радикалами, комплексами различного состава и строения.
Химические реакции рассматриваются как совокупность актов разрыва
иобразования новых химических связей, обусловленных преодолением потенциальных энергетических барьеров, действием различных внутренних
ивнешних причин, к которым можно отнести химическую индукцию, химическое инициирование (через химические добавки), влияние окружающей среды (барометрическое, тепловое, влажностное, реагентное, гравитационное, электромагнитное, электрозвуковое и др.) Скорость химического превращения определяется кинетическими характеристиками процессов как факторов вероятностного взаимодействия частиц, обладающих энергией, достаточной для преодоления критического потенциального барьера, а также обладающих определенным уровнем энтропии (энтропийным фактором). В конечном итоге имеет место «отбор» таких морфологических форм гидратов, которые в наибольшей степени приспособлены к функционированию вяжущей системы.
6.3.2. Процессы гидратационного твердения, протекающие в масштабе зерна цемента
6.3.2.1. О состоянии и роли воды затворения
Портландцемент и его разновидности мы с полным основанием можем относить к классу дисперсно-зернистых материалов, то есть таких материалов, в которых доля тонкодисперсных частиц (примерно микронных размеров) велика и, соответственно, велико их влияние на поведение всей системы. Речь идет, прежде всего, о большой суммарной поверхностной энергии этих частиц, обусловленной высокими значениями их удельной поверхности.
При соприкосновении цементных зерен с водой затворения
определенная ее часть переходит в поверхностно-адсорбционное состояние,
обладающее значительной энергией связи.
- 86 -
Для химически инертных по отношению к воде порошков главной причиной формирования адсорбционных слоев воды считают физическое притяжение молекул воды относительно поверхности твердой фазы. Поверхностные силы со стороны твердой фазы имеют несколько составляющих: дисперсионную или молекулярную, электростатическую, структурную.
Дисперсионные силы относят к близкодействующим. Их можно рассматривать как равнодействующую сил межчастичного притяжения и броуновских сил отталкивания.
Электростатические силы – дальнодействующие. Они обеспечиваются ионными и дипольными взаимодействиями.
Причиной адсорбции, близкой к физической, может быть также образование водородной связи, В частности, такая связь возникает при адсорбции на поверхности частицы, содержащей гидроксильные группы.
Если поверхность твердой фазы химически активна по отношению к воде, то дополнительно возникают более прочные связи химической природы. Адсорбционную воду, обладающую такого рода связями, называют
хемосорбционной.
Взависимости от преобладания тех или иных видов сил общую энергию связи воды на поверхности зерен цемента ученые оценивают в
200…800 Дж/г и выше.
Слой адсорбционной воды на поверхности зерна по толщине неоднороден; наибольшую толщину имеет в окрестностях активных центров.
Втерминах коллоидной химии сферы связанной воды на зернах цемента называют сольватными оболочками. В терминах механики дисперсных систем такую воду называют пленочной. На наш взгляд термин «сольватные оболочки» лучше подходит для сильно оводненных систем «цемент-вода», при низком содержании воды термин «пленочная вода» более понятен, особенно при анализе напряженного состояния влажной дисперсии. Используется также более нейтральный термин – «граничный слой воды».
Многочисленные опыты показывают, что вода в граничном слое на зернах цемента жестко структурирована за счет диполей. Это вполне объяснимо, если учесть, что поверхность зерна цемента имеет четко выраженную электроотрицательность.
Исследования и расчеты показывают, что толщина граничного слоя воды на зернах кварца составляет 8-10 нм, а на зернах цемента она может достигать 100 нм и более (до 1000 молекулярных слоев воды). Наиболее прочно связанной является вода в слоях, близких к поверхности твердой фазы, толщиной около 1 нм.
Всоответствии с положениями коллоидной химии, касающимися сольватных оболочек, мы с полным основанием можем говорить о поляризации сольватных оболочек на зернах цемента, о существовании двойного электрического слоя (ДЭС), об электрокинетическом потенциале, о
- 87 -
диффузном слое, то есть распространении слабой поляризации на окружающую зерно цемента условно несвязанную воду.
Как и в коллоидных системах, в системе «цемент-вода» наблюдается сжатие сольватных слоев при концентрационных (за счет введения химических реагентов), тепловых, электромагнитных воздействиях.
Вода в пограничных слоях по своим свойствам значительно отличается от обычной объемной воды (в цементном тесте она заполняет межзерновые поры и капилляры). В частности, плотность адсорбционной воды по некоторым оценкам достигает 1,1 г/см3; упругость достигает показателя упругости, характерного для твердых тел. Очень важной особенностью поверхностно-связанной воды является ее низкая растворяющая способность. В связи с этим весьма показательны экспериментальные результаты, полученные проф. Е.И.Шмитько. Им исследовалась степень гидратации цемента, совершенство структурных характеристик гидратных новообразований в зависимости от содержания воды в твердеющей системе. Оказалось, что при количестве воды, не превышающем ее количества в пленках, гидратационные процессы практически не развиваются; образовавшиеся при этом новые фазы имеют весьма несовершенную структуру. И лишь при наличии в системе объемно-капиллярной воды (В/Ц 0,06…0,07) гидратационные и структурообразующие процессы развиваются нормально.
Исходя из таких результатов, мы считаем правомерным утверждение ряда ученых и специалистов о том, что жестко структурированный поляризованный слой пленочной воды в процессах гидратации и твердения выполняет, в основном, транспортные функции, обеспечивая передачу заряженных частиц, ионов, молекул, некоторых комплексов к поверхности или от поверхности зерна цемента. Поставщиком же гидратных ионов, растворителем для поступающих от клинкерных минералов частиц является объемная вода. Поэтому ее присутствие в твердеющей системе обязательно.
6.3.2.2. О причинах и закономерностях образования новых твердых фаз - гидратов
Микроскопические наблюдения за процессом взаимодействия клинкерных минералов с водой на поверхности зерна цемента, проведенные профессором Л.Г.Шпыновой, показали, что вначале происходит конгруэнтное растворение отдельных минералов, которое длится не более 5 с, затем в промежутке времени до одной минуты на зернах цемента образуется первичный гидрат с отношением оксида кальция к оксиду кремния С/S 3, его толщина составляет около 0,8 нм. Затем образуется вторичный гидрат с С/S 2, толщина слоя которого достигает 6 нм. В этом же промежутке времени на поверхности зерна цемента отчетливо обнаруживаются первичные кристаллы гидроксида кальция.
- 88 -
Врезультате первоначальной быстрой реакции на поверхности зерна цемента образуется достаточно плотная пленка новообразований, которая препятствует свободному доступу воды к реакционной поверхности, в результате чего общий процесс замедляется и наступает так называемый индукционный период, в течение которого система не отвердевает и внешне остается как бы неизменной. Но в действительности развитие процессов,
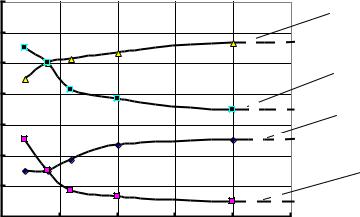
хотя и с небольшой скоростью, продолжается. В частности, в жидкой фазе, окружающей зерно цемента, идет наращивание концентрации ионов ОН-, К+, Na+ и др. (рис.17), которая в итоге достигает равновесного уровня, после чего гидратационные процессы самоускоряются.
Вто же самое время происходит интенсивный рост твердых новобразований под первичной гидратной пленкой. Эти новообразования формируют так называемую (по международной терминологии) внутреннюю сферу «слоя Тейлора» или структуру внутреннего ритма. Твердые новообразования в структуре внутреннего ритма, увеличиваясь в объеме, создают под первичной пленкой напряжения, которые, в конце концов, разрывают ее и тем самым обеспечивают свободный доступ воды к реакционной зоне и вынос продуктов реакции во внешнюю сферу (в жидкую фазу). С этого момента времени процесс гидратационного твердения заметно ускоряется (индукционный период закончился) и начинается формирование из твердых новообразований внешней сферы «слоя Тейлора» или структуры внешнего ритма – чешуйчатого, волокнистого, игольчатого строения.
мл |
14 |
|
|
|
|
+ |
+ |
|
|
|
|
|
2(К + Na ) |
||
ммоль/100 |
|
|
|
|
|
||
12 |
|
|
|
|
|
|
|
10 |
|
|
|
|
SO42- |
|
|
8 |
|
|
|
|
|
- |
|
|
|
|
|
|
|
||
, |
|
|
|
|
|
2OH |
|
|
|
|
|
|
|
||
Концентрация |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
||
4 |
|
|
|
|
Са2+ |
|
|
|
|
|
|
|
|
||
2 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
|
|
|
|
|
|
|
180 |
|
|
|
Время гидратации, мин |
|
|
|||
Рис.17. Изменение ионного состава воды в порах твердеющего цементного теста (по данным Ф Лохера и В.Рихартца)
С течением времени образование структур внутренних и внешних ритмов для каждого зерна цемента повторяется, то есть процесс структурообразования протекает циклически, а сфера из новообразований
