
учебное пособие химия цемента
.pdf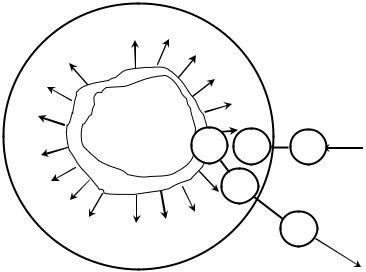
- 59 -
5.4.4. Особенности диссоциации карбонатов кальция при получении клинкера
При нагревании известняка или мела идут обычные процессы диссоциации СаСО3, имеющие место при получении воздушной извести. Схема диссоциации зерна СаСО3 представлена на рис.16.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис.16. Схема диссоциации |
||
СаО |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зерна СаСО3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обозначения: 1 – подвод те- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
плоты; 2 – передача теплоты |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
через слой; 3 – химическая |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакция |
|
на поверхности |
СаСО3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
(теплота |
расходуется на |
|||
|
|
|
|
2 |
|
|
1 |
|
|
||||||||
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разложение СаСО3, СО3 2-, |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
4 |
|
|
|
|
|
|
|
СаО . СО2 |
и рекристаллиза- |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цию СаО); 4 –диффузия СО2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СО2 |
|||
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
через слой СаО; 5 – переход |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СО2 |
в |
межзерновое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пространство |
||
Интегральная скорость разложения СаСО3 возрастает с уменьшением размера исходных частиц, а примеси в известняке или меле могут и ускорять, и тормозить процесс образования и развития зародышей СаО. Соединения, содержащие двухвалентное железо, интенсифицируют процесс декарбонизации, так как между Fe2+и СО2 идет реакция взаимодействия. Фтористые соли, которые вводятся в состав цементной шихты в качестве добавок – минерализаторов для улучшения процесса спекания, также вызывают значительное ускорение реакции диссоциации, которая начинается при температуре примерно на 100 0С ниже обычной. Соли щелочных металлов (Na2CO3, K2CO3, NaCl) также интенсифицируют реакцию разложения СаСО3. Предполагается, что ион Na+ (К+) может замещать Са2+ в решетке кальцита, что искажает строение поверхностного слоя кристаллов, приводит к ослаблению связей между ионами и ускоряет протекание электронных и ионных перемещений, что, безусловно, влияет на процесс термического разложения СаСО3. Ускоряют диссоциацию кальцита также оксиды MnO, В2О3 и многие другие оксиды.
Между тем, в любом случае температурный фактор остается определяющим для скорости диссоциации СаСО3.
- 60 -
5.4.5.Механизм образования клинкерных минералов
втвердой фазе
Для получения клинкера используются специально приготовленные сырьевые смеси, тонкоизмельченные и тщательно перемешанные, состоящие из частиц углекислого кальция, глинистого компонента и корректирующих добавок. Сырьевые смеси обычно содержат 75-78 % СаСО3 (известняк, мел) и 22-25 % алюмосиликатного компонента (глины, техногенные продукты). При нагревании отдельные компоненты смеси испытывают как самостоятельные превращения, о которых уже шла речь (дегидратация, диссоциация и др.), так и вступают в различные химические взаимодействия, приводящие в итоге к синтезу клинкерных минералов. При этом химические реакции клинкерообразования могут протекать в твердом состоянии (топохимически) и в расплаве (жидко-фазовые превращения). Тот или иной механизм реакций зависит от ряда факторов, в том числе – от состава сырья, температуры, наличия примесных элементов и др.
Для процессов клинкерообразования механизм реакций важен не сам по себе. Главное рациональное зерно видится в том, что механизм реакций во многом предопределяет состав, структуру, термодинамическое состояние образующихся соединений. Эти соединения могут выступать и как промежуточные, и как окончательные фазы портландцементного клинкера. Причем, возможны вариации перехода от исходных фаз к конечным. Все это указывает на необходимость более подробного рассмотрения возможных вариантов процессов клинкерообразования.
5.4.5.1. Общие представления о процессах клинкерообразования
Реакции между твердыми веществами, в том числе – кристаллическими, протекающие без участия газообразных или жидких веществ (хотя бы в качестве промежуточных состояний реакционной системы), получили название твердофазовых. Основной причиной таких реакций (они называются еще топохимическими) является перемещение ионов и электронов, вызываемое неравновесным состоянием решеток реагирующих веществ. Дефекты кристаллических решеток (точечные, дислокации поверхностные, объемные) способствуют протеканию реакций топохимического взаимодействия. Ионы, в зависимости от размеров, величины заряда и других факторов, перемещаются в пределах одной и той же решетки с различной скоростью: обычно анионы перемещаются значительно медленнее, чем катионы. Поэтому считается, что реакции в твердом состоянии осуществляются, как правило, за счет движения катионов, которые тоже в зависимости от вида диффундируют с различной скоростью. Чаще всего развивается так называемая встречная диффузия катионов, например, движение ионов Са2+ в одном направлении с одной скоростью,
- 61 -
а ионов Si4+ - в противоположном – с другой скоростью. Различия в скорости диффузии катионов может достигать больших значений. Следствием различной подвижности разноименных ионов является возникновение градиента концентрации в кристалле и, естественно, химического и электрического потенциалов; последний в определенной мере регулирует перемещение катионов, ускоряя их движение или замедляя его. Одноименные диффундирующие ионы обычно перемещаются с равной скоростью беспорядочно во всех направлениях, поэтому первоначально возникающая новая твердая фаза не упорядочена по строению, является метастабильной и при определенных условиях претерпевает превращения. Постепенно она становится устойчивым гомогенным твердым раствором равновесного состава или распадается с образованием нового равновесного химического соединения. Каждый из этих процессов является сложным, состоящим из отдельных элементарных актов разрыва старых химических связей, образования новых связей, возникновения активированных комплексов, переходных состояний и т.п. Появление новой фазы подчиняется своим определенным закономерностям. Вначале возникают зародыши кристаллов, затем они приобретают способность расти, и твердый раствор переходит в новое кристаллическое вещество – продукт твердофазовой реакции.
Важно также отметить то, что химическое превращение на поверхности твердой фазы происходит так, что кристаллическая решетка новой фазы сопрягается с кристаллической решеткой старой фазы близкими по строению кристаллографическими плоскостями, структурные параметры которых различаются в небольшой степени. Постепенно такая «вынужденная» неустойчивая структура переходит в структуру, устойчивую при данных условиях.
Продукты твердофазовой реакции образуют слой на поверхности «покрываемого» компонента, который по мере развития твердофазовых реакций изменяет свои толщину и строение. В частности, при повышении температуры, возникшие кристаллики новых соединений испытывают собирательную рекристаллизацию, то есть укрупнение.
5.4.5.2.Виды, последовательность и механизм твердофазовых реакций клинкерообразования
Применительно к процессу обжига портландцементного клинкера реакции в твердом состоянии начинаются при температуре 750-800 0С и выше и продолжаются до температуры 1200 0С. Кристаллические решетки практически всех компонентов цементного сырья в этих условиях отличаются особо повышенной активностью вследствие появления в них вакантных мест, которые были заняты молекулами Н2О, СО2, гидроксильными ионами ОН- и др. Интенсивное тепловое движение структурных элементов кристаллических решеток, сопровождающееся
- 62 -
«обменом мест», вначале приводит к некоторому исправлению дефектности строения монокристаллов, а затем – к взаимодействию кристаллов различных компонентов по одному из вышеизложенных (п.5.4.5.1) механизмов. Скорость взаимодействия оксида кальция с кислотными оксидами в твердофазовых реакциях зависит от целого ряда факторов. В частности, эти реакции протекают тем быстрее, чем выше температура, чем более разрыхлены кристаллические решетки реагирующих веществ за счет разложения, присутствия примесей, полиморфизма, чем более тонко измельчен компонент и др.
Как показывают многочисленные исследования, реакции в твердом состоянии являются, как правило, многоступенчатыми, с образованием промежуточных соединений. Последовательность возникновения новых фаз определяется не их химическим потенциалом, а работой их образования. В тех случаях, когда структуры наиболее выгодных в термодинамическом отношении новых соединений будут мало отличаться от структур исходных веществ, они одновременно окажутся и первичными, и наиболее устойчивыми. И наоборот, если новые структуры наиболее выгодны в энергетическом отношении, но очень далеки от структур исходных компонентов, то возникают кинетические трудности прямого перехода исходных соединений в эти структуры. Поэтому первыми в таких условиях будут появляться промежуточные, близкие по структуре к исходным, соединения, хотя энергетически они менее выгодны. По этой причине промежуточные соединения всегда термодинамически неустойчивы и стремятся превратиться в другие, более устойчивые в данных условиях, но тоже промежуточные фазы. Это происходит до тех пор, пока система не перейдет к состоянию, характеризующемуся минимумом запаса свободной энергии.
Обосновывать и прогнозировать состав клинкерных фаз в процессе обжига позволяют данные термодинамического анализа. Так, в системе СаОSiO2 наблюдается следующая последовательность синтеза силикатов кальция:
3CaО + SiO2 |
2CaO.SiO2 |
3CaO.2SiO2 |
CaO.SiO2 |
|
2 CaO.SiO2.CаO(C3S) |
(15) |
|
Реакции образования силикатов кальция начинаются с поверхности контактных зон кристаллов СаО и SiO2. Скорость диффузии ионов Са2+ в решетку кристалла SiO2 на несколько порядков выше, чем ионов Si4+ в решетку СаО. При избытке ионов Са2+ в начальный момент создаются
условия для разрыва связей –Si-O-Si- |
в поверхностном слое кристаллов SiO2 |
|
с образованием силикатов кальция неупорядоченной структуры. |
||
Образование минералов в системе СаО-Al2O3 |
происходит в следующей |
|
последовательности: |
|
|
3СаО + Al2O3 |
CaO.Al2O3 |
5CaO.3Al2O3 |
|
3CaO.Al2O3. |
(16) |

- 63 -
При этом механизм твердофазного синтеза можно представить следующим образом. Ионы Са2+ диффундируют в решетку Al2O3 и вызывают разрыв связей Al-O-Al c образованием моноалюмината кальция. Это соединение характеризуется пространственной связью октаэдров AlO6 9- и тетраэдровAlO4 5- с помощью катионов Са2+.
В системе СаО-Fe2O3 предполагается встречная диффузия катионов Fe2+, Fe3+ и катионов Са2+. Последовательность ступенчатого процесса
образования минералов имеет вид |
|
|
|
2 СаО + Fe2O3 |
CaO.Fe2O3 |
2CaO.Fe2O3. |
(17) |
В трехкомпонентной системе СаО-Al2O3-Fe2O3 образуются твердые |
|||
растворы алюмоферритов кальция с общей формулой 6СаО .xAl2O3 |
.yFe2O3. |
||
Их синтез осуществляется также ступенчато через промежуточные стадии: вначале образуются соединения 5СаО .3Al2O3 и 2CaO.Fe2O3 , а затем в результате реакции между этими минералами и СаО кристаллизуются алюмоферриты кальция различного состава, в том числе и 4СаО . Al2O3 .
Fe2O3 .
С точки зрения термодинамики реакции образования клинкерных минералов из оксидов возможны уже в интервале температур 600-850 0С (энергия Гиббса имеет отрицательное значение). Однако, в связи с тем, что исходные компоненты (оксиды СаО, SiO2, Al2O3, Fe2O3) при этой температуре содержатся в незначительном количестве, такие взаимодействия не играют существенной роли. Более предпочтительны будут реакции образования
минерала - С2S |
путем взаимодействия кальцита и метакаолинита: |
|
||
5СаСО3 |
+ Al2O3 |
. 2SiO2 = 2( 2CaO.SiO2) + CaO.Al2O3 + 5CO2 |
|
|
|
|
|
(∆G = - 352,4 кДж/моль). |
(18) |
Появление С2S также связано со следующей реакцией: |
|
|||
40СаСО3 + 7(Al2O3 |
. 2SiO2) = 14( 2CaO.SiO2) + 12 CaO .7Al2O3 + 40СО2 |
|||
|
(∆G = - 1713,2 кДж/моль). |
(19) |
||
Клинкерный минерал 2CaO.Fe2O3 образуется по реакции: |
|
|||
|
2СаСО3 + Fe2O3 = 2CaO.Fe2O3 + 2СО2 |
|
||
|
|
|
(∆G = - 29,7 кДж/моль). |
(20) |
Термодинамические расчеты показывают, что появление 3СаО .Al2O3 , 4СаО .Al2O3 . Fe2O3, при данных температурах невозможно, так как ∆G является положительной величиной. Их образование может происходить только при более высоких температурах обжига.
Что касается появления 3CaO.SiO2 , то расчеты показывают, что энергия Гиббса реакции синтеза этого соединения из оксидов СаО и SiO2 с повышением температуры увеличивается (табл.11).

- 64 –
Таблица 11
Величина энергии Гиббса образования 3СаО.SiO2 при различных температурах
Схема |
Температура, |
Энергия Гиббса, |
реакции |
оС |
кДж/моль |
3СаО + SiO2 |
25 |
-115,15 |
3СаО .SiO2 |
729 |
-33,13 |
|
1127 |
+24,30 |
Этот факт свидетельствует о малой вероятности образования С3S путем непосредственного взаимодействия оксидов в процессе обжига. Реакция образования этого соединения из кальцита и 2СаО.SiO2 также имеет положительную величину ∆G и поэтому невозможна. Получение же 3СаО .SiO2 взаимодействием -С2S и СаОсвоб. термодинамически возможно во всем диапазоне температур: ∆G при 727 0С составляет - 104,5 кДж/моль, при 11270С - 159,6 кДж/моль. Однако, его количество в этих условиях будет невелико, так как несмотря на то, что СаСО3 при этих условиях разложился примерно на 50 %, свободного оксида кальция в материале почти нет, так как он практически мгновенно связывается кислотными оксидами, особенно SiO2, с образованием ортосиликата кальция -С2S.
Необходимо отметить, что при этих температурных условиях уже образуются первичные неустойчивые эвтектические расплавы, которые нарушают чисто топохимическое течение процессов минералообразования. Расплавы появляются в виде тонких пленок на поверхностях частиц сырьевой смеси, богатых примесями железистых, щелочных и сернистых соединений. Такие капельножидкие расплавы существуют непродолжительное время, состав их переменный, но они, тем не менее, ускоряют ход твердофазовых реакций.
При повышении температуры материала до 1050-1200 0С скорость диссоциации СаСО3 превышает скорость связывания СаО; появляется свободная СаО (около 10-12 %). В этих условиях начинают протекать реакции насыщения низкоосновных алюминатов и силикатов кальция до более высокоосновных, иногда промежуточного состава. В это время появляется трехкальциевый алюминат 3СаО .Al2O3 и четырехкальциевый алюмоферрит 4СаО .Al2O3 .Fe2O3.
Реакции образования алюминатов, ферритов, силикатов кальция являются экзотермическими и сопровождаются значительным выделением теплоты (до 420 кДж на 1 кг клинкера). Это приводит к значительному повышению температуры – на 150-200 0С (экзотермическая зона обжига). В итоге возрастает скорость реакции в твердом состоянии. К концу экзотермической зоны температура материала достигает 1300 0С и начинается новый процесс, который получил название спекания, в ходе которого в обжигаемом материале появляется расплав. К этому моменту времени материал состоит из С2S, C3А, C4AF (или С2F) и определенного количества СаОсвоб.
-65 -
5.4.6.Последовательность и механизм жидкофазовых реакций
клинкерообразования
Клинкерные минералы, образовавшиеся в результате реакций в твердой фазе, с появлением расплава претерпевают значительные изменения: одни из них перекристаллизовываются, другие вступают в новые реакции и образуют новые соединения. Механизм этих превращений мало зависит от состава расплава, но их скорость, состав образующихся продуктов определяются именно свойствами жидкой фазы.
5.4.6.1. Условия появления расплава и его состав
Присутствие в шихте примесей и легкоплавких оксидов вызывает появление точечных расплавов уже при температуре 500-800 0С и даже ниже. Это небольшое количество жидкой фазы сохраняется в обжигаемом материале до появления основного количества эвтектического расплава. При температуре 1400 0С в состав расплава полностью переходят Al2O3 и Fe2O3, и количество расплава составляет 26-30 % от обжигаемой массы. Состав эвтектики системы СаО - SiO2 - Al2O3- Fe2O3 при температуре 1338 0С в процентах следующий: СаО – 54,8; SiO2 – 6,0; Al2O3 - 22,7; Fe2O3 – 16,5. В расплаве также содержатся MgO, Na2O, K2O, SO3 и другие примеси.
Причины появления расплава в обжигаемой системе ученые объясняют следующим образом. С повышением температуры возрастает амплитуда колебаний структурных элементов кристаллической решетки от положения равновесия; когда величина амплитуды превысит межатомное расстояние, происходит отрыв ионов. С этого момента начинается переход кристаллического твердого тела в новое агрегатное состояние (жидкое), называемое стадией предплавления. Это состояние характеризуется тем , что вещество испытывает сильное термическое расширение, вызванное удалением ионов и разрывом части химических связей. В результате в кристалле появляются вакансии, которые накапливаются во времени. Выход из решетки анионов, например О2-, приводит к появлению положительной вакансии, отталкивающей окружающие ее положительные катионы Са2+, Si4+ и др., которые смещаются к другим анионам кислорода. Выход катиона сопровождается образованием отрицательной вакансии, отталкивающей от себя анионные группировки. В итоге происходит возникновение остаточных сильных и новых слабых связей, причем количество более слабых связей в решетке возрастает. Процесс скопления вакансий приводит к появлению поверхностей разрыва.
Таким образом, можно сказать, что процесс плавления кристалла рассматривается как накопление в нем вакансий, уменьшение силы химических связей вплоть до их полного исчезновения.
- 66 -
5.4.6.2. Структура расплава
Если с повышением температуры химические связи в решетке кристалла ослабляются постепенно и равномерно, то расплав будет иметь структуру, близкую к структуре исходного твердого тела. В том случае, если кристаллическая решетка расширяется энергично и химические связи в ней рвутся быстро и неравномерно, то вблизи точки плавления в кристалле возникают хаотически расположенные микроучастки метастабильной жидкой фазы. Кристалл после этого сразу же переходит в жидкость частично или полностью.
В процессе плавления кристаллов в расплав переходят не отдельные атомы, а их группировки – блоки и, естественно, что координационное число ионов в этих блоках становится меньше, чем в исходных кристаллах, так как атомные группировки имеют локальные разрежения (вакансии, «дырки»). С повышением температуры количество таких вакансий увеличивается и, следовательно, в блоках продолжает уменьшаться координационное число. В итоге расплав стремится к «истинному раствору». Но, тем не менее, клинкерные жидкие фазы будут представлять собой структурированные жидкости, так как в них всегда есть некоторое количество структурных образований (агрегатов, групп, кристаллитов).
Если рассмотреть в расплаве катионы по характеру их связи с
анионами, то можно выделить две группы: с преимущественно ковалентной связью – Si4+, Al3+, P5+, B3+ и преимущественно с ионной связью – Са2+, Mg2+,
Na+, Mn2+, Fe2+ и др. По этому признаку ионы первой группы склонны к образованию комплексов разнообразных форм и размеров (цепи, кольца); ионы второй группы могут существовать в расплаве в виде изолированных групп типа МеОх у-, например СаО6 10- . В связи с этим кремнезем находится в расплаве в виде устойчивых кремнекислородных группировок; группировки окружены ионами Са2+, Mg2+, Fe2+ и др., стремящимися «отобрать» ионы кислорода, чтобы образовать с ними свои собственные структуры. Под энергичным воздействием ионных сил цепи (-Si-O-Si-) разрываются и возникают более слабые цепи (-Si-O-Me-). При большом содержании ионов-модификаторов F+, B+, Mn2+, Fe3+ и др., число разрывов увеличивается и анионные комплексы становятся представленными более простыми структурами, вплоть до обычного тетраэдра SiО4 4-. Такие анионы устойчивы в присутствии Са2+ и образуют с ними комплексы. Что касается иона алюминия, то он может в расплаве существовать как в виде катионамодификатора, так и в виде анионных комплексов AlО2 1- и Al3О7 5- , соответствующих соединениям СаО.Al2O3 и 5СaO.Al2O3, а также в виде анионных комплексов алюмосиликатного типа.
Таким образом, расплав представляет собой ионную жидкость, в которой ионы оказывают взаимное поляризующее воздействие на электронные оболочки, причем наиболее сильно деформируется оболочка кислорода. Взаимная поляризация ионов существенно влияет на характер
- 67 -
взаимодействия и расположения анионов и катионов в расплаве. Пары анион
– катион, энергия взаимодействия которых более высока, чем остальных пар, будут чаше находиться в соседстве друг с другом, вызывая в итоге неравномерность распределения ионов в массе расплава (микрогетерогенность). Слабо взаимодействующие между собой ионы вынуждены в этом случае концентрироваться в определенных микрообъемах, усиливая микронеоднородность состава и структуры расплава.
5.4.6.3.Физико-химические основы образования новых клинкерных фаз в расплаве
До сих пор мы рассматривали процессы клинкерообразования до температуры 1300оС, результатом которых явилось получение следующих
минералов: 3СаО . Al2O3, 4CaO . Al2O3 . Fe2O3, 2CaO . SiO2. Однако обжиг продолжают до температуры 1450оС с целью получения главного минерала цементного клинкера – трехкальциевого силиката 3СаО . SiO2, появление которых связывают с образованием жидкой фазы – расплава.
Расплав образуется на частицах обжигаемого материала в виде пленок различной толщины и размеров. К этому моменту времени обжигаемые зерна представляют собой конгломерат несовершенных по структуре кристаллов различных минералов. Появившийся расплав, прежде всего, склеивает кристаллы в зернах и сближает их за счет действия сил поверхностного натяжения жидкости. Это явление получило название спекания. В начальный момент спекания в расплав переходят более легкоплавкие минералы С3A, C4AF1) (их называют минералами-плавнями), оксиды MgO и CaO, а затем С2S. Таким образом, реакционной средой, в которой происходит синтез С3S, является трехкомпонентная система: клинкерный расплав, в котором равномерно распределены кристаллы СаО и С2S.
Процесс синтеза С3S представляется как совокупность следующих превращений: миграция расплава в зерна оксида кальция и С2S, растворение контактных зон и диспергирование макрочастиц на отдельные блоки, растворение микрокристаллов СаО и С2S, которые при переходе в расплав диссоциируют на ионы Са2+ , О2- и кремнекислородные анионы SiO4 4-. Завершающим этапом является диффузия образовавшихся ионов от растворяющихся кристаллов к зонам роста кристаллов новой фазы С3S. Обычно образование С3S рассматривается в ионной форме:
Са2+ + О2- + SiO4 4- С3S (21)
С3S (21)
При этом принято как аксиома, что при синтезе трехкальциевого силиката исходные компоненты (СаО и С2S) растворяются в расплаве одновременно. Однако это предположение, как показывают современные исследования, не
____________________________________________________
Примечание 1)- здесь и далее для клинкерных минералов 3СаО . SiO2,
2CaO . SiO2, 3CaO . Al2O3, 4CaO . Al2O3 . Fe2O3
используются обозначения: С3S, C2S, C3A, C4AF
- 68 -
имеет достаточно серьезного физико-химического обоснования. Высказываемые сомнения связаны с тем, что первоначально образующийся клинкерный расплав имеет более высокую основность (см. табл.12), чем соответствующая эвтектика: 2,56 вместо, например, 2,34 для минерального состава равновесного расплава, состоящего из С2S – 16 %, C3S – 1,6 %, C3A – 32,3 %, C4AF – 50,1 %. Причина такого явления заключается в том, что сырьевая смесь всегда содержит избыток СаО, предназначенный для образования основного ортосиликата кальция. В этих условиях алюмоферритная фаза образует вторичные твердые растворы по реакции:
С4AF + CaO  C6-xAF, где 0 х2. (22)
C6-xAF, где 0 х2. (22)
В образовавшемся высокоосновном неравновесном расплаве растворяются дополнительные (сверх равновесных 16 % для С2S, входящего в состав эвтектики) количества С2S по реакции:
3(4,67СаО . Al2O3 .Fe2O3) + 2C2S = 2C3S + 3C4AF. (23)
Таким образом, состав алюмоферритной фазы и всего клинкерного расплава приходит как бы в исходное состояние.
Рассмотренный двухстадийный цикл образования С3S повторяется до полного усвоения свободного оксида кальция и завершения синтеза С3S. Естественно, что состав С6-хAF, количество СаО, усвоенного за одни цикл, количество таких циклов могут изменяться в значительных пределах в зависимости от конкретных условий, но суть остается одна: рассмотренные особенности не отрицают процессов растворения исходных компонентов и синтеза С3S, а лишь уточняют характер химического взаимодействия твердофазных компонентов С2S и СаО с клинкерным расплавом. И если диффузия лимитирует кинетику процесса синтеза С3S в расплаве, то кислотно-основные соотношения определяют возможность и пределы его осуществления.
Движущей силой процесса является разность электроотрицательностей взаимодействующих компонентов. В результате химических реакций, протекающих при обжиге, электроотрицательности реагентов и фаз системы стремятся к выравниванию.
При этом обнаруживаются следующие закономерности:
образование С3S в расплаве возможно только в том случае, если основность расплава становится в определенный момент выше основности расплава в равновесном состоянии;
повышение основности расплава, то есть введение дополнительного количества СаО в расплав, происходит в результате химического взаимодействия последнего с расплавом; тем самым подтверждается известный принцип Юнга: сначала повышается основность алюмоферритной фаз с образованием высокоосновных твердых растворов и лишь затем увеличивается основность белита до алитовой фазы;
