
учебное пособие химия цемента
.pdf- 49 -
Представленная реакция обратима, но лишь при определенных условиях протекает в сторону образования оксида кальция (СаО) – основной составляющей извести. Этот химический процесс возможен только при относительно высоких температурах обжигаемого материала и давлении углекислого газа в среде обжига: чем оно ниже, тем интенсивнее идет процесс диссоциации. Величину давления СО2, соответствующую условию равновесного сосуществования всех трех компонентов реакции (СаСО3, СаО, СО2), принято называть давлением диссоциации. Естественно, что давление СО2, выделяющегося при реакции, должно превышать давление СО2 в среде обжига. При обычных температурах разложение СаСО3 невозможно, поскольку давление диссоциации ничтожно мало. Чтобы процесс разложения протекал с достаточной скоростью, необходимо, чтобы температура (называется температурой декарбонизации) была выше 880 0С. Такая температура соответствует давлению диссоциации углекислого газа, равному
0,1 МПа.
Диссоциация карбонатов начинается с распада ионов СО3 2- по схеме:
СО3 2-  СО2 + О2-. (8)
СО2 + О2-. (8)
Образуются нейтральные молекулы газообразного СО2 и анионы кислорода, которые, соединяясь затем с катионами кальция, образуют новую фазу – оксид кальция (СаО), располагающуюся в пределах исходного кристалла СаСО3. Процесс диссоциации углекислого кальция протекает по топохимическому механизму.
Таким образом, можно предполагать, что при обжиге известняка протекают параллельно или параллельно-последовательно процессы разрушения кристаллической решетки СаСО3, разложения сложных анионовСО3 2-, образование кристаллической решетки СаО. Вместе это составляет кристаллохимическую сторону явления диссоциации углекислого кальция. Распад анионов и последующее разрушение кристаллической решетки исходного вещества возможны лишь при определенных условиях, когда составляющие кристаллическую решетку частицы накопили достаточный запас кинетической энергии, необходимой для разрушения существующих связей и образования новых. Поэтому, в первую очередь это будет касаться тех карбонат-ионов, в которых группы СО3 2- имеют энергетический потенциал, достаточный для отрыва аниона О2-. Чтобы произошел такой отрыв, необходимо молекуле углекислого газа успеть удалиться от аниона кислорода на достаточное расстояние за период времени, соизмеримый с частотой колебания частиц в кристаллической решетке. Такие условия в первую очередь создаются на поверхности кристалла СаСО3. Способствовать распаду будет также силовое поле катионов Са2+, которое деформирует анион СО3 2-. Наиболее выгодными для осуществления процесса распада карбонат-ионов являются те места поверхности кристалла, где имеются
наибольшие |
искажения кристаллической решетки (вакансии, дислокации). |
Именно там |
связи между частицами наиболее ослаблены, а запас кинети- |
- 50 -
ческой энергии достаточно высок. Как уже неоднократно отмечалось, такие места получили название активных центров поверхности.
Таким образом, распад карбонат-ионов является первым, начальным этапом процесса диссоциации СаСО3.
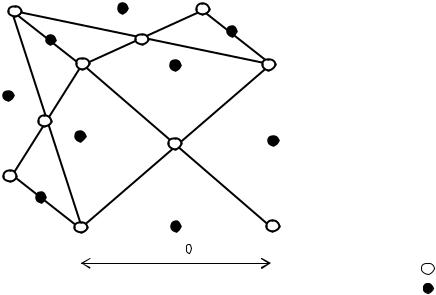
Вторым, основным, этапом является превращение гексагональной решетки кальцита в кубическую решетку оксида кальция с уменьшением ее объема почти в 2,25 раза. На рис.12 представлена кристаллическая структура оксида кальция.
|
|
|
|
|
|
Рис. 12. Схема кристалли- |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
ческой структуры (элементар- |
|
|
|
|
|
|
|
ной ячейки) оксида кальция |
|
|
|
|
|
|
|
Обозначения: |
|
|
|
|
4,79 А |
|
Са2+; |
||
|
|
|
|
- |
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
- |
О2- |
|
|
|
|
|
|
||
Ребро куба элементарной ячейки СаО имеет длину 0,479 нм. |
|
||||||
Последовательность процесса превращения решетки СаСО3 |
в решетку |
||||||
СаО представляется примерно следующей. По мере развития распада карбонат-ионов СО3 2- происходит увеличение концентрации ионов О2- в поверхностном слое, что ведет к искажению этого участка решетки. Но, если хемодесорбция, то есть удаление в газовую фазу молекул СО2, протекает относительно легко и быстро, то диффузия ионов кислорода в исходный продукт затруднена из-за небольшой подвижности этих ионов в кристаллической решетке СаСО3 и высокой энергии связи этих ионов с катионами кальция. Поэтому возникновение зародышей новой фазы – СаО вначале будет идти замедленно и лимитирующим процессом является именно диффузионное перемещение ионов О2-, необходимых для формирования новых граней решетки СаО.
Отметим, что возникающая фаза находится в дисперсном состоянии и характеризуется высокой поверхностной энергией, что свидетельствует о термодинамической неустойчивости (метастабильности) образовавшихся частиц СаО.
Дальнейшее развитие процесса идет на границе раздела поверхностей СаО и СаСО3, так как вследствие деформирующего влияния СаО на образующейся поверхности легче идет распад группы СО3 2- . С появлением

- 51 -
границ раздела процесс диссоциации ускоряется и приобретает автокаталитический характер. «Фронт» реакции, определяющий положение макроскопической границы исходной фазы – СаСО3 и новой фазы – СаО, будет состоять как из вновь появившихся, так и из растущих частичек оксида кальция.
Скорость реакции диссоциации, достигнув максимального значения, соответствующего наибольшей поверхности раздела, начинает замедляться. Этому процессу способствует утолщение внешнего слоя, состоящего из СаО. Наступает момент, когда диффузия молекул СО2 через этот слой может стать лимитирующей стадией. Необходимость активизации процесса разложенияСО3 2- и диффузии молекул углекислого газа требует повышения температуры обжига выше 1000 0С.
Вообще роль температуры не сводится только к увеличению скорости образования СаО. О.П.Мчедловым-Петросяном изучено изменение свойств извести при повышении температуры обжига до 1000 0С и выше. Установлено, что изменения свойств извести связаны с видом валентных связей Са-О. При повышении температуры доля ионной связи в решетке СаО возрастает (доля ковалентности соответственно уменьшается) и достигает максимума при температуре около 1200 0С. Увеличение степени ионности в молекулах, как известно из кристаллохимии, сопровождается повышением потенциальной энергии. Следовательно, энергия кристаллической решетки СаО и ее химический потенциал будут увеличиваться. Известь, полученная при таких условиях, отличается максимальной реакционной способностью. Однако, при наличии в сырье оксидов железа, кремния и др. при повышенных температурах обжига появляются условия для получения частиц пережженной извести, что значительно ухудшает ее свойства.
5.3. Особенности процессов, протекающих при получении магнезиальных вяжущих веществ
Для получения магнезиальных вяжущих используются магнезит MgCO3 и доломит – двойная соль СаСО3. MgCO3.
Диссоциация карбоната магния протекает аналогично процессу
разложения кальцита: |
|
|
MgCO3 (тв.) |
MgО(тв.) + СО2 (газ) |
(9) |
Но природа катиона в кристаллической решетке исходного соединения оказывает существенное влияние на величину энергии активации, необходимой для разложения аниона СО3 2-. Известно, что в ряду карбонатов температура разложения закономерно повышается с переходом от иона магния к иону бария в последовательности, представленной в табл.4, а устойчивость аниона СО3 2- закономерно понижается с увеличением электростатического взаимодействия катиона с анионом О2-. В связи с этим катион Mg2+, обладающий наименьшим радиусом в этом ряду

|
|
|
- 52 - |
( r |
|
|
0,037нмrMg2+), будет оказывать более сильное действие по |
Mg |
2 |
|
|
|
|
|
сравнению с другими катионами и, следовательно, будет энергичнее притягивать ионы кислорода при образовании оксида магния. Поэтому для разложения MgCO3 в процессе обжига потребуется более низкая температура, чем для СаСО3 – в пределах 600-650 0С.
По форме оксид магния обладает такой же кристаллической решеткой, как и СаО, то есть кубической. Однако, кристалл MgO, по сравнению с оксидом кальция, имеет несколько меньшие размеры и большую плотность (см. таблицу 9). Это обуславливает меньшую гидравлическую активность МgO, в связи с чем его затворяют не чистой водой, а растворами некоторых солей.
Таблица 9
Характеристики кристаллических решеток оксидов кальция и магния
Кристалл |
к.ч. |
Размер ребра, |
Сумма ионных |
|
|
нм |
радиусов, нм |
СаО |
6 |
0,479 |
0,24 |
MgO |
6 |
0,420 |
0,21 |
Продукт диссоциации доломита СаСО3.MgСО3 отличается слоистостью вследствие наличия в его структуре катионов двух типов: Са2+ и Mg2+. Соответственно, в процессе разложения доломита различают две стадии. На первой стадии обжига в результате большей активности иона магния происходит распад доломита на две новые фазы: карбонат кальция и оксид магния по формуле
СаMg(CO3)2 = CaCO3 + MgO +CO2 (газ) |
(10) |
На второй стадии идет разложение СаСО3 на оксид кальция и углекислый газ
СаСО3  СаО + СО2 (газ) (11)
СаО + СО2 (газ) (11)
Температура, необходимая для полного разложения доломита, превышает температуру диссоциации чистого магнезита и составляет около 730 0С. Вместе с тем, она ниже, чем температура разложения чистого СаСО3. Это объясняется тем, что ион Mg2+, вследствие малого радиуса, значительно сильнее деформирует ионы СО3 2- , чем ионы кальция. Поэтому карбонатион ослабляется и в доломите разлагается на СО2 и О2- легче, чем в СаСО3. В кристаллической решетке доломита, где чередуются слои ионов Mg2+, СО3 2- и Са2+, первыми распадаются ионы СО3 2- , окруженные ионами магния; ионы же СО3 2- , находящиеся в окружении ионов Са2+, более устойчивы и разрушаются позже, при более высоких температурах обжига.
- 53 -
5.4. Физико-химические основы получения портландцементного клинкера
5.4.1.Общая характеристика сырья
Втехнологии портландцемента получение клинкера является наиболее сложным в химическом отношении процессом, цель которого – обеспечить заданный фазовый (минералогический) состав цемента.
Вкачестве основных сырьевых компонентов для получения клинкера обычно используется смесь карбонатных пород с высоким содержанием углекислого кальция и глинистых пород, содержащих в своем составе водные алюмосиликаты и примеси в виде кремнезема, оксидов железа и др. Глина
обеспечивает сырьевую смесь (шихту) кислотными оксидами: SiO2, Al2O3, Fe2O3, а поставщиком ионов Са2+ при синтезе клинкерных минералов являются известняк, мел и т.п. Часто приходится вводить корректирующие добавки, чтобы состав клинкера не отличался от заданного. В качестве таких добавок используют вещества с высоким содержанием или оксида железа (пиритные огарки и др.), или глинозема (бокситы), или оксида кремния в активной (аморфной) форме (трепелы, опоки и др.). В природе довольно часто встречаются известково-глинистые породы – мергели, представляющие собой смесь мельчайших частиц углекислого кальция и глинистых
минералов в требуемых для получения клинкера соотношениях и являющиеся поэтому наиболее ценным и высококачественным сырьем. Шлаки – продукты кристаллизации и грануляции различных расплавов (отходы металлургической и энергетической промышленности) также являются ценным сырьем для цементной промышленности.
Состав и особенности структуры глинистых минералов
Глинами называют тонкодисперсные осадочные породы природного происхождения, в состав которых входят глинистые минералы, кварцевые, железистые, алюмосодержащие оксиды и др.
Глинистые минералы (каолиниты, монтморрилониты, гидрослюды) являются главной, самой высокодисперсной составляющей глин. Они имеют, как правило, кристаллическое строение. Некоторые глины включают один вид глинистого минерала, но во многих из них присутствует смесь этих минералов. В зависимости от типа глинистого минерала химический состав глины будет сильно изменяться. Глинистые минералы обладают
способностью сорбировать на поверхности своих частиц некоторые катионы
(Са2+, Mg2+, H+, K+, Na+. NH4+) и анионы (SO42-, Cl-, PO43-, NO3-) и, слабо удерживая их, вновь отдавать при определенных условиях. Такие ионы
получили название обменных.
- 54 -
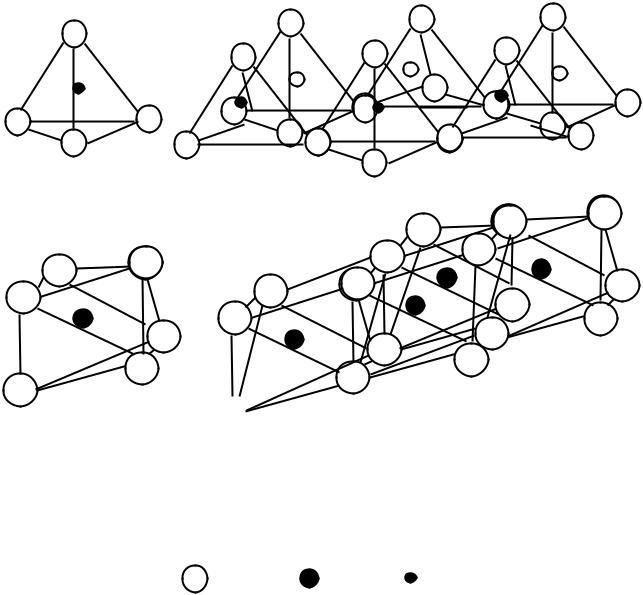
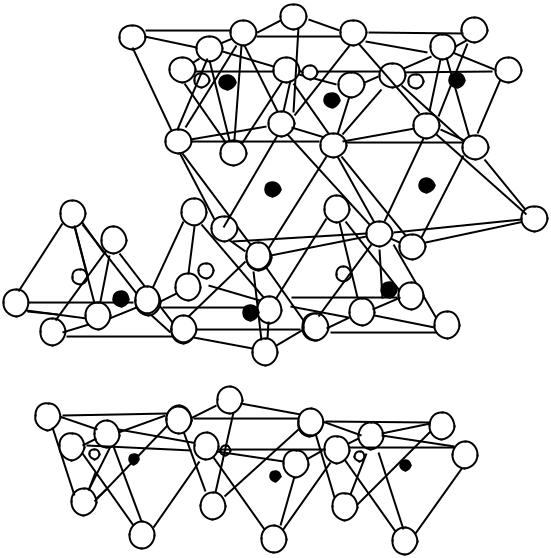
Наиболее часто в цементной промышленности применяются глины, в которых основными минералами являются каолинит и монтмориллонит. В них различают два структурных элемента: кремнекислородный (тетраэдрический) и алюмокислородный (октаэдрический). На рис.13 представлено схематическое изображение слоев, состоящих из этих элементов.
1 |
2 |
3  4
4
Рис.13. Схематическое изображение кремнекислородного (тетраэдрического) и алюмокислородного (октаэдрического) слоев
Обозначения: тетраэдрический: 1 – отдельный тетраэдр; 2 – сетка тетраэдров;
октаэдрический: |
3 – отдельный октаэдр; 4 – сетка октаэдров |
|
- О2- ; |
- Al3+; |
- Si4+ |
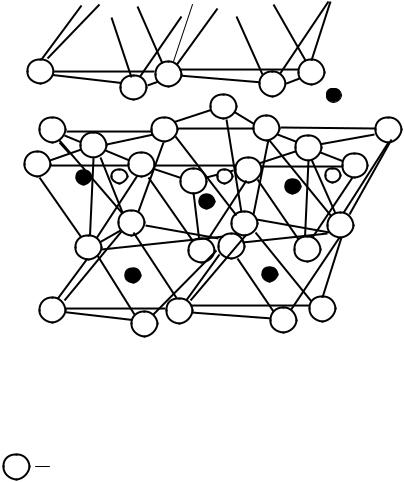
Химическая формула каолинита – Al2O3.2SiO2.2H2O, он имеет слоистую структуру. Каждый слой состоит из двух сеток: одна - из тетраэдров SiO4 4-, вторая - из алюмокислородногидроксильных октаэдров. Тетраэдры и октаэдры соединены вершинами через атомы кислорода. Схематическое изображение структуры каолинитового слоя представлено на рис.14.
В каолинитовом слое нижняя сетка представлена ионами гидроксила ОН-, средняя – анионами О2- и ОН-, а верхняя – анионами кислорода. Между нижней и средней сетками расположены катионы Al3+, а между средней и верхней – катионы Si4+ (часть которых замещена на катионы алюминия).
- 55 -
3
он |
он |
он |
|
ОН |
ОН |
2
1 |
|
он |
он |
он |
он |
|
он |
он |
Рис.14. Схематическое изображение структуры каолинитового слоя
Обозначения:1 – полный слой; 2 – межслоевое пространство;
3 – начало второго слоя
О2- ; 
 Si4+ ;
Si4+ ; 
 Al3+
Al3+
Сетки из О2- и ОН- соприкасаются, и между анионами возникает водородная связь, которая удерживает их друг около друга. В структуре пакета, состоящего из двух слоев, прослеживается бесконечная цепь (-Si-O-Al-O-Si- O-)n, в которой элементы связаны ковалентно.
Монтмориллонит, в отличие от каолинита, относится к минералам с трехслойным типом решетки. Его химическая формула – Al2O3.4SiO2.nН2O. В одном полном слое (пакете) два наружных слоя образованы кремнекислородными тетраэдрами, а средний – алюмокислородногидроксильными октаэдрами (рис.15).
Тетраэдрические и октаэдрический слои в пакете соединены таким образом, что вершины тетраэдров (кислород) и октаэдров (гидроксил) образуют общую сетку ионов. Всего в слое четыре сетки: верхняя и нижняя содержат О2-, две средние – ОН- и О2-. Между сетками из анионов располагаются катионы Si4+ и Al3+. В структуре одного пакета прослеживается цепь (-Si-O-Si-O-Al-O-Si-O-)n с ковалентной связью элементов.
В монтмориллоните всегда часть атомов кремния в тетраэдрах замещена на атом алюминия, а часть атомов алюминия в октаэдрах – на атомы магния (цинка, железа, никеля, лития и т.п.).
- 56 –
1
2
Обменные катионы, nН2О
3
Рис.15. Схематическое изображение структуры монтмориллонитового слоя
Обозначения те же, что и на рис.14
Таким образом, различие между двухслойными глинистыми минералами (каолинитом) и трехслойными (монтмориллонитом) заключается в том, что первые, характеризуясь более простой структурой, легче отдают воду (их дегидратация начинается при температуре 450-600 0С), а вторые, имея замкнутые пакеты, отдают воду труднее и для их дегидратации необходимы более высокие температуры. Кроме того, каолинит содержит в качестве катиона исключительно ион алюминия, а монтмориллонит – и другие ионы (магния и т.д.), а структурированных гидроксильных ионов в последнем содержится значительно меньше, чем у минералов каолинитовой группы.
Существенным различием рассматриваемых двух групп глинистых минералов является также координация иона алюминия в структуре кристал-
- 57 -
лической решетки: у каолинита эта координация шестерная, у монтмориллонита – и шестерная, и четверная.
О.П.Мчедлов-Петросян, рассматривая основы общей теории активности глинистых минералов, пришел к выводу о том, что именно наличие изначально четверной, термодинамически неустойчивой координации придает монтмориллониту высокую химическую активность. У каолинита такая активность проявляется лишь после обезвоживания, когда потеря ОН-ионов вызывает искусственное понижение координации иона алюминия.
Такое различие в строении и структуре глинистых минералов накладывает отпечаток на поведение глин при нагревании.
5.4.3. Превращения глинистых минералов при нагревании
При нагревании глин происходят процессы дегидратации, которые сопровождаются значительными изменениями в структуре кристаллических решеток глинистых минералов. В результате образуются новые фазы, которые принимают активное участие в синтезе минералов портландцементного клинкера.
Дегидратация, прежде всего, вызывает появление дефектов в структуре кристаллов глинистых минералов, приводящих к увеличению межплоскостных расстояний примерно на 0,01-0,03 нм, а также к появлению пустот и активных центров.
Рассмотрим процесс дегидратации глинистых минералов на примере
каолинита, сначала в виде химической реакции: |
|
|
Al2O3.2SiO2.2H2O (кр) |
Al2O3.2SiO2(кр) + 2H2O (газ). |
(12) |
В результате разложения каолинита образуется каолиновый ангидрит – метакаолинит, характеризующийся неупорядоченной, близкой к аморфной, структурой.
Энергия активации реакции дегидратации каолинита составляет 180 кДж/моль. Эта реакция проходит под диффузионным контролем удаления ионов ОН-. Считается, что обезвоживание связано с перемещением протонов Н+ и образованием особых ионов гидроксила, находящихся в
активном состоянии – (ОН)- *. |
|
|
|
Схематично это можно представить так: |
|
|
|
ОН- + ОН- |
(ОН)- * + (ОН)- * |
Н2О + О2 |
(13) |
Образующаяся в этих условиях в результате дегидратации новая фаза – метакаолинит сохраняет многие признаки структуры каолинита и, в частности, слоистость строения. В то время как исходные кремнекислородные слои остаются неизменными, в алюмогидроксилкислородных слоях уже при нагревании до 600 0С происходят сильные изменения – они превращаются в тетраэдрические, состоящие из элементов AlO4 5- . Ковалентные связи (-Si-O-Al-), имеющиеся в каолините, не разрываются, более того, в метакаолините их число даже

- 58 -
возрастает. Таким образом, в процессе дегидратации каолинита его распад на
оксиды SiO2 и Al2O3 не происходит.
Дальнейший нагрев до температуры 900-1000 0С вызывает перестройку в кристаллической решетке метакаолинита. Перестройка заключается в разрыве слоя из кремнекислородных тетраэдров и частичном повышении координации ионов алюминия по схеме:
|
AlO4 5- |
AlO6 9- . |
(14) |
Процесс протекает |
необратимо |
с выделением теплоты; взамен связей |
|
(-Si-O-Al-) образуются |
новые связи: |
(Al-O-Al) и |
(Si-O-Si), появляются |
изолированные тетраэдры муллита – силиката алюминия.
Подводя итог вышесказанному, можно представить следующие обобщения (табл.10) относительно тех изменений, которые происходят с глинистыми минералами в процессе обжига портландцементного клинкера при нагревании до 1000 0С.
|
|
|
|
|
Таблица 10 |
Изменения глинистых минералов при нагревании |
|||||
|
|
|
|
|
|
Минерал, |
|
Т е м п е р а т у р а, 0С |
|
||
его химическая |
|
|
|
|
|
формула |
100-200 |
|
600-800 |
|
850-1000 |
Каолинит, |
удаление |
|
удаление основной |
|
удаление следов |
Al2O3.2SiO2.2H2O |
свободной |
|
массы воды в виде |
|
ОН-ионов |
|
воды |
|
координированных |
|
и перестройка |
|
|
|
ионов ОН- |
|
решетки |
|
|
|
(образование |
|
(причина |
|
|
|
метакаолинита – |
|
экзотермичес- |
|
|
|
Al2O3.2SiO2), |
|
кого эффекта), |
|
|
|
искажение |
|
обычно с |
|
|
|
координации |
|
частичным |
|
|
|
атомов алюминия |
|
отщеплением |
|
|
|
|
|
SiO2, иногда с |
|
|
|
|
|
образованием |
|
|
|
|
|
муллита |
Монтмориллонит, |
удаление |
|
удаление |
|
удаление |
Al2O3.4SiO2.nH2O |
свободной и |
|
межпакетной |
|
координирован- |
|
адсорбиро- |
|
воды |
|
ных ОН-ионов, |
|
ванной воды |
|
|
|
перестройка |
|
|
|
|
|
решетки с |
|
|
|
|
|
выделением |
|
|
|
|
|
шпинели и |
|
|
|
|
|
стекла |
