
учебное пособие химия цемента
.pdf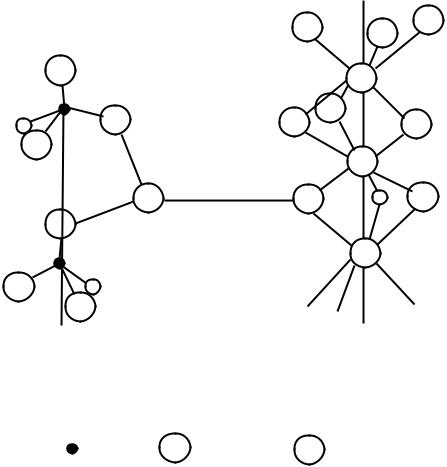
- 39 -
искаженном виде. С точки зрения последовательности образования силикатных фаз в процессе обжига цементного клинкера получение алита можно рассматривать как насыщение белита избыточной известью.
Таким образом, в структуре основного ортосиликата – Са2SiO4.CaO, как и в структуре ортосиликата – Са2SiО4, содержатся те же кремнекислородные ионы SiO4 4- , но они дальше удалены друг от друга, так как между ними «внедрились» и ионы кальция, и ионы кислорода.
а) |
|
|
б) |
Рис.8. Схема двух главных элементов структуры основного |
|||
|
ортосиликата кальция |
|
|
а) – ортосиликатный; |
б) - кальцийкислородный |
||
Обозначения: |
|
|
|
- Si4+; |
- |
O2-; |
- Ca2+ |
Здесь уместно обратить внимание и на следующее обстоятельство. В извести межатомное расстояние Са-О равно 0,241 нм, в то время как в кальцийкислородном «мотиве», находящемся в структуре С3S, это расстояние составляет от 0,235 до 0,324 нм, то есть является величиной переменной. Это говорит о том, что в одном случае имеет место уменьшение длины связей Са-О, а в другом – их увеличение. В результате наблюдается сильная деформация кристаллической решетки основного ортосиликата кальция, что вызывает появление в ней напряженного состояния, как основного фактора повышенной активности этого соединения. Кроме того, структурный многогранник кислорода – правильный октаэдр – в решетке С3S сильно искажен: ионы кальция расположены вокруг иона кислорода таким образом, что пять из них находятся в одной полусфере, а один ион кальция – в другой, в результате чего возникает зазор между полусферами, равный 0,02 нм.

- 40 -
Изложенные структурные особенности выявлены на синтезированном («чистом») трехкальциевом силикате. В реальных цементах трехкальциевый силикат составляет основу так называемой «алитовой фазы», представляющей собой С3S, модифицированный в определенной степени (около 4 %) элементами примесей. Обычно замещение происходит
следующим образом: |
2 Si4+ |
2Al3+ + Mg2+ |
(5) |
||
Замещение повторяется один раз в каждых восемнадцати молекулах |
|||||
С3S, и поэтому формулу алита можно записать так: |
|
||||
|
54СаО . 16SiO2 |
. Al2O3 |
. MgO. |
|
|
В этом соединении ионы «внедрившегося» алюминия, имея меньшую валентность, не могут столь прочно удерживать электроны иона кислорода, как ионы кремния. В силу меньшей устойчивости тетраэдр AlO4 5- разрушается легче, чем SiO4 4-.В свою очередь, под влиянием внедрившегося иона магния электронная оболочка иона кислорода, входящего в состав алюмокислородного тетраэдра AlO4 5- , будет смещаться, и происходит перераспределение электронной плотности. Это приводит к искажению («неправильности») электрического поля в решетке алита. Кроме того, связь Mg-O по сравнению с Са-О имеет меньшую энергию, и она легче разрушается. Все это приводит к тому, что алит значительно активнее гидратируется водой по сравнению с белитом.
Подобные, и даже большие по количеству, изоморфные замещения характерны и для других минералов портландцементного клинкера: трехкальциевого алюмината – С3А (около 12%) и четырехкальциевого алюмоферрита - С4АF (около 10 %). Большее замещение связано со своеобразием их структур, в которых имеются крупные полости (в кристаллической решетке С3А их радиус составляет около 0,147 нм), облегчающие осуществление гетероизоморфных замещений и размещение в
них таких крупных катионов, |
как, например, Na+. |
Октаэдрические позиции Al3+ удобны и для размещения Fe3+. |
|
Результатом таких замещений |
является искажение структуры «чистого» |
3СаО.Al2O3, а, следовательно, и изменение его свойств. Известно, что трехкальциевый алюминат является самым активным минералом портландцементного клинкера.
Ряд активности минералов портландцементного клинкера имеет вид:
С3А  С4АF
С4АF  C3S
C3S  -C2S
-C2S
Кристаллическая решетка четырехкальциевого алюмоферрита содержит четыре «удобные» для замещений позиции: две октаэдрические и две тетраэдрические, нарушающие электростатику и микросимметрию его структуры. Обычно четырехвалентные Si4+ и Ti4+ способны занять позиции в тетраэдрах вместо трехвалентных Al3+ и Fe3+ , а Mg2+, Mn3+,Ti4+ - в октаэдрах. Возникающие искажения структуры столь значительны, что С4AF оказывается плохо закристаллизованным и даже частично аморфизированным.
- 41 -
Таким образом, подводя итог вышесказанному, можно отметить, что причины проявления вяжущих свойств различных соединений и основы их активности заключаются в целом комплексе кристаллохимических параметров и энергетических проявлений.
Систематизируя все вышесказанное, можно выделить следующие основные критерии оценки способности различных систем проявлять вяжущие свойства (табл.8).
Таблица 8
Критерии оценки вяжущих свойств различными соединениями
|
Тип критерия |
|
Цель использования критерия |
||
Положение |
катионобразующего |
для |
оценки |
свойств |
вяжущих |
элемента в |
периодической системе |
гидратационного твердения |
|
||
Менделеева |
|
|
|
|
|
Отношение |
радиуса катиона и |
для |
оценки |
свойств |
вяжущих |
аниона, |
электроотрицательность |
гидратационного твердения |
|
||
элемента |
|
|
|
|
|
Ионный потенциал катиона |
для |
оценки |
проявления |
вяжущих |
|
|
|
свойств системой «оксид-кислота» |
|||
Окислительно-восстановительный |
для |
оценки |
проявления |
вяжущих |
|
потенциал металла |
свойств системой «металл-кислота» |
||||
Анализируя эту таблицу, можно отметить тесную связь кристаллохимических параметров с возможностью отвердевания системы «порошок-жидкость затворения». Не менее важную роль в степени проявления вяжущих свойств играют также такие факторы, как наличие «нерегулярной» координации (например, у иона Са2+ в силикатных системах), «открытость» (наличие пустот) кристаллической структуры клинкерных минералов, их способность к изоморфным замещениям, приводящим к искажению кристаллической решетки, «неправильность» электростатического поля, как результат этого явления и другие факторы.
Заключение к четвертой главе
Содержание четвертой главы по своей сути продолжает и развивает применительно к вяжущим веществам физико-химические представления, содержащиеся в третьей главе.
Замечательным является то, что ученым-материаловедам удалось преломить основополагающие проблемы строения вещества, кристаллохимии и кристаллографии на практические вопросы получения и применения вяжущих веществ. В этом ряду, прежде всего, следует отметить применимость периодического закона Д.И.Менделеева, вплоть до энергетических уровней атомных орбиталей, формирования структур кристаллических фаз с определенной степенью «вяжущей» активности.
- 42 -
5. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПОЛУЧЕНИЯ ВЯЖУЩИХ ВЕЩЕСТВ ГИДРАТАЦИОННОГО ТВЕРДЕНИЯ
Основное свойство вяжущих веществ «твердеть» приобретается ими в процессе нагревания (обжига) до различных температур определенных сырьевых материалов природного или техногенного происхождения.
Опираясь на физико-химические представления о процессах отвердевания вяжущих веществ, мы можем хотя бы в общих чертах сформулировать основные цели тепловой обработки (обжига), причем представить это с различных научных позиций.
С термодинамической точки зрения процесс обжига – это повышение общего энергетического потенциала; с химической – повышение химического потенциала вяжущего вещества как компонента химически реакционной системы; с кристаллохимических представлений – создание метастабильных дефектных структур, способных в процессе отвердевания под воздействием воды или другого жидкого компонента перестраивать свою структуру с достижением термодинамически (в том числе и химически) устойчивого состояния, что в итоге позволяет обеспечить заданные строительные свойства получаемого камневидного материала.
Температура и другие условия тепловой обработки (обжига) будут, безусловно, различными в зависимости от того, какой вид вяжущего мы намерены получить, какого состава сырье используется.
В зависимости от температуры тепловой обработки вяжущие вещества строительного назначения можно разделить на вяжущие низкотемпературного обжига (строительный гипс и некоторые его разновидности), умеренно температурного обжига (высокообжиговый гипс, магнезиальные вяжущие, строительная известь), высокотемпературного обжига (гидравлическая известь, романцемент, портландский и глиноземистый цемент). Предложенное деление носит несколько условный характер, но вместе с тем оно вполне подходит для того, чтобы дальнейшее рассмотрение процессов, сопровождающих получение вяжущих веществ, образующихся структурных построений, свойств и т.п. рассматривать в порядке возрастания температуры обжига.
5.1. Процессы, протекающие при обжиге гипсовых вяжущих веществ
Сырьем для получения гипсовых вяжущих обычно служит природный гипс, представляющий собой водную соль сульфата кальция (кристаллогидрат) – СаSO4.2H2O. В качестве сырья могут быть использованы и другие материалы: природный ангидрит – СаSO4, гипсосодержащие отходы – фосфогипс, борогипс и др.
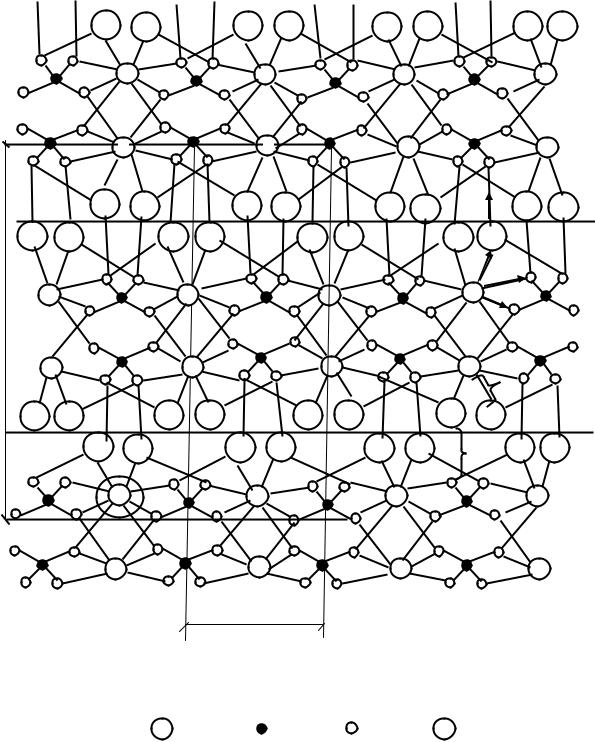
В кристаллической решетке двуводного гипса (рис.9) каждый атом кальция окружен шестью комплексными группами, состоящими из
- 43 -
сsin .10 –10 м
Рис. 9. Схема кристаллической структуры двуводного гипса
Обозначения: |
- Н2О; |
- S4+; |
- O2-; |
- Ca2+ |
|
четырех тетраэдров |
SO4 |
2- |
и двух |
молекул |
воды. Структура |
|
|||||
кристаллической решетки этого соединения слоистая. Слои образованы, с одной стороны, ионами Са2+ и группами SO4 2-, а с другой – молекулами воды. Каждая молекула воды связана как с ионами Са2+, так и с ближним сульфатным тетраэдром. Так как координационное число иона Са2+ в данном случае равно 8, то каждая связь этого иона равна 1/8 его валентности.

- 44 -
Внутри слоя, содержащего ионы Са2+ и SO4 2- имеются относительно прочные (ионные) связи, в то время как в направлении к слоям, содержащим молекулы воды, связь слоев значительно слабее. Поэтому при тепловой обработке двуводный гипс легко теряет воду (процесс дегидратации). На практике этот процесс можно проводить до различной степени его завершенности, и в зависимости от этого получать гипсовые вяжущие различных модификаций с различными свойствами. В зависимости от температуры и длительности обжига можно получить: полуводный сульфат кальция (полугидрат) - и -модификаций, - и -обезвоженные полугидраты, -растворимый и -растворимый ангидриты (иногда их обозначают как -ангидрит), нерастворимый ангидрит. Для практических целей особое значение имеют условия получения модификаций полуводного сульфата кальция (полугидрата).
Реакция дегидратации двуводного гипса с образованием этих
модификаций протекает с поглощением теплоты и имеет вид: |
|
|
CaSO4.2H2O |
( )CaSO4.0,5H2O+1,5H2O - Q |
(6) |
Сегодня является общепризнанным, что образование -или - модификаций полуводного гипса зависит от условий тепловой обработки: - полугидрат образуется при температуре 107-125 0С и выше при условии, что вода выделяется в жидком состоянии, для чего предусматривается автоклавная обработка; -модификация полуводного гипса получается при нагревании до 100-160 0С в открытых аппаратах при удалении воды в виде пара.
Высокопрочный -полугидрат кристаллизуется в виде хорошо образованных крупных прозрачных игл или призм; обычный строительный гипс - -полугидрат состоит из мельчайших плохо выраженных кристалликов, образующих агрегаты. По строению кристаллической решетки они подобны, в отличие от свойств: скорости реакций взаимодействия с водой, водопотребности, плотности и прочности получаемого гипсового камня. Это объясняется различной степенью дисперсности кристаллов двух модификаций полугидрата. В частности -полугидрат обладает более высокой водопотребностью и, соответственно, более низкой прочностью.
В процессе обжига гипсового камня создаются такие энергетические условия, при которых происходит разрыв связей ионов Са2+ и тетраэдров 2- с молекулами воды, в результате чего значительная ее часть высвобождается. Это явление приводит к повышению плотности кристаллов
исходной фазы в результате сжатия кристаллической решетки.
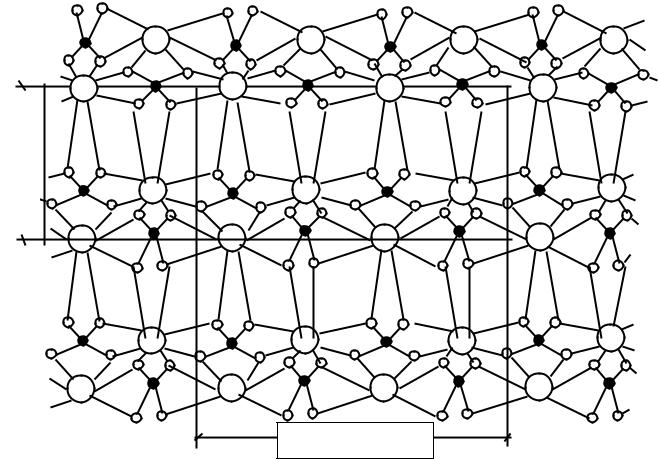
С точки зрения кристаллохимии обезвоживание двуводного гипса до полуводного является фазовым превращением, сопровождающимся перестройкой кристаллической решетки за счет смещения цепочек Са-SO4-Ca-SO4. Смещение происходит на расстояние, равное 0,317 нм, что соответствует длине связи Са-S. При этом цепочки преимущественно
- 45 -
сохраняют свою ориентацию, а смещение происходит перпендикулярно и параллельно их направлению. На рис.10 изображена схема кристаллической решетки полуводного гипса в той же проекции, что и для двуводного гипса на рис.9.
= 6,83.10 –10 м
= 11,94.10-10
Рис. 10. Схема кристаллической структуры полуводного гипса
Обозначения те же, что и на рис.9
Вода в полугидрате CaSO4.0,5H2O находится в полых каналах между слоями Са-SO4-Ca-SO4 и удерживается за счет ближайшего иона кальция и иона кислорода группы SO4 2- (вода как бы защемлена между ними). Она сохраняет прежнюю координацию в кристаллической решетке относительно иона кальция, как и в двуводном гипсе.
Так как большая часть связей оказалась ненасыщенной, то решетка полуводного гипса имеет искаженный вид; это и обуславливает высокую гидравлическую активность данного соединения.
Превращение полугидратов в обезвоженные полугидраты (СаSO4) происходит при дальнейшем их нагревании и не сопровождается заметными изменениями кристаллической решетки, поэтому получаемые продукты называют обезвоженными полугидратами. Тем не менее, в результате удаления остальной кристаллизационной воды упорядоченность и, следовательно, стабильность решетки снижается, пористость значительно возрастает.
- 46 -
Модификации обезвоженного полугидрата существуют в узком интервале температур и практического значения не имеют.
При дальнейшем нагревании (220-300 0С) происходит перестройка кристаллической решетки обезвоженного продукта и образуется растворимый ангидрит -и -модификаций с высокими удельной поверхностью и водопотребностью. Поэтому в технологии гипсовых вяжущих веществ стремятся избегать повышения температуры до указанного предела.
При повышении температуры обжига выше 400 0С происходит перекристаллизация - растворимый ангидрит переходит в нерастворимый, аналогичный по структуре природному ангидриту СаSO4. Нерастворимый ангидрит самостоятельно с водой не взаимодействует и не твердеет.
Когда температура повышается до 750 0С, продукт обжига вновь приобретает способность твердеть. Это объясняется тем, что постепенно начинается частичная диссоциация (химическое разложение) сульфата кальция, и в составе вяжущего появляется свободный оксид кальция – СаО в количестве 2-3 %. Полученный продукт носит название высокообжигового гипса (эстрих-гипс).
Как показывают исследования, при обезвоживании до состояния полугидрата и далее до растворимого ангидрита расстояние между соседними ионами Са2+ и SO4 2- несколько возрастает, в то время как при образовании нерастворимого ангидрита оно уменьшается; именно этот фактор снижает активность ангидрита по отношению к воде.
Оценка энергии кристаллической решетки различных модификаций гипса показала, что обезвоживание приводит к ее увеличению. Например, для двуводного гипса энергия кристаллической решетки составляет 2300 кДж/моль, а для полугидратов сульфата кальция – 2505 кДж/моль.
Из всех перечисленных модификаций сульфата кальция в современном строительстве наибольшее применение получили строительный ( - СаSO4.0,5H2O) и высокопрочный ( -СаSO4.0,5H2O) гипс. При этом промышленный выпуск высокопрочного гипса, несмотря на его явные преимущества, не велик из-за сложностей традиционной автоклавной технологии. Поэтому усилия многих современных ученых направлены на совершенствование технологии высокопрочного гипса.
Новейшие исследования, выполненные в Харькове профессором Бабушкиным и его учениками (информация 2004 года), показали, что для управления процессом получения высокопрочного гипса ( -модификации) весьма важным является соблюдение требуемых термодинамических параметров реакций обезвоживания двугидрата и, в первую очередь, точное знание температур перехода двугидрата в полугидрат с учетом парциального давления газовой фазы.
С этих позиций выполнены термодинамические расчеты (энергия Гиббса и значения парциальных давлений пара) для реакций:
- 47 -
1.СаSO4 . 2H2O = -СаSO4.0,5H2Oкр + 1,5H2Oж.
2.СаSO4 . 2H2O = -СаSO4.0,5H2Oкр + 1,5H2Oж.
3.СаSO4 . 2H2O = -СаSO4.0,5H2Oкр + 1,5H2Oгаз.
4.СаSO4 . 2H2O = -СаSO4.0,5H2Oкр + 1,5H2Oгаз.
5.Н2Ож = Н2Огаз
(индексы: «кр» - кристаллическое состояние; «ж» - жидкое состояние; «газ» - газообразное состояние), которые дали основание для следующих выводов. Реакция (1) до температуры 373оК термодинамически невозможна (G0373 = +1,8 кДж/моль), а при температуре более 413 К становится возможной при условии, если выделение воды сохраняется в жидком виде, что соответствует давлению водяных паров выше 0,194 МПа (по реакции 5).
Реакция (2) до температуры 413 К термодинамически невозможна, а при температуре выше 413 К -полугидрат если и образуется, то сразу превращается в -полугидрат, поскольку вода при этом выделяется в жидком состоянии и устойчивой формой полугидрата сульфата кальция является - модификация.
Анализ условий протекания реакций (3) и (4), которые идут с образованием газообразной воды, показывает, что до температуры 373 К их протекание невозможно ни термодинамически, ни кинетически. При температуре более 373 К, с появлением газообразной воды, эти реакции с кинетической точки зрения становятся возможными. Термодинамически же образование -модификации становится возможным при температуре выше 378,2 К, а образование -модификации – при температуре, выше 381,2 К (108,1 0С), причем, протекание обеих реакций обеспечивается, если в зоне реакции давление паров воды достигает 0,13 МПа, что соответствует температуре 387 К.
Условия протекания реакции (3) с получением -полугидрата авторам разработки удалось реализовать в аппарате кипящего (взвешенного) слоя с дополнительным устройством в виде диффузора (усеченного конуса), создающего в среде обжига задаваемое давление паров воды.
Таким образом, благодаря этим исследованиям значительно расширились технологические возможности получения высокопрочного гипса ( -полугидрата).
5.2. Процессы, протекающие при получении воздушной извести
5.2.1. Кристаллохимическая характеристика сырья
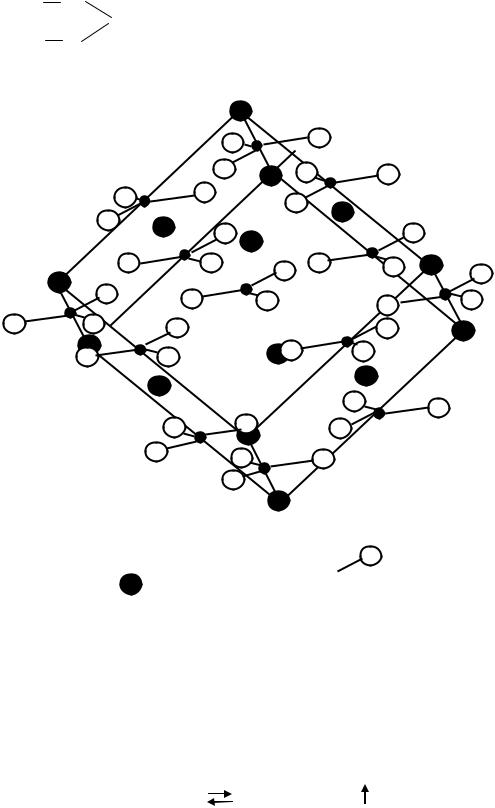
Для производства воздушной извести обычно применяют природные материалы, содержащие в своем составе преимущественно углекислый кальций (известняк, мел и др.). Углекислый кальций или карбонат кальция встречается в природе в виде трех минералов: кальцита, арагонита и
- 48 -
ватерита; наиболее распространенным является кальцит или известковый шпат, который кристаллизуется в гексагональной системе. Элементарная кристаллическая ячейка кальцита содержит две молекулы СаСО3. Кальцит является ионным соединением, карбоксильные группы СО3 2-, имеют тригональную конфигурацию
О
С = О с валентными углами в 120 0, разобщены ионами
О
кальция Са2+ . Каждая группа СО3 2- окружена шестью атомами кальция. Структура кальцита представлена схематически на рис.11.
Рис.11. Структура кальцита
Обозначения:
- Са2+; 
 - СО3 2-
- СО3 2-
5.2.2. Химические процессы, протекающие при обжиге карбонатного сырья
При обжиге известняка и других подобных пород происходит их диссоциация, то есть процесс разложения твердого вещества на более простое твердое вещество и газ. Применительно к кальциту этот процесс
может быть представлен следующим стехиометрическим уравнением: |
|
СО3 СаО(тв.) + СО2 (газ) |
(7) |
