
учебное пособие химия цемента
.pdf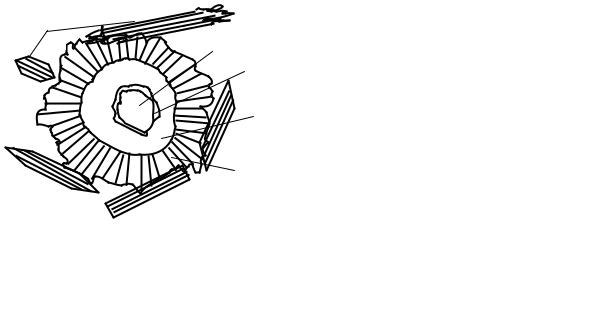
- 99 -
продукты реакции практически не препятствуют доступу воды, так как, увеличиваясь в объеме, они разрушают кусок и тем самым увеличивают его пористость. Можно также считать, что количество воды, первоначально продиффундировавшей в поры, является достаточным для реакции гидратации извести.
Совсем иной механизм гидратации наблюдается на зерне цемента. Так как зерно по структуре очень плотное (для портландцемента = 3,08-3,10 г/см3), то оно не впитывает воду и, соответственно, химическая реакция гидратации идет только на поверхности, и, как мы уже отмечали, достаточно быстро. Но дальнейшее формирование первичной гидратной пленки, внутренней и внешней сферы «слоя Тейлора» затрудняют доступ воды к поверхности зерна цемента и постепенно переводят процесс под диффузионный контроль, при котором скорость химической реакции становится полностью зависимой от скорости диффузии воды в зону реакции, а растворенных продуктов реакции – во внешнюю сферу. По мнению ученых, диффузионная макрокинетика и диффузионный механизм отложения кристаллических новообразований подтверждается многими фактами, в том числе усеченной формой агрегатированных пирамид с вершиной, ориентированной от зерна цемента (рис.21).
5 |
1 |
|
|
|
|
|
2 |
Рис.21. Схематическое изображение |
|
|
|
|
3 |
реагирующего с водой зерна С2S |
|
Обозначения: |
|
|
|
1-негидратированное ядро; |
|
4 |
2-первичный гидрат С2SHx; |
|
|
3-вторичные мелкокристаллические |
|
|
гидросиликаты кальция (внутренний |
|
|
продукт); |
4-третичные отчетливо кристаллические гидросиликаты кальция (внешний продукт);
5-отдельные крупные кристаллы, дендриты
Убедительное доказательство такому механизму роста кристаллов привели немецкие ученые. Они экспериментально обнаружили, что вынос растворенных продуктов из внутренней сферы во внешнюю происходит через трубчатые кристаллы. Например, иглы ксонотлита некоторые ученые рассматривают как свернувшиеся тонкие тоберморитоподобные пластинки, внутри которых существуют влагопроводящие каналы.
Перенос воды из внешней сферы во внутреннюю через межкристаллитные поры, трещины и т.п. происходит под действием осмоти-
- 100 -
ческих и электроосмотических сил. Это подтверждается наличием так называемого внутримембранного электростатического потенциала.
Для первоначальной стадии химических реакций гидратационного твердения цемента большое значение имеет так называемая иммобилизованная вода в виде относительно толстой сольватной оболочки, существование которой, как уже отмечалось, обусловлено свободной поверхностной энергией зерна цемента.
Таким образом, мы пришли к убеждению, что начальная стадия процессов гидратационного твердения может протекать под кинетическим контролем, а с какого-то временного периода процесс неизбежно должен перейти под диффузионный контроль.
О том, что это так, свидетельствуют кривые нарастания прочности цементного камня, имеющие экспоненциальный затухающий характер при далеко не израсходованном клинкерном фонде. Ряд ученых считает, что переход в диффузионную область происходит после того, как степень гидратации цемента ( ) достигла 13 % (за степень гидратации принимают количество прогидратировавшего цемента в процентах относительно исходного его количества). Эту цифру следует принять как весьма ориентировочную, так как очевидно, что граница между кинетическим и диффузионным контролем зависит от многих факторов, в том числе – от минералогического состава цемента, водоцементного отношения, температуры твердения и др.
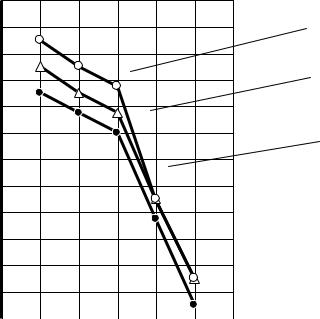
Вопрос о влиянии температурного фактора в свое время (60-е годы ХХ столетия) обстоятельно исследован на кафедре технологии вяжущих веществ и бетонов Воронежского инженерно-строительного института под руководством профессора В.В.Помазкова. На рис.22 представлены характерные для портландцементного клинкера графические зависимости удельной скорости гидратации (wуд(S)) от температуры на ранней стадии тввердения и при условии, что степень гидратации цемента не превышала 7%, что позволяло считать, что этот процесс находится в кинетической области.
Зависимости на рис.22 построены в принятых для химической кинетики координатах: обратная температура – десятичный логарифм скорости. Такие координаты позволяют достаточно однозначно определить характерные температурные области при твердении портландцемента, а также оценить влияние температуры на скорость гидратации. Установлено, что в интервале относительно низких температур (в пределах 20-40 0С) при увеличении температуры на каждые 10 0С скорость гидратации возрастает в 1,5-2 раза. Это как раз и свидетельствует о кинетическом контроле реакции гидратации при таких температурах.
Во втором интервале температур (в пределах 40-60 0С) возрастание скорости гидратации на каждые 10 0С составляет всего около 20 %. Это свидетельствует о том, что с повышением температуры переход в область диффузионной кинетики наступает раньше. Этот вывод имеет
- 101 -
0,3
)ч 0,28. м/( 0,26кг
, 3 0,24 10 . 0,22(S)
удW0,2 0,18 0,16 0,14 0,12
0,1
0,08
0,06
3
2
1
|
|
|
|
|
|
|
|
|
1 |
103 |
|
|
|
|
|
|
|
|
|
|
|||
2,9 |
3 |
3,1 |
3,2 |
3,3 |
3,4 |
3,5 |
Т |
||||
|
|||||||||||
Рис.22. Кинетические зависимости Wуд(S)=f(Т) для трех (1,2,3) портландцементных клинкеров
принципиальное значение для заводской технологии бетона и железобетона, так как становится очевидным, что чем больше мы форсируем процесс твердения за счет повышенных температур, тем в меньшей степени мы используем потенциал цемента при последующем твердении в условиях «дозревания» бетона и службы конструкции. Поэтому в современных рекомендациях на получение высокопрочных бетонов указываются невысокие температуры твердения.
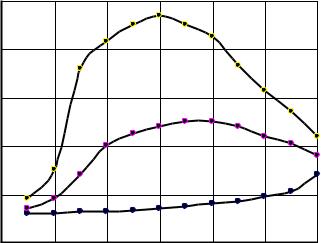
Высказанное положение наглядно подтверждается графиками изменения скорости гидратации портландцемента во времени при различных температурах (рис.23, данные В.В.Помазкова). Так, при 60 0С процесс твердения достиг максимальной скорости через 6 часов после помещения образцов в тепловую камеру (относительная влажность среды выдерживалась на уровне 100 %), а дальше она интенсивно снижалась. При температуре 400С максимум скорости наступил через 8 часов, а при температуре 20 0С едва заметное самоускорение процесса за счет теплового инициирования (собственное тепловыделение цемента) началось лишь после 6 часов выдержки образцов, и в пределах опыта скорость гидратации не достигла своего максимума.
Этими данными мы можем закончить обзор информационного поля, касающегося вопросов скорости гидратационного твердения цементов. Из приведенного обзора стало очевидным, что сегодня рассчитывать на аналитическое описание процесса, исходя из общепринятых кинетических
|
|
|
|
- 102 - |
|
|
|
|
5 |
|
|
|
|
|
|
ч) |
|
|
|
|
|
|
|
2. |
4 |
|
|
|
|
|
|
/(м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, кг |
|
|
|
|
|
|
|
3 |
3 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
60 0С |
|
. Wуд(S) |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
40 0С |
|
|
|
|
|
|
|
|
20 0С |
|
1 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
|
|
|
Продолжительность |
|
|||
Рис.23. Изменение скорости гидратации портландцемента во |
|||||||
|
|
времени в зависимости от температуры |
|||||
параметров, не приходится. В подобной ситуации для аналитического описания процесса остается один путь – путь экспериментальных исследований. Результатом таких исследований могут быть графические или математические зависимости, отражающие кинетику гидратации и твердения цемента. В качестве управляющих факторов могут выступать минералогический состав цемента, температура, влажность среды твердения, содержание химических добавок и др. В качестве оценочных характеристик для степени завершенности процесса могут использоваться показатель степени гидратации цемента, тепловыделение цемента, контракция (сжатие) цементного камня, рН вытяжки из цементного камня, величина электрохимического потенциала, прочность в различные сроки твердения и др.
Краткие обобщения представлений о процессах, протекающих в масштабе зерна цемента
Для периода смешения цемента с водой процесс структурообразования отождествляется с формированием вокруг зерна цемента пленок воды (сольватных оболочек), которые увеличивают эффективный диаметр частиц, меняют свойства воды, способствуют образованию вокруг зерна цемента электрозаряженной сферы и возникновению в пограничной области электрохимического потенциала.
Акты химических реакций, отмеченные для первого иерархического уровня, рассматриваются в непосредственном взаимодействии с поверх-
- 103 -
ностью зерна цемента, которая, выступая в качестве подложки для зародышей кристаллических новообразований, облегчает и делает более вероятными процессы конденсации и кристаллизации новой твердой фазы (гидратов), предопределяет расположение новообразований вокруг зерна цемента в виде разрастающихся сферических глобул переменного состава и структуры.
В свою очередь новообразования выступают в качестве активных центров для адсорбции дополнительных объемов воды и для «надстройки» новых структурных элементов.
Общие представления об элементарных актах гидратации клинкерных минералов и образовании новой твердой фазы трансформируются в представления о совокупности этих актов в дисперсной системе, в которой каждое зерно цемента – это локальная система, реализующая по существу, одни и те же акты гидратации и твердения; в то же время зерно цемента выступает как элементарная ячейка системы твердения, для которой акты этого уровня иерархии приобретают статистический смысл.
6.3.3.Процессы гидратационного твердения, протекающие
вмасштабе цементного камня
6.3.3.1. Общие представления о процессах перехода цементного теста в цементный камень
Вэтом разделе мы должны выяснить: каким образом цементное тесто переходит в искусственный камень с определенным набором свойств. В связи с этим рассмотрим вначале с общих структурных позиций – от чего зависит прочность любого строительного материала.
Считается, что механические свойства материалов зависят от характера связей контактирующих частиц: зерен и кристаллов, их «осколков» и т.п.
Взависимости от физико-химической природы дисперсных структур, образуемых этими связями, акад. П.А.Ребиндер разделил их на коагуляционные, конденсационные и кристаллизационные.
Коагуляционными называют структуры, в которых связь между частицами осуществляется через прослойки жидкой среды за счет относительно слабых вандерваальсовских сил межмолекулярного взаимодействия. Материалы с коагуляционной структурой в зависимости от содержания жидкой фазы обладают подвижностью, пластичностью, тиксотропностью и относительно низкой прочностью.
Конденсационными называют структуры, в которых непосредственный контакт между частицами возникает за счет химических связей. Для материалов с этим типом структуры характерна высокая прочность, хрупкость и необратимость структуры при механических или термических разрушениях.
Кристаллизационными называют структуры, в которых контакт между
частицами осуществляется путем прямого срастания с образованием
- 104 -
пространственной кристаллической сетки или каркаса с более или менее правильным строением. Механические свойства в этом случае зависят от характеристик кристаллических структур.
А теперь те же вопросы рассмотрим применительно к вяжущим веществам.
По определению вяжущими веществами гидратационного твердения мы называем порошковидные минеральные вещества, которые, будучи затворенными водой (или водными растворами химических реагентов), образуют пластично-вязкое тесто, способное со временем переходить в камневидное состояние.
В результате протекания процессов гидрато-и структурообразования в вяжущей системе происходят количественные и качественные изменения. В самом общем виде изменения структурного состояния системы может быть представлено следующими превращениями:
типичные контакты в исходном вяжущем (порошке)
коагуляционные контакты в системе «цемент-вода»
коагуляционно-конденсационные контакты в твердеющей системе
конденсационно-кристаллизационные контакты (контакты срастания) в цементном камне
А теперь рассмотрим более подробно основные моменты, связанные с переходом цементного теста в цементный камень, то есть с преобразованием структуры цементного теста в структуру цементного камня.
По мнению многих ученых формирование начальной структуры цементного теста сводится к образованию связей между твердыми частицами под действием поверхностных сил: создаются так называемые коагуляционные контакты. Но так как эти силы являются ближнедействующими, то они не могут обеспечить возникновение достаточно прочных контактов без дополнительных условий, главным из которых многие считают условие «стесненного состояния», которое достигается начальной высокой концентрацией дисперсной фазы, химическим связыванием жидкости затворения, поставляющей новой фазе полярные группы, а также физическими явлениями адсорбции молекул воды
- 105 -
частицами новообразований (переход воды в так называемое «пленочное» состояние).
На длительно протекающие процессы твердения вяжущей системы, когда она набирает значительную прочность, определяющее влияние оказывают дальнодействующие силы электростатической природы, так как частицы новой фазы не являются нейтральными, а в результате ориентации адсорбированных на их поверхности диполей дисперсионной среды (в данном случае - воды) они приобретают определенную заряженность. Это подтверждается наличием у данных систем постоянного электрического момента. Необходимо учесть, что электростатические (ионные) силы не насыщены и не направлены в пространстве и, по-видимому, именно поэтому возможна конденсация всей твердеющей системы. В явлении
межагрегативной конденсации могут |
также участвовать |
и |
силы |
электромагнитного взаимодействия |
сближенных поверхностей частиц за |
||
счет имеющего место излучения и поглощения электромагнитных волн поверхностными атомами и молекулами. Эти силы распространяются на достаточно большие расстояния и достигают значительной величины. В результате возникают специфические интенсивные взаимодействия, способствующие переводу системы в твердое состояние.
Следующие этапы твердения связаны с зарождением и образованием кристаллических фаз. Для структуры затвердевшего цементного камня характерны более прочные кристаллизационные контакты химической природы – так называемая «поверхностная химическая сшивка», обусловленная взаимодействием внешних электронов атомов контактирующих частиц. Энергия связи «химической сшивки» может составлятьот 40 до 400 кДж/моль, а сила связи на одни контакт – 10-4 Н.
Приведенным выше далеко не исчерпывается информационное поле по рассматриваемому вопросу. Чтобы не «утонуть» в мелких деталях при подробном изложении вопроса, приведем ключевые положения о механизме отвердевания вяжущей системы, которые отстаивал в своих работах профессор М.М.Сычев (С.-Петербургский технологический университет).
1.Вследствие химического взаимодействия в вяжущей системе «твердое тело-жидкость затворения» и связывания молекул полярной жидкости образуется новая фаза, содержащая полярные группы – кристаллогидраты.
2.Новая фаза возникает в виде частиц высокой степени дисперсности; именно с этим связан переход значительной части жидкости (воды) в «пленочное» состояние. В результате высоких начальных значений отношения Т/Ж, химического связывания воды за счет продолжающейся гидратации, перехода воды в «пленочное» состояние появляются так называемые «стесненные» условия, без которых невозможно появление коагуляционных контактов срастания.
3.В результате «стесненности» и перекрытия пленок воды в местах контактов создаются условия для электростатического и электромагнитного

- 106 -
взаимодействия частиц. Происходит иммобилизация свободной воды (она приобретает свойства твердого тела), ионы теряют подвижность – наблюдается схватывание системы.
4.При продолжении перехода безводных соединений в гидраты количество связанной воды увеличивается, поровое пространство заполняется новыми порциями частиц новообразований – количество контактов возрастает, прочность цементного камня повышается.
5.Главной причиной увеличения прочности является постепенный переход адгезионных и когезионных (коагуляционных) контактов в прочные кристаллизационные контакты срастания с химическими связями. Эволюция контактов происходит за счет того, что в этих зонах пленки воды «утончаются» настолько, что возможен плавный переход контактов одного типа в другой, более прочный.
6.3.3.2. Химические и структурные аспекты образования новых фаз в цементном камне
Ранее в этой главе мы достаточно обстоятельно рассмотрели причины гидратационной активности цемента, проследили за элементарными актами, обеспечивающими его твердение. Завершить такое рассмотрение мы должны некоторыми определяющими моментами, которые определяют состав цементного камня вцелом с учетом минералогического состава цементного клинкера.
Напомним, что основными составляющими цементного клинкера являются силикатная, алюминатная и алюмоферритная фазы. Рассмотрим для каждой их этих фаз химические и структурные превращения, которые и приводят к образованию новых цементирующих веществ.
Образование гидросиликатов кальция и их структурные особенности
При взаимодействии трехкальциевого силиката С3S (алита) с водой в системе образуются гидросиликаты кальция и гидроксид кальция Са(ОН)2. Если исходить из того, что в начальный момент в твердеющем цементе образуется преимущественно гидросиликат состава 3СаО.2SiO2.3H2O, то ход реакции можно представить следующей схемой:
2(3СаО.SiO2) + 6H2O = 3CaO.2SiO2.3H2O + 3Ca(ОH)2. (43)
Фактически алит при взаимодействии с водой дает гидросиликаты кальция разного состава в зависимости от температуры среды и концентрации гидроксида кальция в жидкой фазе. Считается, что в начальной стадии образуется первичный гидросиликат, который подвергается быстрому гидролизу с образованием соединений с меньшим отношением
СаО : SiO2 (вторичные и третичные гидросиликаты). Чем ниже концентрация СаО в окружающем водном растворе, тем меньше основность
- 107 -
образующегося гидросиликата. Наличие СаО в растворе обусловлено
растворением |
небольшого |
количества |
свободной |
извести |
|
портландцементного |
клинкера |
в начале |
твердения и |
гидролизом |
|
минералов-силикатов в дальнейшем.
Концентрация СаО в жидкой фазе системы «цемент-вода» зависит от многих факторов и, в первую очередь, от основности портландцементного клинкера, продолжительности твердения и температуры. При обычной температуре и концентрации Са(ОН)2 до 1,1 г/л (в расчете на СаО) образуются гидросиликаты примерно следующего переменного состава: (0,8- 1,5)СаО.SiO2.(1-2,5)H2O. При концентрации Са(ОН)2 в жидкой фазе, соответствующей полному насыщению (например, 1,25 г/л при 10 0С), С3S гидратируется с образованием метастабильного гидросиликата кальция
состава (1,5-2) СаО.SiO2.nH2O. Степень гидратации синтезированного С3S в разные сроки твердения составляет (температура 20 0С): 1 сутки – 25-35 %, 10 суток – 55-65 %, 28 суток – 78-80 %, то есть в реальном цементе алит отличается высокой активностью при взаимодействии с водой.
Гидратация -С2S, в отличие от С3S, протекает медленно: даже через несколько лет можно обнаружить лишь до 85 % соответствующих гидратированных соединений. Степень гидратации -С2S через 1 сутки составляет 5-10 %, через 10 суток – 10-20 %, через 28 суток – 30-50 %.
Химический состав гидросиликатов кальция этой группы изменяется по мере развития гидратации цемента. Их основность меняется от 1,65 до 1 в пределах степени гидратации 25-30 %. При дальнейшем твердении основность остается практически постоянной.
Образующиеся при гидратации алита и белита в обычных условиях гидросиликаты кальция представляют собой слабо закристаллизованные (субмикрокристаллические) продукты, рентгеноструктурная идентификация которых затруднена. Морфология, дисперсность и состав этих новобразований зависит от многих факторов, главными из которых являются температура и наличие в жидкой фазе примесных (относительно цементного клинкера) соединений. Большинство исследователей считают, что практически все гидросиликаты кальция близки по структуре к природному минералу – тобермориту, имеющему средний состав 5CaO.6SiO2.5H2O с определяющим размером элементарной ячейки 1,13 нм. Поэтому такие гидросиликаты получили название тоберморитоподобных.
Принято делить гидросиликаты кальция, образующиеся в цементном камне, на два вида: С-S-H(I) или CSH(B), в котором отношение СаО : SiO2 1,5, и С-S-H(II) или С2SН2 (иногда его называют С2S -гидрат), в котором отношение СаО : SiO2 1,5. Гидросиликаты первого вида называются низкоосновными и кристаллизуются в виде тончайших пластинок (лепестков) толщиной 2-3.10-3 нм (2-3 молекулярных слоя), шириной 40-55.10-2 нм. Длина кристаллов может достигать нескольких десятков и даже сотен нанометров. Удельная поверхность этих частиц составляет 250-380 м2/г.

-108 -
Сповышением основности тонкие лепестки, напоминающие фольгу, начинают скручиваться, образуя волокна с внутренней полостью, в которой могут размещаться молекулы воды. Такая вода относится к адсорбционной; вода, которая входит в состав кристаллогидратов и размещается между слоями кристаллической решетки, называется химически связанной.
Гидросиликаты группы С-S-H(II) имеют более высокие отношения
СаО:SiO2 и называются высокоосновными. Такие гидросиликаты кристаллизуются в виде отдельных волокон и пучков.
Важно обратить внимание на то, что низкоосновные гидросиликаты
кальция характеризуются повышенными прочностными показателями, а высокоосновные – более низкими. Это явление связывают со степенью конденсации кремнекислородных анионов. В первом случае система обогащается, при прочих равных условиях, элементами с более прочными ковалентными связями, создающими предпосылки к развитию высокой прочности. Высокоосновные гидросиликаты содержат преимущественно более слабые кальцийкислородные ионные связи, и это отрицательно сказывается на прочностных показателях цементного камня.
Образование гидроалюминатов кальция
иих структурные особенности
Вначальный период гидратации С3А преобладают высокоосновные
продукты состава 4СаО.Al2O3.19H2O |
и 2СаО.Al2O.8H2O. Реакцию |
|
гидратации можно представить так: |
|
|
2(3СаО.Al2O3) + 27Н2О = 2СаО.Al2O.8H2O + 4СаО.Al2O3.19H2O. |
(44) |
|
Изучение процесса гидратации под электронным микроскопом показало, что на поверхности зерен трехкальциевого алюмината С3А сразу же после соприкосновения его с водой образуется рыхлая оболочка из пластинчатых кристаллов гидроалюминатов кальция. Такая оболочка не препятствует проникновению молекул воды к негидратированной части и поэтому реакция гидратации трехкальциевого алюмината идет очень быстро: через 1 сутки успевает прореагировать до 80 % этого соединения. Схема реакции гидратации трехкальциевого алюмината, представленная уравнением (44), считается не единственной. Так, при температуре выше 25 0С может иметь место следующая химическая реакция:
3СаО.Al2O3 + 6Н2О = 3СаО.Al2O3.6Н2О. |
(45) |
Образующийся при этом гидроалюминат выделяется в виде кристаллов кубической формы. Появление кристаллов кубической формы обуславливается нестабильностью пластинчатых гидроалюминатов кальция при повышении температуры . Также из-за нестабильности гидроалюминатов пластинчатой формы, образующихся согласно (44), со временем даже при обычных температурах, происходит медленный их распад с перекристаллизацией в более стаблильные формы – гиббсит (АН3) и кубический С3АН6. Все это приводит к некоторому снижению прочности.
