- •Характеристика почвы.
- •Морфология и классификация почв
- •Роль микроорганизмов в почвообразовании
- •Соленость
- •Кислотность.
- •Почвенный воздух
- •Типы питания почвенных микроорганизмов
- •Основные понятия экологии почвенных микроорганизмов
- •Экосистемы классифицируются
- •Пространственная структура микробиологических группировок
- •Таксономическая структура микробиологических группировок
- •Функциональная структура микробиологических группировок
- •Экологические стратегии почвенных микроорганизмов
- •Типы взаимоотношений с микроорганизмами
- •Билогическая азотфиксация
- •Симбиоз бактерий с небобовыми растениями.
- •Аммонификация
- •Нитрификация.
- •Виды мембранного транспорта
- •Активный транспорт ионов
- •Ионные каналы растений
- •Физиологическая роль элементов минерального питания
- •Азотные удобрения
- •Фосфорные удобрения.
- •Внесение удобрений
- •Общие принципы использования удобрений
Виды мембранного транспорта
На мембранах, разделяющих клеточные компартменты, поддерживаются градиенты электрических потенциалов. Это является причиной пассивного перемещения ионов в сторону более низкого электрохимического потенциала. Передвижение ионов по градиенту электрохимического потенциала называют пассивным транспортом, против градиента – активным. Различают четыре вида мембранного транспорта ионов: пассивную диффузию, облегченную диффузию, первично-активный транспорт и вторично-активный (сопряженный) транспорт.
Пассивная (неспецифическая) диффузия ионов происходит при появлении в мембране различных гидрофильных пор или при нарушении целостности липидного бислоя. В нормальных условиях транспорт ионов путем простой диффузии – процесс маловероятный.
Пассивный перенос ионов через липидный бислой по градиенту их концентрации резко возрастает при появлении в мембране специализированных белков или пептидов, осуществляющих процесс так называемой облегченной диффузии. В основе облегченной диффузии лежит обратимое связывание транспортируемого иона с белком-переносчиком, который проходит через мембрану с высвобождением иона на другой стороне.
Диффузионным путем идет также транспорт ионов через селективные каналы, которые обеспечивают быстрое трансмембранное перемещение ионов в направлении градиента их электрохимического потенциала. Особенностью транспорта ионов через каналы является значительное снижение энергетических затрат на перенос иона через мембрану.
Первично-активный транспорт осуществляется ионными насосами, источником энергии для которых служат АТР, пирофосфат или субстраты, окисляемые в электрон-транспортных цепях митохондрий, хлоропластов и других мембранах.
Вторично-активным (сопряженным) транспортом называют процесс переноса ионов через мембрану против градиента его концентрации за счет энергии электрохимического градиента других ионов. Сопряженный транспорт может осуществляться в режиме симпорта (оба иона переносятся через мембрану в одном направлении) или антипорта (ионы транспортируются в противоположных направлениях). Вторично-активный транспорт обеспечивает мембранный перенос моносахаридов, сахарозы, аминокислот, пептидов, анионов и ряда катионов. Для этой цели мембранные белки-переносчики чаще всего используют электрохимический градиент ионов водорода, создаваемый различными Н+-насосами.
Активный транспорт ионов
Активный транспорт ионов в клетках растений осуществляется за счет транспортных АТРаз, пирофосфотаз, ионных обменников и АВС-переносчиков.
Транспортные АТРазы. Известно два типа транспортных АТРаз: Р- и V-тип. Общим свойством АТРаз Р-типа является способность образовывать ковалентный фосфорилированый интермедиат (Р~Е), участвующий в реакционном цикле. Из АТРаз Р-типа наибольшее значение для растений имеют протонные и кальциевые АТРазы. Предполагается, что высокоспецифичное поглощение ионов калия клетками растений может обеспечиваться Н+-АТРазой плазмалеммы, которая начинает активно работать при микромолярных концентрациях калия во внешней среде, а насыщение наступает при концентрации ионов К+ более 200 мкМ. Эти переносчики 1 с транспортируют более 100 ионов. Они способствуют аккумуляции калия клетками при 100-кратном градиенте его концентрации на мембране. При гидролизе АТР в процессе функционирования АТРаз Р-типа остаток фосфорной кислоты переносится на карбоксильную группу аппарата активного центра и образуется фосфорилированная форма фермента (Е~Р). Очень эффективным ингибитором АТРаз Р-типа является ванадат, который способен вместо фосфата специфически связываться с активным центром фермента. АТРазы Р-типа отличаются друг от друга по чувствительности к любым другим модификаторам, кроме ванадата, который является сильным ингибитором именно этих ферментов.
Ион-транспортирующие АТРазы V-типа функционируют в тонопласте растений, вакуолях дрожжей и лизосомах. Большинство АТРаз этого типа являются переносчиками протонов и участвуют в процессе транспорта анионов, аминокислот, репарации мембран при эндо- и экзоцитозе. В ходе каталитического цикла для них не установлено образования ковалентно-связанного фосфорилированого интермедиата. АТРазы V-типа блокируются нитратом, хаотропными (KSCN) и блокирующими SH-группы реагентами. Ванадат, будучи ингибитором Р-типа АТРаз, на эти системы не действует.
|
|
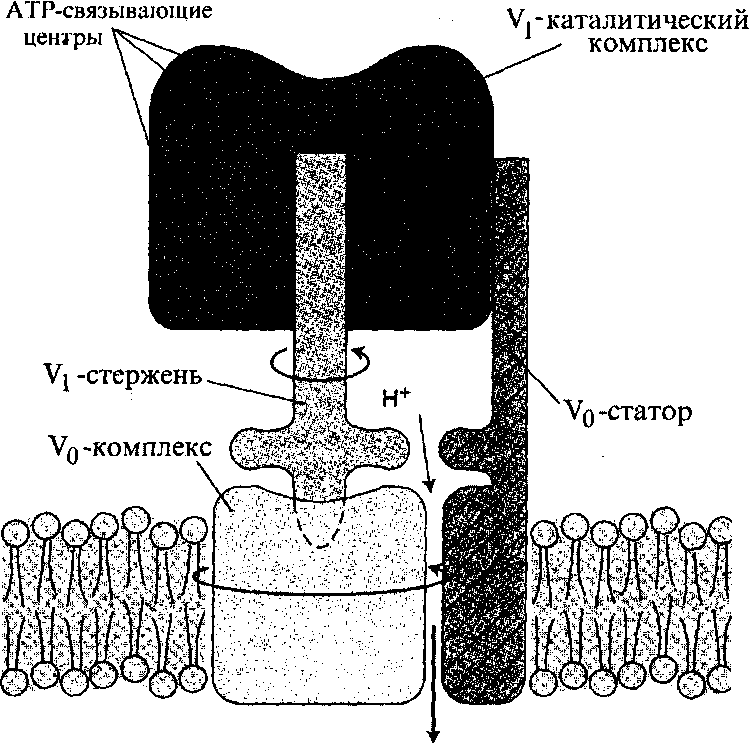
На рисунке приведена так называемая «ротор-статорная» модель V-АТРазы, которая включает 4 структурных компонента: V1-каталитический комплекс, V1-стержень, V0-комплекс (ротор), V0-статор. Предложенная модель имеет явную аналогию со строением и работой АТР-синтазного комплекса митохондрий.Механизм транспорта ионов Н+ представляется следующим образом. |
Комплекс V0-статор фиксирует в неподвижном состоянии каталитическую часть фермента, на которой связывается АТР.
При гидролизе АТР в V1-каталитическом комплексе начинается вращение V1-стержня, который, работая как эксцентрический вал, вращает V0-комплекс. Вращение последнего вызывает передвижение протонов с одной стороны мембраны на другую. Таким образом, в процессе работы V-АТРазы вначале происходит превращение химической энергии АТР в механическую энергию вращения «ротора» (V1-стержня и V0-комплекса), которая в свою очередь трансформируется в энергию электрохимического мембранного градиента ионов Н+.
Транспортные пирофосфатазы. Транспорт ионов водорода внутрь вакуоли осуществляется двумя ферментами, один из которых использует энергию АТР (Н+-АТРаза), а второй – пирофосфата (Н+-РРаза, пирофосфатаза). Оба фермента катализируют электрогенный транспорт протона из цитозоля в вакуоль, создавая на тонопласте электрический (от +20 до +50 мВ) и химический (то 1,5 до 4,5 единиц рН) градиент ионов Н+. Эта энергя используется в процессе вторичного активного транспорта ионов и органических молекул. В последнем случае ионы Na+, Ca2+, Mg2+ и сахара входят в вакуоль, а ионы Н+ выходят из вакуоли по градиенту электрохимического потенциала. Можно видеть, что этот тип протонного насоса включает 14 трансмембранных доменов и 3 консервативных участка, одинаковых у различных типов пирофосфатаз. На долю Н+-РРазы приходится от 1 до 10% белков тонопласта, поэтому Н+-РРаза создавать почти такой же (если не больший), как и Н+-АТРаза, градиент протонов на вакуолярной мембране.
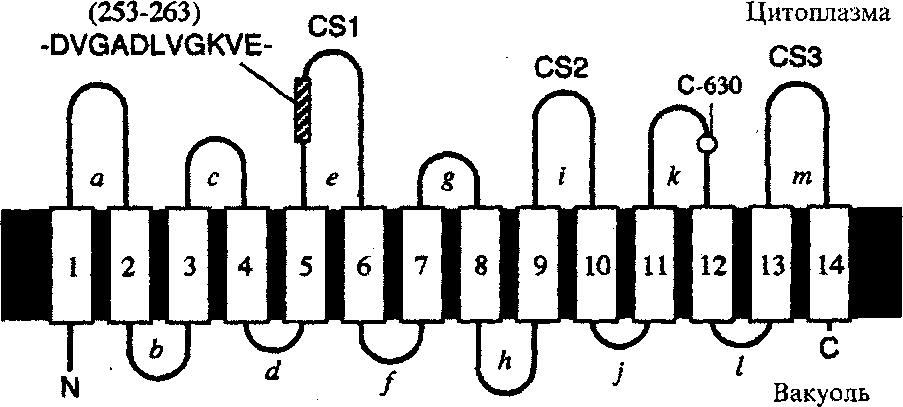
Модель строения пирофосфатазы. 1-14 - четырнадцать трансмембранных домена. CS1, CS12, CS3- консервативные участки белка.
Активный транспорт ионов Са2+ в растительной клетке. Система активного транспорта ионов Са2+ необходима для осуществления по крайней мере четырех важных функций растительной клетки: во-первых, пополнения запасов кальция в клеточных компартментах для последующего его высвобождения через Са-каналы в ходе проведения сигналов; во-вторых, поддержания низкой концентрации ионов Са2+ в цитоплазме для формирования пространственно-временных параметров Ca – сигнала; в-третьих, снабжения кальцием биохимичеких процессов в органеллах клетки; в-четвертых, обеспечения ионами Ca2+ межмембранных взаимодействий, например таких, как транспорт везикул, их слияние и секреция.
Активный транспорт ионов Ca2+ обеспечивается H+/ Ca2+ - обменниками и Ca-помпами. Для каждого из этих двух типов транспорта в качестве источника энергии используется АТР, однако работа H+/ Ca2+ - антипортера зависит также от мембранного градиента pH.
H+/ Ca2+ - обменники обладают относительно низким сродством к ионам Ca2+ (Км = 10-15 мкМ) и большой мощьностью. Они обычно активируются при резком возрастании содержания кальция в цитоплазме. Ca-помпы обладают более высоким сродством к кальцию (Км = 0,1-0,2 мкМ) и меньшей мощьностью по сравнению с Ca2+/H+ - обменниками.
Активность Ca2+/H+ - антипортера наиболее высока на вакуолярной мембране, хотя он обнаружен также и в плазмалемме. Стехиометрия сопряженного H+/ Ca2+ - транспорта на танопласте составляет 3:1. Протонный градиент на вакуолярной мембране формируется в результате работы H+-АТРазы или H+-пирофосфатазы.
Кальциевые помпы относятся к суперсемейству АТРаз Р-типа, поскольку в ходе ферментативного мембранного переноса ионов Ca2+ образует фосфорилированный интермедиат (Е~Р), подавляются ортованадатом и для транспорта ионов используют непосредственно энергию АТР. В качестве эффективного ингибитора Ca-АТРаз часто применяется также эритрозин Б в концентрации 0,5 мкМ.
Основываясь на анализе аминокислотных последовательностей, кальциевые помпы растительных клеток (по аналогии животных) делят на две большие группы: Са-помпы плазмалеммного типа (пМ-типа) и Са-помпы эндоплазматического ретикулума (ЭР-типа). Эти Са-АТРазы различаются по чувствительности к кальмодулину и циклопиазоновой кислоте.
Са-помпы плазмалемного типа активируются лальмодулином. Эти переносчики обнаружены не только в плазмалемме, но и в других мембранах. Са- помпы ЭР типа не чувствительны к кальмодулину, они обнаруживаются в плазмалемме и в тонопласте.
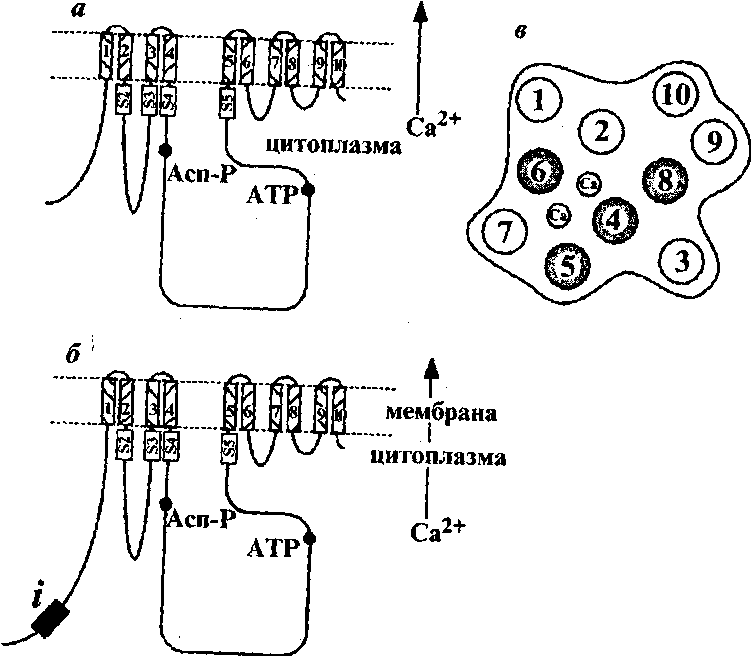
Укладка полипептида Са- АТФ-азы. А - Са-АТФ-аза 2А-типа; б - Са-АТФ-аза ;2В типа; в - взаиморасположение мембранных доменов.
АВС-переносчики. В последнее время исследователи, занимающиеся изучением процессов мембранного транспорта, выделили еще одну группу белков с очень широким диапазоном транспортных функций и назвали ее АВС-переносчиками (от англ. АТР-binding cassette). Большинство АВС-белков являются помпами, обеспечивающими мембранный транспорт за счет энергии АТР, другие способны модулировать работу различных каналов или обладают рядом свойств, присущих ионным каналам.
Часть из них не обладает транспортными функциями. АВС-переносчики осуществляют мембранный транспорт пептидов, сахаров, липидов, тяжелых металлов, полисахаридов, алкалоидов, стероидов, неорганических кислот и конъюгатов трипептида глутатиона. Многие АВС-транспортеры относительно специфичны, однако имеются и такие, которые способны транспортировать различные химические соединения. В растениях этот тип переносчиков выявлен в тонопласте, мембранах хлоропластов и митохондрий.
АВС-белки обычно содержат АТР-связывающий домен, локализованный в цитоплазме, и высокогидрофобный трансмембранный домен, формирующий специфичный «канал», по которому субстраты пересекают мембрану. Нуклеотидевязывающий участок содержит домены, характерные не только для всех АТР-связывающих белков, но и специфическую аминокислотную последовательность, встречающуюся только у АВС-переносчиков. Именно этот домен обеспечивает сопряжение процессов гидролиза АТР и транспорта.
Одной из очень важных функций АВС-переносчиков является их участие в детоксикации липофильных ксенобиотиков, например таких, как гербициды. Процесс детоксикации обычно включает три этапа – активацию, конъюгацию и компартментализацию ксенобиотиков. Первый этап связан с их гидролизом (эстеразами или амидазами) или окислением (например, системой цитохрома Р-450). На втором этапе ксенобиотики или их активные метаболиты образуют конъюгаты с такими эндогенными гидрофильными веществами, как глюкоза, глутатион или малоновая кислота. На третьем этапе неактивные водорастворимые конъюгаты транспортируются АВС-переносчиками из цитоплазмы в вакуоль.