- •Характеристика почвы.
- •Морфология и классификация почв
- •Роль микроорганизмов в почвообразовании
- •Соленость
- •Кислотность.
- •Почвенный воздух
- •Типы питания почвенных микроорганизмов
- •Основные понятия экологии почвенных микроорганизмов
- •Экосистемы классифицируются
- •Пространственная структура микробиологических группировок
- •Таксономическая структура микробиологических группировок
- •Функциональная структура микробиологических группировок
- •Экологические стратегии почвенных микроорганизмов
- •Типы взаимоотношений с микроорганизмами
- •Билогическая азотфиксация
- •Симбиоз бактерий с небобовыми растениями.
- •Аммонификация
- •Нитрификация.
- •Виды мембранного транспорта
- •Активный транспорт ионов
- •Ионные каналы растений
- •Физиологическая роль элементов минерального питания
- •Азотные удобрения
- •Фосфорные удобрения.
- •Внесение удобрений
- •Общие принципы использования удобрений
Ионные каналы растений
Впервые наличие ионных каналов предсказали в 1952 г. английские физиологи А. Ходжкин (A. L. Hodgkin) и А. Хаксли (A. F. Huxley) на основе математического анализа ионных потоков К+ и Na+, возникающих в ходе проведения нервного импульса. Они предположили, что ионные токи идут только через определенные участки мембраны, так называемые active patches. Позднее в этих участках действительно были обнаружены потенциалзависимые Na- и К-каналы.
|
|
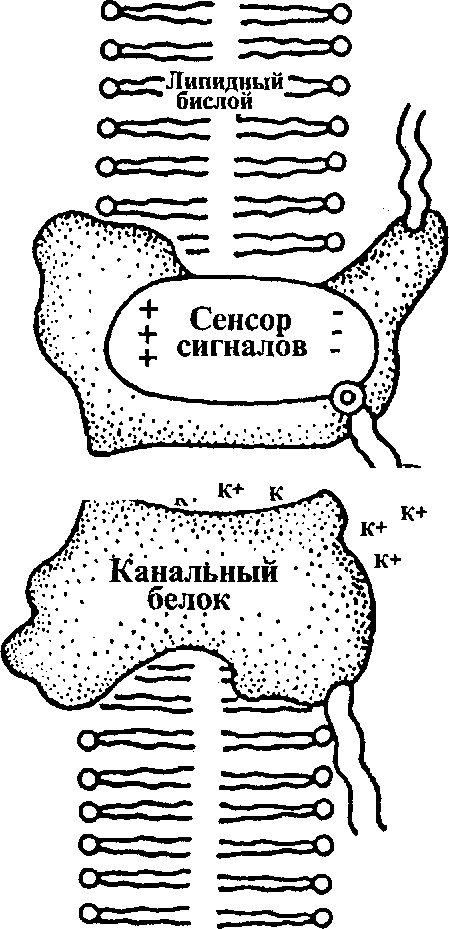
Ионные каналы формируются интегральными белками, которые пронизывают мембрану таким образом, что в ней образуется гидрофильная пора. При этом гидрофильные аминокислоты выстилают стенки поры, а гидрофобные — контактируют с липидной фазой мембраны. Движение ионов через эту внутримембранную гидрофильную пору происходит в один ряд по так называемому эстафетному механизму.
|
Модель ионного канала
В отличие от облегченной диффузии, транспорт ионов через каналы представляет собой процесс, который идет без насыщения и с более высокой скоростью. Особенностью транспорта иЬнов через каналы является также их односторонняя проницаемость.
Ионные каналы классифицируются по принципу управления воротным механизмом и по селективности к различным ионам. Каналы способны избирательно открываться (или закрываться) при изменении мембранного потенциала, а также при гормональных, механических, осмотических и других воздействиях.
В зависимости от способа взаимодействия между воротным механизмом и сенсором внешнего сигнала ионные каналы делят на две группы. Первую группу образуют такие каналы, у которых сенсор внешнего сигнала входит в состав молекулы канала непосредственно. Эта группа включает потендиалзависимые ионные каналы, которые реагируют на изменение мембранного потенциала, а также лигандуправляемые каналы, открываемые при связывании с рецептором специфических агонистов. У каналов второй группы сенсор внешних стимулов пространственно отделен от канала. В этом случае внешний сигнал от сенсора на канал передается через систему внутриклеточных посредников. Эта группа включает рецептороуправляемые каналы и каналы, управляемые G-белками.
Кинетические свойства конкретного ионного канала определяются его проницаемостью, селективностью и функционированием воротного механизма. Большинство ионных каналов находится в открытом состоянии лишь очень короткое время. Переход канала в открытое состояние осуществляется с помощью воротного механизма (ворот), который обычно расположен в его устье. Открывание и закрывание воротного механизма является результатом конформационных изменений белка. При открывании ионного канала регистрируется резкое возрастание электрического тока через мембрану. Открывание и закрывание ионных каналов регулируется мембранным потенциалом, ионами Са2+, рН, фосфорилированием, жирными кислотами и G-белками. В случае потенциалеависимых каналов открывание ворот происходит при изменении мембранного потенциала. Каналы, ассоциированные с рецепторами, открываются в ответ на структурные изменения рецептора.
Селективность ионного канала обусловливается диаметром просвета канала, природой и распределением заряженных групп, особенно тех, которые локализованы непосредственно у входа в канал, где они выполняют функцию селективного фильтра. Последний включает в себя кольцо кислородных атомов, способное осуществлять дегидратацию ионов. Селективные свойства канала определяются последовательностью аминокислот, входящих в состав фильтра.
Проницаемость единичного канала составляет несколько сотен ионов в секунду, что на три порядка быстрее, чем транспорт, катализируемый помпами и переносчиками, и на 11 порядков выше, чем простая диффузия ионов через мембрану. Отличительной особенностью ионных каналов является то, что в открытом состоянии они обеспечивают относительно постоянный поток ионов в одном направлении при конкретной величине мембранного потенциала и в определенной ионной среде. В процессе транспорта через канал происходит взаимодействие иона с белком, поэтому передвижение ионов по каналам отличается от транспорта через аквапорины, в которых эти взаимодействия минимальны. Проводимость канала зависит от заполнения ионами участков на входе и выходе. Выход иона из канала облегчается при появлении на входе другого иона из-за их электростатического отталкивания. Однако при высоких концентрациях электролита может происходить насыщение проводимости канала из-за заполнения ионами его входа и выхода и, как следствие, блокировка канала. Передвижение иона через пору канала сопряжено с преодолением энергетического барьера, величина которого зависит от диаметра поры, энергии гидратации иона, величины рН, ионной силы и других условий, способных понижать энергию активации при прохождении селективного фильтра. Ионы перемещаются по каналу не путем простой диффузии, а в результате последовательных стадий дегидратации и связывания со стенками поры канала. При этом происходит замещение молекул воды гидратной оболочки иона на полярные группы в полости канала. Поскольку увеличение свободной энергии иона при дегидратации с избытком компенсируется энергией его взаимодействия с полярными группами канала, общая энергия иона снижается, что облегчает его прохождение через канал. Наличие в центре канала полярных групп и фиксированных отрицательных зарядов также способствует снижению энергетического барьера для перехода катионов из раствора в канал. Основными параметрами, которые применяют для оценки типа и физиологической роли канала, являются селективность, принципы регуляции воротного механизма, проницаемость и его фармакологические характеристики. В растениях обнаружены практически все основные типы ионных каналов, известные у животных организмов.
К+-каналы. Большинство К+-каналов блокируются четвертичными соединениями аммония (в частности, тетраэтиламмонием) и имеют сходную селективность и хорошую проницаемость только для четырех катионов (Tl+, К+, Rb+, NH4 ). При снижении рН проводимость К+-каналов резко падает из-за протонирования аминокислотных групп в поре канала. У растительных организмов найдены потенциалзависимые и Са-зависи- мые К+-каналы. Потенциалзависимые К+-каналы могут активироваться как при деполяризации мембраны, например К+-каналы выходящего выпрямления (outward-rectifying), так и при ее гиперполяризации — К+-каналы входящего выпрямления (inward-rectifying). Функционирование потенциалзависимых К+-каналов определяет содержание калия в цитоплазме, тургор клетки, фазу реполяризации в ходе генерации потенциала действия ; и некоторые другие функции. К+ -каналы выходящего выпрямления (Кaut-каналы), активирующиеся при деполя- ! ризации мембраны, обнаружены в плазмалемме водорослей, клеток высших растений и дрожжей. Они участвуют в движении устьиц и обеспечивают поток калия из клетки I в ходе генерации потенциала действия у харовых водорослей и высших растений. К+ -каналы входящего выпрямления (Кin-каналы), которые активируются при увеличении мембранного потенциала, имеют более высокую селективность по отношению к ионам К+. Полупериод активации К+-каналов растений в ответ на гиперполяризацию плазмалеммы лежит в пределах 25-200 мс. Каналы могут оставаться в открытом состоянии несколько минут и обеспечивать, в отличие от К+-каналов животных, достаточно продолжительный поток калия в клетку. Растительные К+-каналы содержат шесть трансмембранных доменов (рис. 5.11). Один из доменов выступает в качестве сенсора мембранного потенциала (S4), другие участки формируют гидрофильную пору в устье канала (Р), выявлены также места связывания с циклическими нуклеотидами и белками цитоскелета (анкиринами). Предполагается, что К+-каналы обеспечивают поглощение калия клетками растений при содержании его в среде около 1 мМ. Известно, что содержание ионов К+ в цитоплазме растительных клеток колеблется от 60 до 150 мМ. Возможность транспорта калия в клетку по К+-каналам против градиента концентрации достигается за счет того, что функционирующая в плазмалемме Н+-помпа генерирует отрицательный мембранный потенциал, составляющий от -120 до -220 мВ. Этот потенциал и позволяет аккумулировать калий клетками через К+-каналы даже при 100-кратном градиенте концентрации. Небольшое количество таких каналов в мембране может обеспечивать значительный поток калия в клетку, так как скорость транспорта — более 100 ионов в секунду. Такой тип мембранного транспорта калия, вероятно, встречается только у растений и имеет очень важное значение для минерального питания, поскольку содержание ионов К+ в почвенном растворе и фазе клеточной стенки различных тканей обычно варьирует от 0,3 до 15 мМ . Следует отметить, что селективный фильтр некоторых К^- каналов может также пропускать ионы NHJ и некоторые другие катионы. Работа К^- каналов высших растений эффективно модулируется фитогормонами (АБК) и такими вторичными посредниками, как ионы Са2+, инозитолтрисфосфат, диацилглицерол, G- белки. Ионы Cs+, Na+, Са2+ и А13+ снаружи клетки подавляют функционирование Кукана лов. В отличие от животных, К^-каналы растительных организмов практически не зависят от концентрации ионов Mg2+ в цитоплазме. Са2+ -активируемые К+-каналы начинают функционировать при увеличении содержания ионизированного кальция в цитоплазме, поскольку рецептор для ионов Са2+ расположен на внутренней стороне мембраны. Сродство этого рецептора к ионам Са2+ зависит от мембранного потенциала и обычно возрастает при деполяризации мембраны. Поэтому работа Са2+-активируемых К+-каналов зависит и от концентрации кальция, и от величины мембранного потенциала. При деполяризации мембраны содержание кальция в цитоплазме возрастает в результате двух процессов: входа снаружи по по- тенциалзависимым Са2+-каналам и мобилизации из различных внутриклеточных депо (эндоплазматический ретикулум, вакуоль). Взаимодействие ионов Са2+ с рецептором Са2+-зависимых К+-каналов переводит их в открытое состояние, и ионы калия начинают выходить из клетки по градиенту электрохимического потенциала. Это является причиной гиперполяризации мембранного потенциала и закрытия потенциалзависи- мых Са2+-каналов. Концентрация кальция в клетке снижается, и мембранный потенциал стабилизируется. Таким образом, взаимодействие калиевых и кальциевых каналов позволяет регулировать потенциал покоя клетки.Са2+-каналы. Выделяют потенциалзависимые, рецептороуправляемые и механо- чувствительные Са-каналы (см. рис. 5.2, 5.7). Потенциалзависимые каналы открываются при изменении мембранного потенциала. Активность рецептороуправляемых каналов изменяется при взаимодействии некоего гормона (или лиганда) со специфическим рецептором (см. рйс. 5.10).Наиболее распространены потенциалзависимые Са-каналы L-muna (Long-lasting, т. е. долгоживущие), которые, будучи активированы при деполяризации мембраны, сохраняют это состояние относительно долго. Их повторяющиеся открывания обеспечивают длительный кальциевый ток через мембрану. Характерным признаком, отличающим Са-каналы L-типа от других, является их чувствительность к дигидропириди- нам, фенилалкиламинам и бензотиазепинам. У потенцйалзависимых Са-каналов сенсор внешнего сигнала является составной частью каналообразующего комплекса.Следует заметить, что деление на потенциалзависимые и рецептороуправляемые каналы достаточно условно, поскольку для многих потенциалзависимых каналов показана прямая регуляция рецепторами. В свою очередь есть данные, свидетельствующие о том, что активность рецептороуправляемых каналов может зависеть от мембранного потенциала. Са-каналы, активируемые при деполяризации мембраны, относительно высокоселективны для ионов кальция и демонстрируют низкую проводимость единичного канала. Целый ряд сигналов, включая синий или красный свет, фитогормоны, нодуляци- онные (NOD) факторы и грибные элиситоры, вызывают быструю деполяризацию мембраны, которая достаточна для открывания Са-каналов. Этот тип Са-каналов имеет важное значение в ответных реакциях растений на внешние воздействия. Они активируются, когда мебранный потенциал становится ниже -140 мВ. При этом в качестве эффективного механизма деполяризации часто служит поток анионов из клетки через анионные каналы плазмалеммы.Потенциалзависимые Са-каналы плазмалеммы растительных клеток (в отличие от животных) могут активироваться и при гиперполяризации мембраны. В клетках томатов выявлены, например, Са-каналы, которые активируются только при мембранном потенциале выше -120 мВ. При деполяризации мембраны их активность снижалась. Механочувствителъные Са-каналы активируются при механическом натяжении мембраны и при изменении осмотических характеристик цитоплазмы или внешней среды. Каналы такого типа, участвующие в транспорте Са2+, были найдены в плазма- лемме и эндоплазматическом ретикулуме растительных клеток. Они отличаются специфичностью по отношению к ионам Са (соотношение токов Са:К составляет у разных объектов от 7:1 до 17:1) и сравнительно невысокой проводимостью одиночного канала.
Рецептороуправляемыми (рецепторооперируемыми) каналами обычно называют каналы плазмалеммы, у которых основные белковые компоненты (ион-переносящая пора, воротный механизм) пространственно отделены от рецептора, который расположен в той же мембране. Эти каналы участвуют в повышении концентрации ионов Са2+ в цитоплазме при связывании гормонов с их рецепторами на плазматической мембране. От потенциалзависимых Са-каналов они отличаются слабой чувствительностью к органическим блокаторам. В растительных клетках найдены рецепторооперируемые Са- каналы, активируемые такими гормонами, как АБК и ИУК.
В плазмалемме растительных клеток обнаружены относительно низкоселективные катионные каналы, через которые осуществляется транспорт и К+, и Са2+. Каналы этого типа характеризуются высокой проводимостью единичного канала и называются макси-катионными (maxi cation channels).
В вакуолярной мембране идентифицировано четыре типа кальциевых каналов. Два из них являются потенциалзависимыми, один из которых активируется при гиперполяризации мембраны, а другой — при ее деполяризации. На тонопласте также обнаружены Са-каналы, активируемые такими вторичными посредниками, как инозитол- 1,4,5-трисфосфат (IP3) и циклическая ADP-рибоза (cADPR). Фармакологический анализ cADPR-завиеимого Са-канала свидетельствует о его сходстве с рианодиновым рецептором, который наряду с 1Рз-рецептором обеспечивает высвобождение кальция из эндоплазматического ретикулума в процессе сигнализации в клетках; животных организмов.
Анионные каналы. Клетки растительных организмов в обычных условиях характеризуются очень высоким электрохимическим градиентом анионов на плазматической мембране. Например, у Chara хлорный диффузионный потенциал (рассчитанный по уравнению Нернста) на плазмалемме, достигает (+300)-(+340) мВ. Поэтому активация анионных каналов, как правило, вызывает резкие изменения мембранного потенциала. Это важная особенность физиологии анионных каналов растений отличает их от анионных каналов животных, у которых ионы С1~ близки к состоянию электрохимического равновесия между клеткой и средой. В растениях, по-видимому, только ионы К+ находятся в равновесных условиях между цитоплазмой и средой. Для большинства же других ионов (Н+, Са2+, Na+ и С1~) электрохимические градиенты на плазмалемме и тонопласте далеки от равновесных.
К- факторам, которые индуцируют открывание (или закрывание) анионных каналов, относятся их фосфорилирование или дефосфорилирование, изменение концентрации ионов Са2+ или мембранного потенциала. В плазмалемме и тонопласте харовых водорослей и высших растений имеются анионные каналы, активирующиеся при гиперполяризации мембраны и повышении содержания ионов Са2+ в цитоплазме.
Кальций-зависимые анионные каналы способны усиливать (амплифицировать) потенциал действия у харовых водорослей и обеспечивать мощные потоки хлора в процессе регулирования тургорного давления и движения устьиц. С1~-каналы плазмалем- мы, активируемые при увеличении содержания ионов Са2+ в цитоплазме, обеспечивают фазу деполяризации потенциала действия в растениях. При генерации потенциала действия у харовых водорослей концентрация ионов Са2+ в цитоплазме может достигать 0,6-1,0 мкМ из-за потока кальция снаружи и, возможно, из вакуоли. Это вызывает активацию Са2+-зависимых С1~-каналов, локализованных внутри цитоплазмы, и мощный поток ионов С1_ из клетки.
В плазмалемме клеток высших растений методом петч-кламп (см. с. 159) обнаружены анионные каналы, активирующиеся ауксщом, деполяризацией мембраны, и ме- уянр^унгтнитртткткг^ В замыкающих клетках устьиц, например, анионные каналы открываются при падении мембранного потенциала от -80 до -20 мВ. Этому процессу способствует IP3, который вызывает повышение концентрации кальция в цитоплазме и активацию Са-зависимых К+-каналов.
Потенциал- и Са-зависимые анионные каналы обнаружены и в тонопласте. На основании различий в проницаемости и селективности выделяют медленные (slow vacuolar, SV) и быстрые вакуолярные (fast vacuolar, FV) каналы. Следует отметить, что для анионных каналов характерна более высокая проницаемость для катионов, чем для анионов. Это объясняется, по-видимому, тем, что передвижение аниона через канал происходит только вместе с катионом, поскольку селективный фильтр канала, вероятно, представлен анионной группой. При этом SV-тип анионных каналов более специфичен к анионам, чем к катионам, и лучше проницаем для нитрата, чем для хлорида. Более высокая проницаемость для нитрата анионных каналов тонопласта, чем для С1~, по-видимому, связана с высоким содержанием NOJ в вакуоли.
В клетках растений наиболее эффективными блокаторами анионных каналов являются стилъбеновые дериваты (DIDS и SITS), этакриновая и антрацен-9-карбоновая (А-9-С) кислоты, ионы Zn2+. Са-зависимые С1_-каналы, видимо, более чувствительны к DIDS. Этакриновая кислота, Zn2+ и La3+ эффективнее блокируют С1~-каналы, активируемые при гиперполяризации мембраны. А-9-С угнетает работу и Са-зависимых С1~-каналов, и С1~-каналов, активируемых гиперполяризацией.
Механочувствительные ионные каналы. Фукционирование ионных каналов может зависеть от растяжения мембраны и ее смещения. Каналы, которые изменяют активность в зависимости от натяжения мембраны, называются механочувствителъ- ными.
Впервые Са2+-проводящие механочувствительные каналы были показаны на эндо- телиальных клетках, где они выполняют функции сенсора кровяного давления. Каналы с аналогичными свойствами были найдены в бактериях, грибах и высших растениях. В растениях механочувствительные Са-каналы выявлены методом петч-кламп в замыкающих клетках устьиц и в плазмалемме эпидермиса лука. Активность их зависит от температуры, рН и мембранного потенциала.
Функционирование механочувствительных каналов происходит в тесном взаимодействии с цитоскелетом. Предполагается, что чувствительность каналов к натяжению возрастает, если сила, приложенная к участку мембраны, концентрируется на канале посредством примембранного цитоскелета. Для этого механочувствительные Са-каналы с помощью специальных линкеров (белки анкиринового типа) прикрепляются к цитоскелету (актиновым филаментам). Выделяют два типа каналов, чувствительных к натяжению мембраны: SA-каналы (stretch-activated), активирующиеся при растяжении, и SI-каналы (stretch-inactivated), которые при растяжении мембраны инактивируются. В зависимости от объекта и типа клетки встречаются механочувствительные каналы, селективные к С1~, К+, Са2+ и другим двухвалентным катионам, проницаемые для моно- и двухвалентных катионов, и неселективные (или слабоселективные) для анионов и других катионов. Наиболее часто в качестве ингибитора используют гадолиний (Gd3+), который обратимо блокирует работу механочувствительных каналов в микромолярных (10 мкМ) концентрациях. Однако необходимо иметь в виду, что гадолиний может блокировать также работу ионных каналов других типов.