

Процессы переноса из раствора в твердую фазу
Процесс поглощения газообразных веществ или веществ из жидкой фазы жидкостями или твёрдыми телами называется сорбцией (лат. sorbеo – поглощаю). В зависимости от агрегатного состояния веществ различают два вида сорбции. Абсорбция – объемное поглощение газа жидкостью. Адсорбция – поглощение газообразного или жидкого вещества объемом или поверхностью твердого тела [31].
Для обозначения процессов перехода радионуклида из раствора в твёрдую фазу в данном пособии будет использован общий термин – сорбция. Твердую фазу называют сорбентом, а распределяющийся радионуклид – сорбатом.
Сорбент способен извлекать из воды растворенные в ней компоненты, в частности радиоактивные примеси. Характер поглощения зависит от природы сорбента, а также от формы состояния радиоактивного элемента в воде. Поглощение может происходить за счет действия физических сил (молекулярная сорбция) или за счет химического взаимодействия между сорбентом и поглощаемым веществом (химическое присоединение атома, молекулы или ионный обмен). Рассмотрим четыре основных типа взаимодействия (химизма) сорбента с сорбируемым веществом.
1. Ионный обмен. При этом типе взаимодействия твердое вещество поглощает из раствора ионы в обмен на эквивалентные количества ионов твердой фазы. Происходит замещение катиона матрицы (твердой фазы) на катион раствора:
|
RM1 + M2+ |
RM2 + M1+ , |
где R – полианион матрицы; |
|
|
M1 |
– катион матрицы; |
|
M2 |
– катион раствора, участвующий в обмене. |
|
В процессе обмена полианион матрицы остается без изменений, реакция имеет полную или частичную обратимость.
2. Гетерогенная ионообменная реакция. Это реакция превращения одного вещества в другое.
M+21A+ M22+ M+22A+ M12+ ,
где А – анион, входящий в состав сорбента.
Вещества M1А и M2А имеют совершенно разные кристаллохимические свойства. Ионообменная реакция необратима и протекает в сторону образования соединения с меньшим произведением растворимости. Такой химизм взаимодействия возможен только для макроконцентраций растворённых веществ и не учитывается для
Кафедра радиохимии и
прикладной экологии© |
124 |
|
микроконцентраций радионуклидов, так как при микроконцентрации число ядер будет недостаточно для образования самостоятельной твердой фазы.
3. Электронно-ионообменная реакция.
M+21A+ M2+ M+22A+ M1+
Отличие этого процесса от предыдущего состоит в изменении степени окисления иона сорбата с последующей гетерогенной ионообменной реакцией. Электронно-ионообменной реакции свойственна необратимость.
4. Молекулярная сорбция.
RM1 + M2 |
1 2 |
При молекулярной сорбции происходит поглощение сорбентом молекулы в целом. Механизм молекулярной сорбции предполагает любые виды межмолекулярных взаимодействий, не связанных с образованием химических связей между молекулами сорбата и функциональными группами сорбента. Реакция хорошо обратима.
Теория межфазного распределения предполагает рассмотрение трех разделов: статики, кинетики и динамики этого процесса.
Основы статики межфазного распределения
Статика исследует термодинамически равновесное состояние гетерогенных систем, т.е. фиксирует равновесное распределение вещества между двумя фазами определенной массы или объема при заданных концентрации и температуре. Процесс проводят в сосуде, в который помещают навеску сорбента и определенное количество раствора, содержащего радионуклид. Суспензию перемешивают до достижения состояния равновесия. После приведения фаз в контакт начинается переход радионуклида из раствора в фазу сорбента. Процесс этого перехода самопроизволен, т.е. он протекает в сторону уменьшения свободной энергии Гиббса.
Следует различать термодинамическое и эмпирическое равновесие. Термодинамическое равновесие наступает тогда, когда энергия Гиббса минимальна. Оно может устанавливаться месяцы и годы. Поскольку технологические процессы протекают в реальном времени и не могут осуществляться годами, дожидаясь установления термодинамического равновесия, то базируются они на эмпирическом равновесии. Эмпирическое равновесие – такое состояние гетерогенной системы, когда во времени перестают изменяться все измеряемые параметры (Vж, mс , t , р = const). Обычно измеряют скорость счета (I, имп/с) раствора или твердой фазы. Эмпирическое равновесие наступает намного быстрее по сравнению с
Кафедра радиохимии и
прикладной экологии© |
125 |
|

термодинамическим (за часы, дни) и может считаться правомочным с точки зрения практики.
Так, при рассмотрении статики считают, что система пришла в равновесие. Скорость же межфазного распределения исследуется в разделе «кинетика», и зависит она от множества факторов.
Предположим, что процесс перехода радионуклида из раствора в твёрдую фазу протекает по реакции катионного обмена
R + + ,
где Э – обменивающийся катион твердой фазы; М – катион сорбата (радионуклида).
Тогда термодинамическая константа равновесия (ǽ ) будет равна
ǽ= ам аэ ,
ам аэ
где ам – термодинамическая активность сорбата в твердой фазе;
аэ – термодинамическая активность катиона в растворе; аэ – термодинамическая активность катиона в твердой фазе; ам– термодинамическая активность сорбата в растворе.
Термодинамическую активность определяют как а = с·f , где f – коэффициент активности, с – концентрация. Тогда термодинамическая константа равновесия реакции катионного обмена
ǽ = ссм ff м ccэ ffэ , м м э э
где cм = cТ – концентрация сорбата в твёрдой фазе; cм= cр – концентрация сорбата в растворе.
Ионообменные центры твердой фазы могут быть заняты либо катионом М+ , либо Э+, так как в системе присутствуют только два конкурента. В этом случае полная ионообменная емкость сорбента (число доступных сорбционных центров) Г∞ (гамма):
|
Г∞ = |
с с |
с |
Г |
|
-с |
Г -с |
|
|
|
|
|
|||||||||||||||||
|
|
м |
|
э |
|
э |
|
|
|
|
|
м |
|
|
|
|
т . |
|
|
|
|
||||||||
Тогда |
|
|
|
|
э э |
|
|
|
|
|
|
|
|
|
т э |
|
|
|
|
|
|
|
|
|
|||||
|
cт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
ǽ= |
fм |
|
|
|
|
|
|
|
|
|
|
м э |
; |
||||||||||||||||
с f |
|
( |
|
|
c |
|
|
|
|
c |
|
|
|
c |
|
|
|
f |
|
|
|
|
|||||||
м |
|
|
f |
|
р |
|
т |
м |
f |
э |
|||||||||||||||||||
|
р |
|
|
|
т |
э |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Кафедра радиохимии и
прикладной экологии© |
126 |
|

|
|
|
cТ |
|
|
|
|
|
|
|
|
fм |
|
|
|
|
|||||
|
|
|
|
|
|
ǽ |
|
fэ |
|
, |
|||||||||||
с |
|
( |
|
с |
с |
|
|
|
|
f |
|
||||||||||
р |
|
f |
м |
||||||||||||||||||
|
|
Т |
|
|
|
|
|
э |
|
|
|
|
|
э |
|||||||
|
|
|
|
|
|
|
fм |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
где |
ǽ |
|
|
fэ |
|
|
|
а. |
||||||||||
|
|
|
|
с |
|
|
|
f |
|
|
|
||||||||||
|
|
|
f |
м |
э |
||||||||||||||||
|
|
|
|
|
|
э |
|
|
|
|
|
|
|
|
|
|
|||||
В данном случае а – параметр сорбционного сродства, для СЭ =const может быть принят величиной постоянной, так как даже при некотором изменении коэффициентов активности их отношение остаётся практически постоянным. Чем он больше, тем выше вероятность прилипания частицы к твердой фазе.
ст =а (Г∞- ст ) ср = а·ср·Г∞ – а·ср·ст ; ст + а · ст · ср =а · ср · Г∞ ; ст (1 + а · ср) = а · ср· Г∞.
После преобразований получим изотерму Лэнгмюра:
ст = |
а cр Г |
. |
1 а c |
||
|
р |
|
На рис. 26 изображён график этой функции.
cт
Г∞
 cт = f (cр)
cт = f (cр)
cр
Рис. 26. Изотерма Лэнгмюра
Поверхность сорбента ограничена, поэтому по мере увеличения концентрации определяемого вещества она насыщается. Это положение в теории Лэнгмюра является основным и уточняется следующими допущениями:
1.сорбция локализована на отдельных сорбционных центрах, каждый из которых взаимодействует только с одной молекулой сорбата;
2.сорбционные центры энергетически эквивалентны;
3.сорбированные молекулы не взаимодействуют друг с другом.
Эти условия выполняются не всегда, поэтому не редко межфазное распределение описывают другие изотермы.
Кафедра радиохимии и
прикладной экологии© |
127 |
|
Полную ионообменную ёмкость сорбента можно определить прямым методом измерения в области насыщения. Если получить данные в широком интервале концентраций сорбата, то можно, кроме величины емкости сорбента, установить формальный закон сорбции, т.е. вид изотермы и ее параметры.
Г∞ – количественный параметр сорбции; а – параметр сорбционного сродства, характеризующий качественные характеристики сорбента и сорбата, так как по определению включает в себя их термодинамические параметры. Параметр сорбционного сродства характеризует энергию взаимодействия сорбата и сорбента и зависит от температуры, диэлектрической проницаемости, ионной силы раствора, значения рН.
Сорбционные характеристики сорбента важны для оценки возможности достижения конкретных технологических целей. Чем больше сорбционная емкость сорбента, тем большее количество радионуклида он может извлечь из раствора.
Введем параметр θ – степень заполнения сорбционных центров:
|
|
|
|
|
|
θ |
|
|
c т |
, |
|
|
|
|
||
|
|
cр |
|
р |
|
Г |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
а c |
|
|
|
|
|
||||
тогда |
|
|
|
|
и |
θ |
|
|
р |
|
. |
|
|
|
||
|
Г |
|
1 а c |
|
|
|
|
|
||||||||
|
|
1 а c |
|
|
|
|||||||||||
|
|
|
|
р |
|
|
|
|
|
р |
|
|
|
|||
Обозначим |
θ0 – долю свободной поверхности, не занятой сорбатом. |
|||||||||||||||
|
|
|
|
|
θ0 = 1 – θ = 1 – |
|
а cр |
|
1 |
. |
||||||
|
|
|
|
|
|
1 а cр |
1 а cр |
|||||||||
Эта величина обратно пропорциональна концентрации сорбата в растворе.
Если ср→ ∞, то аср >> 1 и θ0 → 0, т.е. при большой концентрации сорбата в растворе степени заполнения сорбционных центров высоки и доля свободной поверхности стремится к нулю.
Если рассматривать радионуклид |
как микрокомпонент, то ср→ 0, |
||
а· ср << 1, θ0 → 1 и θ = ст /Г∞ → 0. |
|
||
В этом случае |
|
||
ст = |
Г а cр |
, где |
а· ср << 1, т.е. а · ср → 0, |
1 а c |
|||
|
р |
|
|
отсюда
ст = Г∞ · а · ср .
Это выражение называют изотермой Генри. Введём обозначение Г∞· а = kd ,
где kd – генриевский коэффициент распределения.
Тогда |
ст = kd ·ср. |
Кафедра радиохимии и
прикладной экологии© |
128 |
|

В области малых концентраций устанавливается прямо-пропорциональная зависимость между концентрациями сорбата в твердой фазе (ст) и
растворе (ср).
Коэффициент распределения является наиболее фундаментальной характеристикой межфазного распределения, так как учитывает свойства и сорбата, и сорбента (Г∞, а ). Устанавливает соотношение между
равновесными концентрациями радионуклида в растворе и твердой фазе и в области выполнения закона Генри не зависит от концентрации сорбата.
kd = ст / ср.
Обычно измеряют коэффициент распределения в л/кг или мл/г. Чем выше kd, тем ярче процесс переноса сорбата из раствора в твердую фазу, поэтому его называют мерой специфичности. Специфичность – возможность извлечения, высокая вероятность прилипания.
|
На величину kd в общем случае влияют: |
концентрация сорбата в растворе; |
|
концентрация фонового катиона в растворе (конкурента сорбата ); |
|
|
концентрация лиганда; |
|
рН; |
|
удельное содержание сорбента в системе ([m] = m / V, г/мл ); |
|
температура. |
|
По коэффициенту распределения kd можно выбрать наиболее |
эффективный сорбент для данного радионуклида. Величины kd ≈ 103–105 мл/г считаются высокими.
При проведении эксперимента можно определить генриевский коэффициент распределения kd из экспериментальных данных, построив график в координатах «lg ст – lg ср»(рис. 27).
lg ст
ст = kd ·ср;
lg ст = lg kd + lg ср.
α
lg kd 
lg ср
Рис. 27. Изотерма сорбции в области выполнения закона Генри
Прологарифмировав выражение изотермы Генри, получим уравнение прямой с угловым наклоном tg α = 1, отсекающей на оси ординат участок, равный lg kd.
Кафедра радиохимии и
прикладной экологии© |
129 |
|

ЛЕКЦИЯ 15 СТАТИКА МЕЖФАЗНОГО РАСПРЕДЕЛЕНИЯ
Сорбционные характеристики: степень извлечения, распределительное отношение, коэффициент разделения, коэффициент очистки. Влияние форм состояния радиоактивных микрокомпонентов в водных растворах на межфазное распределение. Вид зависимости “lg ε – lg [m]”. Роль радиоколлоидов в биосферном переносе техногенно-рассеянных радионуклидов и процессах очистки радиоактивно-загрязнённых вод.
К сорбционным характеристикам, наиболее часто употребляемым для описания процессов межфазного распределения относят: степень извлечения, распределительное отношение, коэффициент распределения, коэффициент разделения, коэффициент очистки.
Cтепень извлечения (S) – это безразмерная величина, показывающая, какая доля абсолютного количества извлекаемого компонента перешла в сорбент.
S = Iисх - Iр Iисх ,
где Iисх – исходная скорость счета растворов, имп/мин; Iр – равновесная скорость счета растворов, имп/мин.
Иногда вместо термина «степень извлечения» употребляют «степень сорбции». Степень извлечения изменяется в пределах
0 < S < 1.
В случае отсутствия сорбции S = 0, а в случае полного извлечения компонента из раствора в сорбент S = 1. Эта величина может быть определена непосредственно из опыта на основании радиометрических данных.
Можно найти связь kd с величиной S:
S V kd =1- S m ,
где V – объем раствора, m – масса сорбента.
Отношение m/V называют удельной массой сорбента в системе – [m], измеряют в г/мл. В статических условиях можно варьировать удельную массу добавляемого сорбента, чтобы добиться высоких степеней очистки воды. При этом из выражения
S = kd [m]
1+ kd [m]
видно, что чем выше величина kd , тем меньшая удельная масса сорбента нужна для полного извлечения радионуклида из раствора.
Кафедра радиохимии и
прикладной экологии© |
130 |
|
Например, на практике нужно решить задачу очистки радиоактивнозагрязненных сточных вод, для того чтобы сбросить их в открытый водоем.
Предположим, |
что исходная активность сточных вод Аисх≈ 1000 |
Бк/л, а |
||
активность сбросных вод |
Асброса |
может составлять не более 100 Бк/л. |
||
Рассчитаем |
требуемую |
для решения поставленной задачи |
степень |
|
извлечения радионуклида:
S = (1000-100) /1000 = 0,9.
Степень извлечения должна составлять не менее 90 %, радионуклид из раствора можно извлечь и полнее, но это потребует увеличения расхода сорбента и, следовательно, увеличит объем твердой фазы, поступающей на последующее захоронение. В целом стоимость процесса очистки возрастёт. В таких случаях выбирают экономически приемлемое решение. Для реабилитации больших территорий требуются дешевые сорбенты.
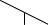
После предварительного расчёта проводим эксперимент, извлекая радионуклид из проб сточной воды несколькими сорбентами с разными коэффициентами распределения интересующего нас радионуклида при разной удельной массе. После построения графика в координатах «S – lg [m]» можно выбрать эффективную удельную массу каждого сорбента (рис. 28).
|
|
|
|
|
|
1 |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
|
|
0,6 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
0,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
|
0 |
|
|
-7 |
-6 |
-5 |
-4 |
-3lg [m]-2 |
-1 |
0 |
1 |
2 |
Рис. 28. Зависимость степени извлечения радионуклида от удельной массы сорбентов: 1 – kd= 10, 2 – kd= 104
Профиль кривой для разных сорбентов будет разный, так как они будут обладать разной специфичностью к радионуклиду, у них будет разное количество сорбционных центров (емкость), а также будет разная скорость протекания процесса (это важно, если время ограничено). По соотношению «цена и эффективная удельная масса сорбента» выбирают экономически приемлемый для очистки сорбент.
В случаях, когда сорбент используется для решения аналитических задач, соотношение количества сорбента и раствора может быть самым
Кафедра радиохимии и
прикладной экологии© |
131 |
|
разным. Применяемые в методиках анализа сорбенты могут быть более дорогими, но обеспечивающими требуемое качество и экспрессность анализа.
Можно ввести еще одну сорбционную характеристику –
распределительное отношение (ε):
= S / (1- S).
Эта величина представляет собой отношение абсолютных количеств сорбированного и оставшегося в растворе компонента (или их долей). Распределительное отношение является величиной безразмерной, область определения которой изменяется в интервале:
0 < . |
|
Распределительное отношение можно рассчитать, |
используя другое |
выражение: |
|
= kd [m].
В том случае, когда технологический интерес представляет растворитель, а не находящиеся в нем компоненты, определяют коэффициент очистки (Kоч). Он показывает, во сколько раз уменьшается концентрация компонента в растворе после выполнения операций по его удалению.
Kоч = 1/ (1 - S),
а после подстановки S = / (1 + ):
Kоч = 1 + .
В природе, как правило, нет однокомпонентных смесей, они многокомпонентные. В связи с этим введем термин «селективность». Селективность – это избирательность извлечения. Селективность сорбции характеризуют коэффициентом разделения. Если в системе присутствуют несколько радионуклидов, то в межфазном распределении каждый из них характеризуется своей величиной коэффициента распределения kd,i. Коэффициентом разделения компонентов x и y называют отношение коэффициентов распределения разделяемых компонентов:
Kразд.(x,y) = kd,x / kd,y .
Поведя эксперимент по сорбции двух радионуклидов одним сорбентом можно построить зависимость степени извлечения радионуклидов от логарифма удельной массы сорбента. Она будет иметь вид, аналогичный рис. 28. Используя данную зависимость, можно выбрать условия разделения радионуклидов.
Факторы, влияющие на селективность сорбции, многочисленны. Основной фактор – сродство компонентов к поверхности сорбента и к
Кафедра радиохимии и
прикладной экологии© |
132 |
|
растворителю. Сродство к сорбенту будет определяться свойствами сорбента и радионуклида. Степень влияния сорбента на величину сорбции определяется химической природой его поверхности и размером пор. Поверхность сорбента может содержать функциональные группы, способные к специфическим взаимодействиям с сорбатом, образованию водородных связей, диполь-дипольному взаимодействию. Соответственно вещества, более склонные к такому взаимодействию, будут лучше сорбироваться.
Влияние форм состояния радиоактивных микрокомпонентов в водных растворах на межфазное распределение
Некоторые химические элементы конца периодической системы, химические свойства которых достаточно хорошо известны, находясь в микроконцентрациях в водных растворах, часто ведут себя непредсказуемым образом. Связано это с образованием разных форм состояния в растворе, которые по-разному ведут себя в процессах межфазного распределения. Влияние форм состояния радиоактивных микрокомпонентов будет проявляться и в биосферном переносе техногеннорассеянных радионуклидов, и в процессах очистки радиоактивнозагрязнённых вод. Если микрокомпонент в растворе представлен несколькими формами состояния, его поведение можно предсказать, зная все его формы и характер их взаимодействия между собой.
Микрокомпонент в растворе может образовывать следующие формы состояния:
простые ионы;
комплексные ионы;
моноядерные и полиядерные гидроксокомплексы;
истинные и псевдоколлоиды.
Сведения о формах состояния микрокомпонента в водном растворе и о наличии подвижного равновесия между ними можно получить сорбционным
методом исследования, построив изотерму в координатах «lg – lg [m]». Перечисленные формы состояния будут по-разному сорбироваться твердой фазой, поэтому в особых случаях изотерма будет иметь различный вид. Особенности изотермы (общий вид, экстремальные точки, наибольшие значения ε) будут зависеть от числа разносорбирующихся сортов, их долей, генриевских коэффициентов распределения каждого сорта и т.п.
Рассмотрим различные варианты:
1. Cорбат-микрокомпонент моносортовой (радионуклид представлен одной формой состояния МZ+). В этом случае его сорбционное поведение описывается законом Генри
= kd [m].
Кафедра радиохимии и
прикладной экологии© |
133 |
|

Прологарифмируем: lg = lg kd + lg [m]. Величина генриевского коэффициента распределения kd в этом случае не зависит от удельной массы сорбента:
lg kd / lg [m] = 0.
Тогда изотерма сорбции в координатах «lg – lg [m]» выразится прямой линией с угловым коэффициентом, равным единице (рис 29). По графику можно определить генриевский коэффициент распределения kd.
2. Сорбат-микрокомпонент представлен несколькими разносорбирующимися (в том числе и несорбирующимися) сортами, между которыми имеется подвижное равновесие, быстро восстанавливающееся в случае убыли какойлибо из форм. Такой сорбат называется неоднородным (полисортовым,
сложным) лабильным сорбатом.
Между формами состояния сорбата возможны взаимные превращения
одной формы в другую
Mz+ ML(z-1)+ ML(z-2)+ MLz0 … MLn (z-n)-.
В случае лабильного сорбата скорость превращения одних форм в другие выше скорости сорбции. При постоянной ионной силе раствора, рН и неизменной природе сорбента между формами устанавливается динамическое равновесие. Внесение сорбента в раствор лабильного сорбата не вызывает нарушения равновесия, поэтому для каждой из форм доля i-сорта в растворе является величиной постоянной и не зависит от удельного содержания сорбента в системе ( i = const, i f [m]). То же самое можно сказать и о генриевском коэффициенте распределения каждого сорта kd,i
(kd,i = const, kd,i f [m]).
Таким образом, если сорбат неоднородный и лабильный, то изотерма сорбции в координатах «lgε – lg [m]» будет прямой линией с угловым коэффициентом, равным 1 (см. рис. 29),как и для моносортовой системы.
ε– обобщенное сорбционное отношение:
ε[m] n kd,i [m] kd ,
1 |
|
|||
где |
|
|
|
|
kd – обобщённый коэффициент распределения. |
||||
|
|
lg |
|
|
|
|
|
α |
tg α = 1 |
lg kd 
lg [m]
Рис. 29. Моносортовой сорбат или сложный лабильный сорбат
Кафедра радиохимии и
прикладной экологии© |
134 |
|

3. Сорбат-микрокомпонент, представлен несколькими разносорбирующимися (в том числе и несорбирующимися) формами, между которыми подвижное равновесие отсутствует или устанавливается намного медленнее, чем сорбционное равновесие. Такой сорбат называют неоднородным
(сложным) инертным сорбатом.
Превращение одних форм в другие происходит крайне медленно по сравнению со скоростью сорбции. Обычно отсутствие подвижной связи характерно для коллоидных и полимерных форм состояния сорбата. Каждый сорт характеризуется своими значениями i и kd,i . Для этого случая i const,i = f [m]. Убыль сорбирующейся формы приведет к ее исчезновению, другие формы останутся без изменения. Все формы состояния ведут себя при межфазном распределении независимо друг от друга. Если массу [m] увеличивать, то в процесс сорбции будут вовлекаться все более слабосорбируемые формы.
Поэтому, если сорбат неоднороден и инертен, то изотерма сорбции в
координатах «lg – lg [m]» будет иметь сложный профиль. При больших значениях [m] угловой коэффициент касательной к изотерме отклоняется от единицы в меньшую сторону. Наиболее характерные изотермы в координатах «lgε – lg [m]» приведены на рис. 30 – 32.
Вид графика зависит от наличия несорбирующихся форм и их количества. Несорбирующимися формами могут быть отрицательно заряженные комплексные ионы, если сорбент обладает катионообменной функцией, или положительно заряженные формы, если сорбентом является анионит. На практике часто встречаются промежуточные случаи, когда систему форм состояния нельзя отнести ни к лабильной, ни к инертной. Некоторые из форм состояния могут быть связаны друг с другом лабильной связью (например, моноядерные ионно-молекулярные формы), а другие формы состояния (полимерные ионы, коллоиды) могут быть инертны.
lg |
|
lg[m] |
tg =1 |
Рис. 30. Сложный инертный сорбат, имеются несорбирующие сорта (их доля мала)
Кафедра радиохимии и
прикладной экологии© |
135 |
|

|
lg |
lg |
|
lg[m |
lg[m |
|
|
|
|
|
|
tg =1 |
|
Рис. 31. Сложный инертный сорбат с |
Рис. 32. Сложный инертный сорбат, |
|||
большой долей несорбирующихся сортов |
состоящий |
из |
небольшого |
числа |
|
сорбирующихся |
сортов, |
резко |
|
|
отличающихся |
значениями |
частных |
|
|
генриевских постоянных |
|
||
На рис. 32 число линейных участков соответствует числу сорбирующихся форм. Каждый из линейных участков соединен с другими плавной кривой с точкой перегиба. По графику можно определить
коэффициент распределения kd,i |
каждой сорбирующейся формы. |
|
Коэффициенты распределения разных сорбирующихся форм |
могут |
|
отличаться в десятки раз, но даже при этом разница в отрезках, отсекаемых линейными участками на оси ординат, не столь велика. Поэтому, если число экспериментальных точек мало, то невозможно выявить отдельные линейные участки изотермы. Можно только определить, что угловой коэффициент касательной к изотерме меньше единицы (tg α < 1).
Знание форм состояния радионуклидов в водных растворах и характера их взаимодействия между собой чрезвычайно важно как для реализации технологических процессов, так и объяснения особенностей миграции радионуклидов в окружающей среде, прогнозирования изменения радиационной обстановки на загрязнённых территориях, проведения реабилитационных мероприятий. Например, при очистке радиоактивнозагрязнённых сточных вод, если сорбат лабильный и сорбент извлекает хотя бы одну из форм состояния, можно полностью извлечь весь радионуклид за счет перераспределения между формами. Если сорбат инертен и присутствуют несорбирующиеся сорта, то одного сорбционного способа очистки будет недостаточно и необходимо применение комплекса методов.
Кафедра радиохимии и
прикладной экологии© |
136 |
|
ЛЕКЦИЯ 16 ДИНАМИКА И КИНЕТИКА МЕЖФАЗНОГО РАСПРЕДЕЛЕНИЯ
РАДИОНУКЛИДОВ
Хроматографический метод разделения смесей. Виды хроматографии. Кинетика межфазного распределения. Математические модели, используемые для описания кинетики сорбции радионуклидов твердой фазой.
Хроматографический метод является физико-химическим методом разделения компонентов сложных смесей газов, паров, жидкостей или растворённых веществ и основан на использовании сорбционных процессов в динамических условиях. Простота, эффективность и универсальность хроматографического метода обусловили его применение для решения различных радиоэкологических и радиохимических задач. С необходимостью разделения и анализа смеси радионуклидов сталкиваются в задачах радиохимического анализа, при переработке рудного сырья при добыче урана и тория и переработке облучённого ядерного горючего.
Эффективность разделения значительно увеличивается, если процесс перехода вещества из одной фазы в другую с последующим установлением межфазного равновесия повторяется многократно. Многократного повторения межфазного равновесия можно достичь, если разделение смеси радионуклидов производить так, чтобы одна из фаз (подвижная) перемещалась относительно другой (неподвижной). Эти условия выполняются в хроматографическом методе разделения смеси веществ.
Открытие хроматографии (1903 г.) как метода принадлежит русскому учёному Михаилу Семёновичу Цвету. Он впервые разделил динамическим методом хлорофилл на две разные формы (различно окрашенные). “Хромос” в переводе с греческого означает “цвет”, отсюда и произошло название метода. Работы М.С. Цвета послужили фундаментом для развития остальных видов хроматографии. Впоследствии хроматографический метод нашёл применение для анализа неокрашенных веществ, осуществляемого в любых средах.
Хроматографический метод разделения основан на различной сорбционной способности веществ, которая зависит как от природы сорбата, так и сорбента, поэтому вещества передвигаются по колонке с разной скоростью. Разные вещества находятся на поверхности сорбента неодинаковое время. Если вещество сорбируется сильнее, то оно дольше удерживается на поверхности сорбента. При достаточной длине слоя сорбента можно разделить смесь на составляющие её компоненты. В связи с тем, что подвижная фаза непрерывно движется, лишь часть каждого из компонентов разделяемой смеси успевает взаимодействовать с поверхностью неподвижной фазы. Остальное уносится потоком подвижной фазы и взаимодействует уже с новым участком сорбента. Задержанные неподвижной фазой компоненты смеси не участвуют в движении потока подвижной фазы
Кафедра радиохимии и
прикладной экологии© |
137 |
|

до тех пор, пока они не десорбируются и не будут перенесены в поток подвижной фазы. Поэтому перенос компонентов смеси вдоль слоя сорбента осуществляется со скоростью меньшей, чем скорость потока подвижной фазы. Поэтому говорят, что при хроматографии многократно повторяются акты сорбции и десорбции.
Таким образом, хроматография – физико-химический метод разделения смесей, основанный на перемещении дискретной зоны вещества вдоль неподвижного слоя сорбента в потоке подвижной фазы и связанный с многократным повторением актов сорбции и десорбции.
Хроматографические методы классифицируются по следующим признакам [32]:
по агрегатному состоянию, в котором производится разделение смеси на компоненты – газовая, жидкостная и газо-жидкостная хроматография;
по механизму разделения – адсорбционная (жидкостная, газовая), распределительная, ионообменная, осадочная, окислительно-восстанови- тельная, адсорбционно-комплексообразовательная хроматография;
по форме проведения процесса – колоночная, капиллярная,
плоскостная (бумажная и хроматография в тонком слое).
Наиболее широко используется колоночная хроматография, в процессе которой разделение компонентов смеси происходит в хроматографической колонке, заполненной сорбентом.
В зависимости от способа передвижения компонентов смеси вдоль неподвижной фазы различают три метода: фронтальный, элюентный и вытеснительный.
1. Фронтальная хроматография.
В случае фронтальной хроматографии раствор с одним радионуклидом или смесью радионуклидов непрерывно вводят в колонку и следят за появлением радионуклида в фильтрате. Этот метод не пригоден для разделения близких по свойствам компонентов и обычно используется для извлечения из смеси сильно сорбирующихся веществ.
1.1. Если в растворе присутствует один радионуклид в форме Mz+, тогда фронтальная выходная кривая будет иметь вид рис. 33.
Рис. 33. Фронтальная выходная кривая для одного радионуклида
Кафедра радиохимии и
прикладной экологии© |
138 |
|
Если в колонку вводят раствор, содержащий радионуклид, способный проникать в сорбент, то сорбент может поглощать и извлекать его из раствора до тех пор, пока вся набивка колонки не придёт в равновесие с протекающим раствором. Движение в колонке происходит с определённой скоростью, и равновесие между фазами не достигается. Однако при соответствующих условиях хроматографический процесс может приближаться к равновесному. Количество связанного в колонке радионуклида будет функцией коэффициента распределения. Ему соответствует некоторый объём обработанного раствора VR до точки перегиба на концентрационной кривой, называемый в хроматографии
удерживаемым объёмом.
VmR = Vm + VR,
где Vm – свободный объем колонки (объем, занятый в колонке подвижной фазой, в данном случае водной).
Для условий равновесной динамики |
|
|
VR= kd mс, |
|
|
где mс – масса сорбента, kd – коэффициент распределения. |
пропорционален |
|
Таким образом, удерживаемый объём |
прямо |
|
коэффициенту распределения радионуклида, |
при условии выполнения |
|
закона Генри не зависит от начальной концентрации сорбата и определяется составом раствора.
Экспериментальные кривые, полученные в динамических условиях, позволяют определить не только динамический коэффициент распределения, но и полную динамическую ёмкость (ПДОЕ):
ПДОЕ = СоVR / mс .
Чем медленнее будет течь раствор, тем быстрее установится равновесие между фазами, поэтому идеальная колонка, которая работала бы в условиях мгновенно наступающего равновесия между фазами, была бы бесконечно протяжённой (имела бесконечное число теоретических тарелок).
1.2. Пусть в растворе присутствует смесь радионуклидов (А, В, С), каждый из которых присутствует в растворе в одной единственной форме состояния. Те из радионуклидов, которые не поглощаются сорбентом, проходят через колонку без задержки, другие же удерживаются сорбентом, и первые фракции вытекающего раствора оказываются свободными от них (рис. 34). Если для радионуклида А kd(А)=0, то вытеснение радионуклида А происходит в пределах свободного объёма колонки.
Прочность связывания для каждого из удерживаемых радионуклидов в большинстве случаев различна. Предположим, что kd(В) < kd(С), поэтому в вытекающем из колонки растворе первым окажется наименее удерживаемый
(VmR(В) = Vm + kd(В) mс), а последним – наиболее удерживаемый радионуклид
(VmR(C) = Vm + kd(С) mс).
Кафедра радиохимии и прикладной экологии©

Рис. 34. Фронтальная выходная кривая для смеси радионуклидов
Между этими двумя моментами состав вытекающего раствора будет изменяющимся: сначала он будет обогащён радионуклидом А, затем А+В и, наконец, сравняется по составу с исходным раствором (А+В+С). В процессе прохождения раствора через колонку будет происходить разделение радионуклидов. В случае фронтальной хроматографии в чистом виде можно получить только радионуклид А. За Vm концентрация радионуклида А достигла в фильтрате СА и больше не изменяется на протяжении всего времени фильтрации.
1.3. В растворе имеется один радионуклид, представленный любым набором форм состояния. Если система форм состояния радионуклида лабильна, то вид выходной кривой не отличается от изображённого на рис. 33. Для инертного сорбата, когда каждая форма состояния радионуклида ведёт себя независимо друг от друга, вид выходной кривой соответствует рис. 34, и возможно разделение отдельных форм.
Фронтальная хроматография не применяется для разделения смеси радионуклидов c инертными формами состояния, поскольку в этом случае эффективность разделения очень низкая.
2.Элюентная хроматография.
Вэлюентной хроматографии раствор разделяемой смеси радионуклидов (В, С) вносится в верхний слой колонки, в которой он занимает узкую полосу.
Затем колонка промывается подходящим элюентом – нейтральным растворителем или веществом, которое сорбируется хуже разделяемых компонентов. Для лучшего разделения необходимо ввести максимальное количество образца в минимальный объём растворителя. Количество образца не должно превышать ёмкости первой тарелки колонки. Разная скорость передвижения компонентов образца через колонку приводит к разделению смеси радионуклидов. В идеальном случае из колонки элюируются полностью разделённые зоны компонентов смеси (рис. 35).
Кафедра радиохимии и |
140 |
|
прикладной экологии© |
||
|
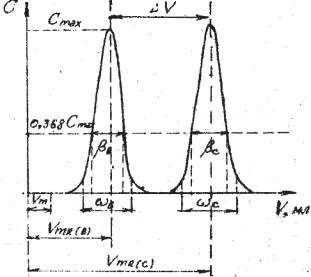
Рис. 35. Кривые элюирования смеси двух радионуклидов
Общий удерживаемый объём (VmR) в этом случае также зависит от величины kd и следовательно определяется составом элюэнта. По экспериментальной кривой элюирования могут быть рассчитаны коэффициенты распределения:
kd=(VmR – Vm)/ mс.
Если радионуклиды в растворе будут представлены набором форм состояния, то в случае лабильного сорбата вид выходной кривой будет аналогичен рис. 35. Для инертного сорбата возможно разделение отдельных форм состояния на различные зоны, что в случае присутствия в растворе смеси радионуклидов может привести к перекрытию пиков и снижению эффективности разделения.
Существенное значение для выбора условий хроматографического концентрирования и разделения имеет размытие зоны вещества в хроматографической колонке, определяемое кинетикой реакции межфазного перехода веществ, скоростью фильтрации раствора и геометрическими характеристиками сорбента.
Кинетика межфазного распределения радионуклидов
Сорбцию радионуклидов твердой фазой можно описать, используя различные математические модели. В этом случае по виду кинетических кривых можно определить, в каком режиме протекает процесс и выбрать оптимальные условия его проведения.
Процесс ионного обмена состоит из нескольких разделенных во времени и пространстве последовательных стадий, основными их которых являются следующие [33]:
Кафедра радиохимии и |
141 |
|
прикладной экологии© |
||
|

1.Доставка десорбирующего иона из раствора к поверхности зерна ионита. Ион диффундирует через пленку жидкости к поверхности зерна.
2.Диффузия десорбирующего иона от поверхности зерна ионита к некоторой точке в его объеме, в которой произойдет обмен.
3.Собственно ионообменный процесс (химическая реакция).
4.Диффузия десорбированного иона от места десорбции к поверхности зерна ионита.
5.Отвод десорбированного иона от поверхности зерна ионита в объем раствора.
Стадии 1 и 5 можно охарактеризовать как массоперенос, стадии 2 и 4 – как массопередачу, а стадия 3 – химическая стадия.
Процесс межфазного распределения – сложный и многостадийный. Совокупное рассмотрение всех стадий этого процесса трудноосуществимо, поэтому обычно прибегают к упрощениям, используя понятие лимитирующей стадии.
Элементарная стадия называется лимитирующей, когда закономерности всего процесса определяются, в основном, кинетическими закономерностями этой стадии. Это элементарная стадия с константой скорости, намного меньшей констант скоростей других последовательных стадий.
В реакции может быть несколько стадий с близкими по величине константами скорости. Тогда каждая из этих стадий будет вносить свой ненулевой вклад и определять закономерности всего процесса. Проанализируем стадии ионного обмена с точки зрения выявления лимитирующих.
Стадия 3 – ионообменная реакция – протекает весьма быстро. Относительно медленные процессы – диффузия вещества в жидкости. Еще медленнее происходит диффузия в пористом твердом теле и тем более в сплошной твердой среде. Поэтому определяющее влияние на скорость сорбции оказывают стадии массопереноса и массопередачи.
Скорость процесса при проведении эксперимента не может быть измерена непосредственно, о ней судят косвенно, путем анализа интегральных кинетических кривых, характеризующих зависимость количества вещества в объёме сорбента от времени:
M τ = f(τ) или Cτ= f (τ),
где M τ – число ядер сорбата в твердой фазе,
Cτ – концентрация сорбата в твердой фазе.
Существуют математические модели, отражающие закономерности межфазового распределения. Для них получены достаточно строгие зависимости. Результаты кинетических экспериментов обычно представляют в полулогарифмических координатах: «р(1–F) = – ln(1–F) – τ»,
Кафедра радиохимии и |
142 |
|
прикладной экологии© |
||
|

где F = Cτ / C∞ – степень достижения сорбционного равнвесия, Cτ и C∞ – текущая и равновесная концентрации сорбата в твердой фазе.
По виду кинетической кривой можно предположить, в каком режиме протекает процесс.
1. Внешнедиффузионный режим (рис. 36).
р(1–F) = γ τ=βс τ,
где γ – наблюдаемая константа скорости процесса,
βс – константа скорости внешней диффузии, зависит от скорости перемешивания и начальной концентрации сорбата в растворе, βс ~ D (коэффициент диффузии в жидкости).
р(1–F)
αtg α = γ
τ
Рис. 36. Вид кинетической кривой при внешнедиффузионном режиме сорбции
2. Внутридиффузионный режим (рис. 37).
р(1–F) = рА + γ τ,
где γ ~ D при больших временах диффузии (D– коэффициент диффузии в сорбенте).
р(1–F)
 α
α
τ
Рис. 37. Вид кинетической кривой при внутридиффузионном режиме сорбции
Для внутридиффузионной кинетики обычно наблюдаются:
независимость кинетической кривой от скорости перемешивания и концентрации внешнего раствора;
зависимость кинетической кривой от размера зерна сорбента.
Кафедра радиохимии и |
143 |
|
прикладной экологии© |
||
|
Для дополнительного доказательства внутридиффузионного режима процесса сорбции используют метод прерывания (или кинетической памяти). Для этого на некоторое время прекращают кинетический эксперимент, либо приостановив перемешивание, либо разделив фазы. Затем контакт раствора и сорбента возобновляют. При этом в случае внутридиффузионной кинетики за время перерыва должно произойти выравнивание градиента концентрации сорбата в фазе сорбента, что приводит к резкому увеличению скорости процесса после его возобновления, т.е. к явлению кинетической памяти. При внешнедиффузионной кинетике прерывание никак не сказывается на скорости процесса.
3.Для смешанно-диффузионного режима вид кинетической кривой – как на рис. 37.
4.Для процесса, который лимитируется химической реакцией обмена,
вид зависимости – как на рис. 36, а γ = k – константа скорости реакции обмена. Доказательством такого режима процесса является его зависимость от температуры. Если ускорение процесса наблюдается с повышением температуры, то сорбция лимитируется химической реакцией. Как уже было сказано ранее, реакция ионного обмена – быстрая и в редких случаях бывает лимитирующей, следовательно, при сорбции могут наблюдаться только диффузионные затруднения. Внутренняя диффузия затруднена, если произошло заполнение доступных сорбционных центров, а дальнейшее извлечение компонента из раствора происходит по мере их освобождения со скоростью внутренней диффузии.
Вреальных системах при описании экспериментальных результатов кинетические кривые имеют вид, свойственный внутридиффузионным или смешанно-диффузионным процессам. Однако поскольку радионуклидымикрокомпоненты склонны к гидролизу, комплексообразованию, образованию псевдо- и истинных коллоидов, сорбции стенкой вмещающей посуды, то рассмотрение кинетики сорбции без учета форм состояния микрокомпонента в растворе некорректно. Скорость перераспределения между формами конечна, что может повлиять на кинетику межфазового распределения.
Для выяснения лимитирующей стадии процесса межфазового распределения радионуклидов кинетический эксперимент проводят либо методом неограниченного объема, либо ограниченного объема раствора. В первом случае через слой сорбента непрерывно пропускают поток раствора с постоянной концентрацией и скоростью. Если слой сорбента тонкий, то концентрацию сорбата в растворе можно считать постоянной и равной исходной. Концентрацию десорбируемого иона можно принять равной нулю, если его первоначально не было в десорбирующем растворе.
Вметоде ограниченного объёма сорбция происходит заданной величиной навески сорбента из некоторого конкретного объёма перемешиваемого раствора, начальный состав которого известен. В этом случае концентрация сорбируемого иона в растворе меняется, но его общая
Кафедра радиохимии и |
144 |
|
прикладной экологии© |
||
|

концентрация в гетерогенной системе остается постоянной. Если применять достаточно интенсивное перемешивание, то можно достичь равномерного распределения концентрации ионов во всём объёме раствора за исключением прилегающих к зерну сорбента слоёв (пограничного слоя). Для выявления влияния форм состояния микрокомпонента в растворе на кинетику необходимо извлечение в фазу сорбента до 90–95 %, поэтому процесс осуществляют методом ограниченного объема. Метод неорганиченного объёма обычно используют для определения константы скорости внешней
диффузии (βс), коэффициентов диффузии в жидкости (D) и в твёрдом теле
(D).
Для учёта влияния форм состояния на кинетику сорбции можно рассмотреть ряд случаев.
1. Сорбат представлен единственной формой, которая и является сорбирующейся Мz+. Тогда
1–F = e- c -1τ) ,
где βс – константа скорости внешней диффузии,
αp– доля сорбата, оставшегося в растворе в равновесных условиях, αp = 1– S∞.
– ln (1–F) = βс/ αp τ .
Для бесконечно большого объема, когда (αp= 1), получаем
– ln (1–F) = βс τ .
Вид кинетической кривой, описываемой этим уравнением приведён на
рис. 36, тангенс угла наклона прямой |
tg α = βс. Для случая ограниченного |
||||
объема вид кривой также соответствует рис. 36, а tg α = β |
с |
(α )-1 . |
|
||
|
|
|
p |
М(ОН)i z-i. |
|
2. Сорбат образует |
моноядерные |
гидроксокомплексы |
|||
Ионообменники, как правило, лучше сорбируют ионы с большим зарядом, поэтому для простоты можно принять, что в сорбент переходит только
катион с максимальным зарядом Мz+. Между всеми формами гидроксокомплексов в растворе существует равновесие
Z-N |
β |
|
|
β |
|
|
|
|
N |
Z-N 1 N 1 |
…. |
||||||
М(ОН)N |
M(OH)N-1 |
|
||||||
|
β-N |
|
|
β-(1)N |
|
|
|
|
β2 |
Z-1 |
β1 |
Z+ |
βc |
|
|
Z+ |
|
|
|
|
||||||
|
|
|
M |
|
|
|
, |
|
…. M(OH) M |
|
|
|
|||||
β-2 |
|
β-1 |
|
|
|
|
|
|
где βi и β-i – модифицированные константы скорости прямой и обратной реакций, размерность – [τ-1].
Если вносим сорбент, то форма Мz+ из раствора убывает, и поэтому смещается равновесие между всеми другими формами гидроксокомплексов.
При убыли Мz+ изменится содержание всех других форм состояния, чтобы
Кафедра радиохимии и |
145 |
|
прикладной экологии© |
||
|
эту убыль скомпенсировать. Накопление формы Мz+ в сорбенте определяется внешнедиффузионным массопереносом, характеризующимся константой скорости βс.
2.1. Cистема комплексных форм состояния сорбата лабильна (βс << βi),
где βс – константа внешней диффузии, βi – константа образования i-гидроксокомплекса. Сорбция происходит медленнее, чем перераспределение между формами состояния в растворе. Тогда убыль формы МZ+ из раствора восполняется мгновенно за счет перераспределения
между формами и доля каждой формы αi=const. Если сорбент обладает высокой специфичностью, то возможен количественный переход
радионуклида в |
твердую фазу S→1, |
[ |
|
Z+] → |
Vр |
С0, |
где |
Vс – объем |
|||
|
|||||||||||
V |
|||||||||||
|
|
|
|
|
c |
|
|
|
Z+] → 0. |
||
сорбента. Если |
сорбция практически отсутствует: S→0, |
то |
[ |
|
|||||||
|
|||||||||||
Зависимость степени достижения равновесия от времени будет иметь вид |
|||||||||||
|
1–F = e- c |
-1 τ) . |
|
|
|
|
|||||
Если сорбат лабилен, то при любом сложном наборе форм состояния кинетическая кривая исходит из начала координат, на всем протяжении
линейна, с угловым коэффициентом tgα = βс/αp (см. рис. 36).
2.2. Пусть сорбат в растворе инертный и перераспределение между формами состояния сорбата отсутствует. При внесении сорбента в систему независимо друг от друга начинается извлечение всех сорбирующихся форм, их может быть несколько. Кинетику инертного сорбата будет описывать сумма
экспонент. |
Следовательно, |
в |
полулогарифмических |
координатах |
прямолинейной зависимости не будет. |
Если число сорбирующихся форм |
|||
n = 2, то вид |
кривой аналогичен рис. 37. |
|
||
Таким образом, формальное подчинение кинетической кривой виду рис. 37 еще не является доказательством внутридиффузионного режима сорбции. Оно будет таковым только в том случае, если установлено, что сорбат химически однороден, либо независимыми экспериментами показано, что он лабилен (скорость превращения одних форм сорбата в другие существенно выше скорости сорбции).
2.3. Можно рассмотреть и промежуточный случай, когда исключить перераспределение между формами состояния сорбата за время сорбции полностью нельзя, как это принято в модели инертного сорбата. Рассмотрим случай, когда стадией, определяющей скорость будет диссоциация
координационного насыщенного комплекса |
М(ОН) |
Z-N, |
тогда β |
N |
<<β , β |
. |
||||
В этом случае : |
|
|
|
|
N |
|
с |
i |
|
|
|
β |
|
|
|
|
|
|
|
|
|
1–F = e |
- |
τ |
, |
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|||
– ln (1–F) = βN /S ·τ .
Кафедра радиохимии и |
146 |
|
прикладной экологии© |
||
|
Накопление сорбата в сорбенте происходит по экспоненциальному закону со скоростью, определяемой кинетической константой диссоциации комплексного соединения. Такой режим процесса называется внешнекинетическим.
ЛЕКЦИЯ 17 СОРБЦИОННЫЕ МАТЕРИАЛЫ
Свойства сорбционных материалов, основные требования, предъявляемые к сорбентам в задачах прикладной радиоэкологии. Классификация. Сорбционные материалы: природные и искусственные.
В прикладной радиоэкологии сорбенты применяются для анализа и очистки природных вод от радиоактивных загрязнений, а также для очистки слабоактивных сточных вод предприятий ядерного топливного цикла. Систематизация разнообразных сорбционных материалов является сложной задачей. У сорбентов может быть однотипная матрица и многообразные функциональные группы, и наоборот, одни и те же функциональные группы могут прививаться к различным матрицам. Поэтому существуют всевозможные сочетания неорганических и органических матриц и функциональных групп. Современные ионообменные материалы могут быть твердыми, жидкими, кристаллическими и аморфными. Они обладают широким спектром свойств, характеризуемых с химической, физикохимической и механической сторон. К основным свойствам сорбентов относят следующие:
ёмкость (полная обменная ёмкость (ПОЕ), статическая обменная емкость (СОЕ), динамическая обменная емкость до «проскока» иона в фильтрат (ДОЕ));
химическая, термическая и радиационная устойчивость;
механическая прочность;
плотность, набухаемость, влагоемкость;
пористость, удельная поверхность;
специфичность и селективность;
скорость установления равновесия и т.п.
Емкость характеризует количественную способность ионита обменивать противоионы и определяется числом ионогенных групп. Каждый ионообменник содержит определенное число групп с подвижными обмениваемыми ионами. Число таких групп в единице массы (объема) ионообменника характеризует величину обменной емкости. Обменная емкость зависит от рН раствора. Полная обменная емкость – полное число ионогенных групп, имеющихся в единице веса или объема материала. Эта величина постоянная для данного материала. Она не зависит от температуры,
Кафедра радиохимии и |
147 |
|
прикладной экологии© |
||
|
концентрации и природы обменивающихся ионов, крупности зерен материала.
Статическая обменная емкость – количество сорбированных ионов единицей веса или объема материала в равновесных условиях. Обычно величина определяется путем контакта навески материала с определенным объемом исследуемого раствора в течение некоторого времени в статических условиях. Величина СОЕ зависит от многих факторов: концентрации и природы сорбированных ионов, температуры опыта и крупности зерен. Она служит для предварительной оценки сорбционной способности материала по отношению к данному иону.
Динамическая (рабочая) обменная емкость – количество сорбированных ионов в динамических условиях, отнесенное к единице массы или объема материала. Эта величина определяется путем фильтрования с постоянной скоростью раствора, содержащего исследуемые ионы известной концентрации, через колонку с известным количеством ионита до появления
(«проскока») иона определенной концентрации в фильтрате. |
|
Сорбенты, применяемые |
в задачах прикладной радиоэкологии, |
должны обладать высокой ёмкостью, высокой специфичностью,
химической, термической и |
механической |
устойчивостью, |
хорошей |
кинетикой процесса сорбции, |
а для решения некоторых задач – |
высокой |
|
радиационной устойчивостью и селективностью. Важным показателем является и стоимость сорбента, особенно если он используется для очистки больших объёмов загрязнённых вод.
Классифицировать сорбенты можно по следующим признакам: по происхождению – на природные и синтетические; по составу – на неорганические и органические; по знаку зарядов обменивающихся ионов – на катиониты, аниониты и амфолиты (последние в зависимости от условий могут обмениваться как катионами, так и анионами). На рис. 38 приведена классификация собционных материалов.
Природным сорбционным материалам – почве и минералам – в пособии уже было уделено достаточно много места (см. лекцию 12). Существует большая группа сорбентов, являющихся продуктами переработки природных органических веществ: древесина и ее составные части (лигнин, целлюлоза), разнообразные, искусственным путем приготовленные активированные угли. Все эти вещества являются полифункциональными сорбентами, ионообменные свойства которых сильно зависят от рН раствора и обусловлены присутствием в их структуре карбоксильных и фенольных групп.
Преимуществом данной группы сорбентов является невысокая стоимость, поэтому они нашли широкое применение. Недостатками большинства природных органических веществ являются высокая степень набухания, легкая пептизуемость, низкая химическая стойкость. Различные способы обработки природных органических материалов несколько повышают их стоимость, но улучшают свойства этих веществ как сорбентов
Кафедра радиохимии и |
148 |
|
прикладной экологии© |
||
|

СОРБЕНТЫ
ПРИРОДНЫЕ |
|
ИСКУССТВЕННЫЕ |
|
|
|
Неорганические |
|
|
|
Органические |
||
(алюмосиликаты, |
|
|
|
(ионообменные |
||
|
слюды) |
|
|
|
смолы) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Органические и продукты |
|
Неорганические (оксиды, |
|
||
|
их переработки (почва, |
|
сульфиды, ферроцианиды, |
|
||
|
древесина, лигнин, активи- |
|
синтетические |
|
||
|
рованные угли, целлюлоза, |
|
алюмосиликаты) |
|
||
|
ацетилцеллюлоза) |
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 38. Классификация сорбционных материалов
. Активированные угли (пористые углеродные сорбенты) получают из различного сырья – каменного угля, торфа, дерева, костей животных и т.д. При нагревании без доступа воздуха из этих материалов сначала удаляют летучие вещества, в результате чего образуется крупнопористая структура. Затем уголь активируют путем окисления кислородом, углекислым газом или водяным паром при температуре Т=800– 900°С:
С + О2 → СО2
2→ 2СО
С+ Н2О → СО + Н2
С+ СО2 →2СО
Впроцессе активации образуются микропоры. Таким образом, в результате обработки твёрдых веществ получают пористые тела губчатой структуры. Природа материала и методы синтеза в значительной степени определяют размеры пор пористых тел. При активации угля на его поверхности образуются прочно связанные с сорбентом окисные соединения, которые при контакте с водой образуют либо карбоксильные, либо гидроксильные группы. Эти группы и обуславливают катионообменные или анионообменные свойства углей.
Повышенной стойкостью к щелочам обладают катиониты на основе углеродсодержащих веществ (угли, дерево, торф), обработанные концентрированными растворами серной, фосфорной и других кислот.
Кафедра радиохимии и |
149 |
|
прикладной экологии© |
||
|
Например, с помощью сульфирования вводят сульфогруппы. Сульфирование изменяет ионообменную емкость материалов, химическую и механическую стойкость.
Относительно дешевыми сорбентами являются древесина, а также компоненты растительной ткани: целлюлоза, лигнин и их производные.
Опилки обладают хорошо развитой поверхностью, поэтому они могут задерживать не только ионные и коллоидные формы, но и радиоактивные изотопы, сорбированные на тонких взвесях. Преимуществом их использования для очистки радиоактивных отходов является возможность последующего сжигания, в результате которой во много раз уменьшается объем радиоактивных отходов. Масса опилок при сжигании уменьшается более чем в 40 раз. На поверхности золы изотопы прочно фиксируются, что очень важно при захоронении отходов. Недостатком процесса сжигания является способность радиоизотопов улетучиваться в результате образования аэрозолей. Устранение этих явлений требует специальной сложной аппаратуры. Ионообменная емкость целлюлозы обычно невелика, поэтому применяют ее для растворов с низкой концентрацией макрокомпонентов. Для улучшения обменных свойств целлюлозы ее окисляют химическим путем или в нее вводят различные функциональные группы. Сорбенты на основе целлюлозы могут использоваться не только в виде волокнистых гранулированных материалов, но и в форме ткани (ацетилцеллюлоза). Использование ткани позволяет проводить ионный обмен с более высокой скоростью, чем на гранулированных материалах.
Синтетические сорбенты также можно разделить на органические и неорганические. Широкое распространение получили синтетические иониты на основе органических смол – ионообменные смолы. Они обладают хорошей способностью поглощать ионы и высокой химической стойкостью. Впервые ионообменные смолы были синтезированы в 1934 г. Адамсом и Холмсом [34]. Каркас ионообменных смол состоит из трехмерной сетки углеводородных цепей полимерного вещества, на которой закреплены функциональные группы. По фазовому состоянию ионообменные смолы – нерастворимые гели, обладающие ограниченной способностью к набуханию. В отличие от пористых сорбентов (уголь, силикагель) частица ионообменной смолы не обладает жесткими порами. Вода проникает в зерно смолы и раздвигает молекулы полимера, вызывая набухание сорбента. Синтез ионообменных смол производят двумя методами: полимеризации и поликонденсации. В обоих методах процесс состоит из 3 стадий:
получение полимеров;
формирование сетчатой структуры (матрицы) с помощью мостикообразователей;
введение в макромолекулы активных (ионогенных) групп. Активные группы могут находиться в исходном мономере, или их вводят в
него перед построением матрицы. В ионитах активными группами могут
Кафедра радиохимии и |
150 |
|
прикладной экологии© |
||
|

быть гидроксильные – ОН, сульфогруппы – SO3H, карбоксильные, фосфорнокислые и другие.
Ионообменные смолы могут проявлять свойства катионитов (обменивающие катионы), анионитов (обменивающие анионы) и амфолитов (содержащие группы, которые могут диссоциировать и по кислотному и по основному типу в зависимости от pH).
От степени диссоциации ионогенных групп зависит, насколько сильно выражены основные или кислотные свойства ионита. Поэтому иониты классифицируют на сильнокислотные, среднекислотные или слабокислотные, сильноосновные, слабоосновные (табл. 23 ).
|
|
|
|
Таблица 23 |
|
|
Классификация ионообменников [35] |
||
|
|
|
|
|
Иониты |
|
Тип |
Ионогенные группы |
|
Катиониты |
сильнокислотные |
сульфононовые |
–SO3H |
|
|
среднекислотные |
фосфоновые |
–PO(OH)2 |
|
|
слабокислотные |
карбоксильные |
–СOOH |
|
Аниониты |
сильноосновные |
четвертичные |
–N(СH3)3OH |
|
|
|
|
аммониевые |
|
|
|
|
основания |
|
|
среднеосновные |
третичные |
–N(СH3)2C2H5OHOH |
|
|
|
|
аммониевые |
|
|
|
|
основания |
|
|
слабоосновные |
амины |
–NH2, –NRH |
|
Кислотные ионогенные группы в Н-форме диссоциируют следующим |
||||
образом: |
–SO3- + H+ |
|
|
|
–SO3H |
|
|
||
–СOOH –СOO- +H+ |
|
|
||
Основные ионогенные группы в ОН-форме при диссоциации выделяют |
||||
ионы ОН-: |
|
–N(СH3)3+ + OH- |
|
|
–N(СH3)3OH |
|
|||
–NH2 + HOH |
–NH3+ + OH- |
|
||
Широкое распространение среди сильнокислотных катионитов получили сульфокатиониты на основе сополимера стирола с дивинилбезолом (ДВБ) – КУ-1; КУ-2; Дауэкс-50 и др.
Сульфогруппа легче всего вводится в ароматические углеводороды и их производные, поэтому для синтеза сульфокатионитов используют доступное ароматическое сырьё: фенол, стирол и т.п. [36].
Например, катионит КУ-1 получают поликондесацией фенола с формальдегидом с образованием трёхмерного пространственного полимера и
Кафедра радиохимии и |
151 |
|
прикладной экологии© |
||
|

последующим введением сульфогруппы путём обработки смолы концентрированной серной кислотой
фенол |
формаль- |
катионит КУ-1 |
дегид |
|
В этом катионите две функциональные группы: гидроксильная и сульфогруппа.
Катионит КУ-2 имеет одну функциональную группу –SO3H и для его получения используется процесс полимеризации. Сначала при сополимеризации образуется пространственный сополимер, при этом дивинилбензол выступает мостикообразователем. От его количества зависит степень набухаемости ионита. Обычно содержание сшивающего агента ДВБ составляет 8–10 %. Сополимер получают в виде твёрдых шариков определённого размера, которые в последующем обрабатывают серной кислотой, прививая ионогенные группы. Таким образом, ионогенные группы вводят в готовый сополимер, так как сульфирование мономерного стирола вызывает определённые трудности. Брутто-реакцию получения ионита можно представить следующим образом:
стирол |
дивинилбензол |
катионит КУ-2 |
Сильноосновные аниониты, содержащие четвертичные аммониевые группы, можно получить как путём конденсации аминов, например с формальдегидом и последующим алкелированием аминов, так и путём полимеризации ненасыщенных соединений, содержащих аммониевые группы. Аниониты, обладающие хорошими сорбционными свойствами, достаточно высокой химической и механической прочностью, получают в основном методом сополимеризации.
Основой полимеризационных анионитов является сшитый полистирол, в который вводят функциональные группы, способные к обмену анионов. Одним из приёмов введения функциональной группы являются хлорметилирование с помощью хлорметилметилового эфира и последующая обработка аммиаком или аминами.
Кафедра радиохимии и |
152 |
|
прикладной экологии© |
||
|

При взаимодействии хлорметилированного сополимера стирола и дивинилбензола с триметиламином получают сильноосновный анионит АВ-17:
|
ClCH2OCH 3 |
N(CH3)3 |
|
|
|
|
|
| |
|
|
CH2Cl |
стирол дивинилбензол |
хлорметилированный сополимер стирола |
|
|
|
и дивинилбензола |
N(CH3 )3
|
CH2
|
Cl- +N(CH3)3
анионит АВ-17
Емкость ионообменных смол выше, чем у природных ионитов примерно в 10 раз. К недостаткам ионообменных смол следует отнести следующие:
смолы не обладают высокой избирательностью. Если смола – катионит, то она будет извлекать любые катионы раствора. Когда в растворе много солей, емкость смолы быстро исчерпывается, поэтому вводится ограничение на использование смол по солесодержанию в растворе, оно должно составлять не более 2 г/л;
свойства смол ухудшают органические вещества, они не поглощаются смолами и могут соединяться с радионуклидами;
смолы не поглощают тонкие радиоактивные взвеси и имеют низкие емкости по коллоидам;
имеют низкую радиационную устойчивость;
дороги, поэтому необходима их регенерация, а процесс регенерации сложен и приводит к образованию вторичных отходов.
По сравнению с ионообменными смолами синтетические
неорганические сорбенты обладают высокой радиационной, химической и термической устойчивостью, являются полифункциональными сорбентами и могут поглощать радионуклиды как за счет ионного обмена, так и за счет других процессов, обладают высокой сорбционной емкостью, высокой специфичностью и повышенной избирательностью к отдельным
Кафедра радиохимии и |
153 |
|
прикладной экологии© |
||
|

радионуклидам. К синтетическим неорганическим сорбентам относятся: оксиды, соли, сульфиды многовалентных металлов, синтетические алюмосиликаты. Давно известна и широко используется сорбционная способность таких оксидов, как Al2O3, Fe2O3, MnO2, SiO2, гидратированных оксидов циркония, цинка, олова, титана, применяют сорбенты на основе солей Zr,Ti и других многовалентных металлов [24].
Повышенной избирательностью к отдельным элементам, значительной ёмкостью и радиационной стойкостью обладают сорбенты на основе циркония и титана. Установлено, что основой структуры гидроокиси циркония является тетрамер. Cвежеосажденный гидроксид циркония можно представить в виде Zr4(OH)16 или Zr(OH)4. Старение этого соединения приводит к образованию гидратированного оксида циркония.
Гидратированные оксиды титана и циркония являются неорганическими полимерными соединениями, в которых атомы металла связаны между собой в полимерные цепи оловыми (-ОН) или оксо-связями (-О-), кроме этого они имеют в своем составе адсорбированную и химически связанную воду, поэтому эти материалы являются классическими примерами амфолитов
Среди сорбентов на циркониевой основе распространение получил фосфат циркония. Рассмотрим взаимодействие одного фрагмента гидроксида циркония с фосфорной кислотой
ОН |
|
|
|
OH |
OH |
|
|
OH |
│ |
|
|
|
│ |
|
|
||
HO – Zr – ОН + |
ОН – Р |
|
HO – Zr – О – Р |
|||||
│ |
|
|
|
ОН |
│ |
|
|
OH |
|
|
|
|
|
||||
ОН |
О |
|
OH |
O |
||||
В результате взаимодействия формируется формируется связь – Zr – O – P – Твердая фаза претерпевает превращения вплоть до Zr3(PO4)4. Фосфат циркония эффективно извлекает из воды ионы Sr2+ и Cs+.
Распространение получили сорбенты на основе ферроцианидов тяжелых металлов. Эти сорбенты являются труднорастворимыми соединениями типа МI4-2хМIIх[Fe(CN)6], где М – ион щелочного металла, МII – ион двухзарядного металла (Zn, Cu, Ni, Co, Fe). Например, K2Ni[Fe(CN)6] –
смешанный ферроцианид никеля – калия.
Ферроцианиды селективно извлекают щелочные металлы из растворов. Ряд сродства для щелочных металлов имеет вид:
Li+ < Na+ < K+ < NH4 + < Rb+ < Cs+
Коэффициент распределения KdCs-137 на сорбенте КУ-2 равен 103 мг/л, тогда как на смешанном ферроцианиде K2Ni[Fe(CN)6] –106 мг/л.
Ион Сs+ легко вытесняет часть тяжелого металла М(II), а также К+ из смешанных солей:
K2Ni[Fe(CN)6] + 2Сs+ → Cs2Ni[Fe(CN)6] + 2К+
Кафедра радиохимии и |
154 |
|
прикладной экологии© |
||
|

Вытеснение ионом Cs+ ионов тяжелого металла можно объяснить тем, что существует неравноценная связь между атомами тяжелого металла М(II) и группой [Fe(CN)6]4-. Часть ионов М(II) удерживается слабее и может быть вытеснена действием раствора щелочных металлов. Фрагмент кристаллической решетки ферроцианида с вакансией в позиции иона
Fe(CN)64- приведённа рис. 39 [37].
Рис. 39. Фрагмент кристаллической решетки ферроцианида с вакансией в позиции иона Fe(CN)64- [37]
Рассмотрение сорбционных процессов можно провести на основе модели структуры ферроцианида с учетом вакансий в позиции ионов Fe(CN)64-. Согласно этой модели, у ферроцианидов, состав которых выражается общей формулой МI4-2хМIIхFeII(CN)6, ионы Fe(CN)64- и часть ионов переходного металла МII(1) находятся в узлах гранецентрированной решетки (позиции типа a и b соответственно). Другая часть ионов переходного металла МII(2) и ионы щелочного металла МI размещаются в центрах ячеек решеток.
При ионном обмене на смешанных ферроцианидах переходных и щелочных металлов в обмене участвуют ионы МI и МII(2), т.е. те из них, которые находятся в позициях типа с. С возрастанием радиуса иона щелочного металла его сродство к ферроцианидным сорбентам растет. Причиной этого сродства является усиление поляризационного взаимодействия обменных ионов с CN-группами ферроцианидов.
Последняя группа сорбентов, которые будут рассмотрены в данном пособии, – сорбенты на основе солей гетерополикислот. Например, фосфоромолибдат аммония (NH4)3PМо12O40·nH2O, фосфоровольфрамат (NH4)3PW12O40·nH2O. Они являются катионитами, более селективными к щелочным элементам, чем ионообменные смолы (табл. 24).
Катион гетерополисоединения (ГПС) NH4 + или К+ обменивается с
более тяжелым катионом (Cs+ или Rb+), причем последний образует еще менее растворимое ГПС, чем первый. Обмен происходит вследствие
Кафедра радиохимии и |
155 |
|
прикладной экологии© |
||
|
различной растворимости фосфоровольфраматов щелочных элементов и
аммония, которая уменьшается в ряду К+ NH4 |
+ Rb+ Cs+. |
Таблица 24 Коэффициенты распределения щелочных металлов из 0,1 М раствора
NH4NO3 [24]
Сорбент |
Cs |
Rb |
K |
Na |
|
|
|
|
|
Дауэкс-50 |
62 |
52 |
46 |
26 |
Фосфоромолибдат |
6000 |
230 |
34 |
0 |
аммония |
|
|
|
|
Фосфоровольфрамат |
3950 |
134 |
- |
- |
аммония |
|
|
|
|
ЛЕКЦИЯ 18 СПОСОБЫ ПОЛУЧЕНИЯ НЕОРГАНИЧЕСКИХ СОРБЕНТОВ
Способы получения высокоспецифичных сорбентов. Факторы повышения сорбционного сродства неорганических сорбентов.
Свойства неорганических сорбентов определяются их составомструктурой, степенью оформленности кристаллической решетки. Эксплутационные характеристики сорбентов зависят во многом от их формы: гранулы, сферические частицы, мембраны, волокна, пористые блоки и т.д. Можно использовать ионообменный материал в виде осадка, производя осаждение из раствора. В этом случае радионуклид попадает в осадок за счёт явления соосаждения. При смешивании исходных растворов обычно получаются мелкокристаллические осадки, которые далее необходимо отделить от маточного раствора. Возможности технологического применения такого способа ограничивают довольно продолжительное время осадкообразования и трудоёмкость процедуры его дальнейшей переработки. Большие объёмы осадка и его мелкокристаллическая структура затрудняют процесс фильтрации. Поэтому удобнее процесс извлечения радионуклидов проводить в сорбционном варианте, не путем соосаждения, а сорбцией заранее подготовленной твердой фазой (она и есть сорбент) в статическом или динамическом режиме.
К основным технологиям получения неорганических сорбентов можно отнести следующие:
осаждение сорбционных материалов из растворов с последующим формованием;
получение сорбентов методом падающей капли, включая золь-гель;
модифицирование существующих материалов;
Кафедра радиохимии и |
156 |
|
прикладной экологии© |
||
|
нанесение сорбционных материалов в виде пленок на поверхность материалов-носителей.
Все эти методы получили широкое применение, как в лабораторных экспериментах, так и в промышленных технологиях.
Для ускорения сорбционных процессов и улучшения механических свойств сорбентов проводят их гранулирование из порошкообразных осадков путем применения связующих веществ. Этот метод является в настоящее одним из основных способов получения неорганических сорбентов и включает в себя следующие операции: смешение реагентов, выделение осадка малорастворимого вещества, отделение его от маточного раствора, отмывка, сгущение, формование. По способам выполнения и аппаратурному оформлению существенно различается стадия формования сорбционных материалов. Выделяют следующие способы формования:
высушивание на поверхности, имеющей углубления заданных форм и размеров;
высушивание с последующим измельчением материала, размалыванием или растрескиванием при замачивании в воде или водных растворов солей;
распыление с последующей сушкой;
замораживание с последующим размораживанием;
прессование, в том числе таблетированием;
гранулирование окатыванием;
гранулирование пресс-формованием (экструзионные и формующие грануляторы);
формование с твердеющими связующими веществами.
Осадки имеют рыхлую максимально развитую поверхность, за счет нее эффективно извлекаются радионуклиды. Обработка веществ высушиванием, введение в них цементирующих добавок и различных наполнителей, позволяют увеличить скорости фильтрации, но при этом ухудшаются сорбционные свойства ионитов из-за уменьшения удельной обменной емкости. Приготовление гранулированных неорганических сорбентов с высокой емкостью, воспроизводимыми сорбционными свойствами, хорошей кинетикой процесса сорбции возможно при использовании методов замораживания с последующим размораживанием. Гранулы сорбентов, полученных замораживанием, обладают несколько меньшей механической прочностью по сравнению с «высушенными», однако превосходят последние по величине сорбционной емкости. При сушке вследствие протекания процессов дегидратации происходят сужение пор, уменьшение удельной поверхности сорбентов и количества ОН-групп, способных к обмену.
Сорбенты в гранулированном виде могут быть получены формованием их тонкодисперсных частиц с помощью связующих. Измельчение ксерогелей до нескольких микрон и формование их со связующим позволяют образовывать водостойкие гранулированные материалы с двухпористой структурой. Первичные частицы связующего (чаще всего используются золи
Кафедра радиохимии и |
157 |
|
прикладной экологии© |
||
|
труднорастворимых гидроксидов), схватываясь в гель и цементируя частицы порошка, составляют систему транспортных пор с радиусами от нескольких десятков до тысяч Å, обеспечивая хорошие кинетические свойства сорбента. Пористая же структура основного материала остается практически неизменной и обеспечивает ему постоянство свойств. Для получения механически прочных гранул достаточно ввести золь в количестве, обеспечивающем содержание SiO2 в конечном продукте 9 – 15 мас. % .
Золь-гель метод применяется для синтеза сорбентов в нашей стране уже 50 лет и положен в основу получения различных видов неорганических сорбентов, в том числе силикагеля и алюмогеля. Полученные таким способом материалы имеют сферическую форму частиц, что обеспечивает наименьшую истираемость и наибольшие газо- и водопроницаемость, насыпной вес. Процесс получения включает основные стадии:
приготовление вещества сорбента в форме золя;
диспергирование золя с получением капель;
желатинизация капель при прохождении через слой жидкости (масло, органические растворители, растворы реагентов);
отмывка сферических частиц гидрогеля от растворимых солей;
сушка и прокаливание.
Получать золи и проводить их желатинизацию можно разными методами. Время гелирования, соотношения и концентрации реагентов меняются. Существуют типовые установки, пригодные для получения определенного ассортимента неорганических сорбентов. Научнопроизводственной фирмой «Термоксид» на резервных площадях Белоярской АЭС организован выпуск неорганических сорбентов на основе гидратированных оксидов титана, циркония и олова с использованием зольгель метода.
При получении неорганических сорбентов существенное влияние на их сорбционно-кинетические и эксплутационные характеристики оказывает каждый из этапов синтеза. Основное отличие неорганических сорбентов от органических состоит в замедленной диффузии сорбируемых ионов вглубь гранулы. Причина заключается в жесткости скелета неорганических веществ, в результате – отсутствие набухания, незначительный размер пор. Поэтому сорбционная способность неорганических сорбентов существенно зависит от степени развития поверхности. Мелкодисперсные материалы обладают развитой поверхностью, и весь объём сорбирующего материала доступен для сорбции. О недостатках использования осадков уже было сказано выше.
При гранулировании не всегда удается сформировать пористые гранулы с развитой поверхностью. Если неорганические осадки кристаллизуются легко, то происходит быстрая кристаллизация, которая сопровождается срастанием первичных кристаллитов друг с другом, вследствие чего их поверхность и сорбционная способность уменьшаются. Можно исключить из гранулы ионообменника ее внутреннюю, балластную при сорбции микрокомпонентов, часть, оставив лишь наружную
Кафедра радиохимии и |
158 |
|
прикладной экологии© |
||
|
