
химия
.docБиологически значимые элементы
[править]
Материал из Википедии — свободной энциклопедии
Биологически значимые элементы (в противоположность биологически инертным элементам) — химические элементы, необходимые живым организмам для обеспечения нормальной жизнедеятельности. Биологически значимые элементы классифицируют на макроэлементы (содержание которых в живых организмах составляет больше 0,01 %) имикроэлементы (содержание менее 0,001 %).
|
Содержание [убрать]
|
[править]Использование термина «минерал» по отношению к биологически значимым элементам
Микро- и макроэлементы (кроме кислорода, водорода и азота), попадают в организм, как правило, при приёме пищи. Для их обозначения в английском языке существует терминDietary mineral.
В конце XX века российские производители некоторых лекарственных препаратов и биологически активных добавок стали использовать для обозначения макро- и микроэлементов термин минерал. С научной точки зрения такое употребление термина «минерал» является неправильным, так как оно используется только для обозначения геологического природного тела с кристаллической структурой. Тем не менее, производители т. н. «биологических добавок» (возможно, в рекламных целях) стали называть свою продукцию витамино-минеральными комплексами.
[править]Макроэлементы
Эти элементы слагают плоть живых организмов. К макроэлементам относят те элементы, рекомендуемая суточная доза потребления которых составляет более 200 мг. Макроэлементы, как правило, поступают в организм человека вместе с пищей.
[править]Биогенные элементы
-
Кислород — 65%
-
Углерод — 18%
-
Водород — 10%
-
Азот — 3%
Эти макроэлементы называют биогенными (органогенными) элементами или макронутриентами (англ. macronutrient). Из макронутриентов преимущественно построены такиеорганические вещества, как белки, жиры, углеводы и нуклеиновые кислоты. Для обозначения макронутриентов иногда используют акроним CHNO, состоящий из обозначений соответствующих химических элементов в таблице Менделеева.
[править]Другие макроэлементы
Рекомендуемая суточная доза > 200 мг:
-
Калий
-
Кальций
-
Магний
-
Натрий
-
Сера
-
Фосфор
-
Хлор
[править]Микроэлементы
Термин «микроэлементы» получил особое распространение в медицинской, биологической и сельскохозяйственной научной литературе в середине XX века. В частности, для агрономов стало очевидным, что даже достаточное количество «макроэлементов» в удобрениях (троица NPK — азот, фосфор, калий) не обеспечивает нормального развития растений.
Микроэлементами называются элементы, содержание которых в организме мало, но они участвуют в биохимических процессах и необходимы живым организмам. Рекомендуемая суточная доза потребления микроэлементов для человека составляет менее 200 мг. В последнее время стал использоваться заимствованный из европейских языков терминмикронутриент (англ. micronutrient).
Поддержание постоянства внутренней среды (гомеостаза) организма предусматривает в первую очередь поддержание качественного и количественного содержания минеральных веществ в тканях органов на физиологическом уровне.
[править]Основные микроэлементы
По современным данным более 30 микроэлементов считаются необходимыми для жизнедеятельности растений, животных и человека. Среди них (в алфавитном порядке):
-
Бром
-
Железо
-
Йод
-
Кобальт
-
Марганец
-
Медь
-
Молибден
-
Селен
-
Фтор
-
Хром
-
Цинк
Чем меньше концентрация соединений в организме, тем труднее установить биологическую роль элемента, идентифицировать соединения, в образовании которых он принимает участие. К числу несомненно важных относят ванадий, кремний и др.
[править]Совместимость
Основная статья: Совместимость микронутриентов
В процессе усвоения организмом витаминов, микроэлементов и макроэлементов возможен антагонизм (отрицательное взаимодействие) или синергизм (положительное взаимодействие) между разными компонентами.
[править]Недостаток микроэлементов в организме
Основные причины, вызывающие недостаток минеральных веществ:
-
Неправильное или однообразное питание, некачественная питьевая вода.
-
Геологические особенности различных регионов земли — эндемические (неблагоприятные) районы.
-
Большая потеря минеральных веществ по причине кровотечений, болезнь Крона, язвенный колит.
-
Употребление некоторых лекарственных средств, связывающих или вызывающих потерю микроэлементов.
[править]См. также
-
Химический состав клетки
-
Суточная потребность человека в биологически активных веществах
[править]Литература
-
Ultratrace minerals. Authors: Nielsen, Forrest H. USDA, ARS Source: Modern nutrition in health and disease / editors, Maurice E. Shils ... et al.. Baltimore: Williams & Wilkins, c 1999., p. 283–303. Issue Date: 1999 URI: [1]
Кислород
[править]
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Кислород (значения).
|
8
|
|||||
|
Внешний вид простого вещества |
|||||
|
|
|||||
|
Свойства атома |
|||||
|
Имя, символ, номер |
Кислоро́д / Oxygenium (Oxygen)(O), 8 |
||||
|
Атомная масса (молярная масса) |
15,9994 а. е. м. (г/моль) |
||||
|
Электронная конфигурация |
[He] 2s2 2p4 |
||||
|
Радиус атома |
60 (48) пм |
||||
|
Химические свойства |
|||||
|
Ковалентный радиус |
73 пм |
||||
|
Радиус иона |
132 (-2e) пм |
||||
|
Электроотрицательность |
3,44 (шкала Полинга) |
||||
|
Электродный потенциал |
0 |
||||
|
Степени окисления |
-2, −1, -½, -⅓, 0, ½, +1, +2 |
||||
|
Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) |
||||
|
Термодинамические свойства простого вещества |
|||||
|
Плотность (при н. у.) |
0,00142897 г/см³ |
||||
|
Температура плавления |
54,8 К (-218,35 °C) |
||||
|
Температура кипения |
90,19 К (-182,96 °C) |
||||
|
Теплота плавления |
0,444 кДж/моль |
||||
|
Теплота испарения |
3,4099 кДж/моль кДж/моль |
||||
|
Молярная теплоёмкость |
29,4[1] Дж/(K·моль) |
||||
|
Молярный объём |
14,0 см³/моль |
||||
|
Кристаллическая решётка простого вещества |
|||||
|
Структура решётки |
моноклинная |
||||
|
Параметры решётки |
a=5,403 b=3,429 c=5,086 β=135,53Å |
||||
|
Температура Дебая |
155 K |
||||
|
Прочие характеристики |
|||||
|
Теплопроводность |
(300 K) 0,027 Вт/(м·К) |
||||
|
8 |
Кислород |
|
O 15,999 |
|
|
2s22p4 |
|
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периодапериодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O(лат. Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекулакоторого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород[2]. Жидкий кислородимеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
|
Содержание [убрать]
|
[править]История открытия
Официально считается[3][4], что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
![]()
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
[править]Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькойтермина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
[править]Нахождение в природе
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
[править]Получение
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
![]()
Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):
![]()
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
![]()
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при t = 100 °C):
![]()
На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
![]()
[править]Физические свойства
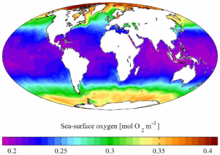
![]()
В мировом океане содержание растворенного O2 больше в холодной воде, а меньше - в тёплой.
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте(2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
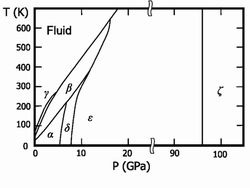
![]()
Фазовая диаграмма O2
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы. Известны шестькристаллических фаз, из которых три существуют при давлении в 1 атм.:
-
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся кмоноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[5].
-
β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[5].
-
γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решёткиa=6,83 Å[5].
Ещё три фазы образуются при высоких давлениях:
-
δ-О2 интервал температур 20-240 К и давление 6-8 ГПа, оранжевые кристаллы;
-
ε-О4 давление от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
-
ζ-Оn давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит всверхпроводящее состояние.
[править]Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
![]()
![]()
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
![]()
Окисляет большинство органических соединений:
![]()
При определённых условиях можно провести мягкое окисление органического соединения:
![]()
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
-
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
![]()
-
Некоторые оксиды поглощают кислород:
![]()
-
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
![]()
-
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
![]()
-
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
![]()
-
Озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
![]()
-
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
![]()
[править]Фториды кислорода
-
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
![]()
-
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
![]()
-
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
-
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.)[6] OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон).
[править]Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
[править]В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
[править]Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.

 Газ
без цвета, вкуса и запаха;
голубоватая
жидкость
(при низких температурах)
Газ
без цвета, вкуса и запаха;
голубоватая
жидкость
(при низких температурах)