
химия
.docМедноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
[править]Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
[править]Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
[править]Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
[править]Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[9].
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 511 и 578 нм.
[править]Стоимость
На 2011 год стоимость меди составляет около $8900 за тонну[10].
[править]Биологическая роль

![]()
Продукты, богатые медью.
![]()
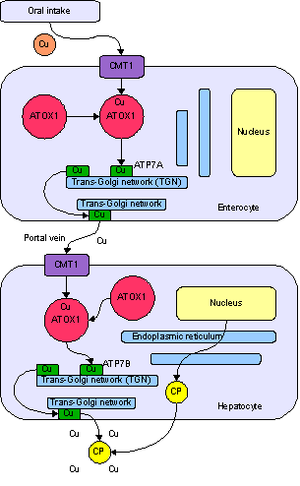
Метаболизм меди у человека. Поступление вэнтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азыATP7A в воротную вену. Поступление в гепатоцит, гдеATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белкомцерулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белкагемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[11].
[править]Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[12].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[12]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
[править]Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[13] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штаммастафилококка золотистого, известного как «супермикроб» MRSA[14]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)[15].
[править]Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
[править]Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[16][17]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т подтверждённые запасы[16], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[16]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн[18]. Основными производителями меди в России являлись:
|
Компания |
тыс. тонн |
% |
|
Норильский никель |
425 |
45 % |
|
Уралэлектромедь |
351 |
37 % |
|
Русская медная компания |
166 |
18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[19]. Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
-
 Чили (5,560 млн
т в 2007 г. и 5,600 млн т в 2008 г.),
Чили (5,560 млн
т в 2007 г. и 5,600 млн т в 2008 г.), -
 США (1,170/1,310),
США (1,170/1,310), -
 Перу (1,190/1,220),
Перу (1,190/1,220), -
 КНР (0,946/1,000),
КНР (0,946/1,000), -
 Австралия (0,870/0,850),
Австралия (0,870/0,850), -
 Россия (0,740/0,750),
Россия (0,740/0,750), -
 Индонезия (0,797/0,650),
Индонезия (0,797/0,650), -
 Канада (0,589/0,590),
Канада (0,589/0,590), -
 Замбия (0,520/0,560),
Замбия (0,520/0,560), -
 Казахстан (0,407/0,460),
Казахстан (0,407/0,460), -
 Польша (0,452/0,430),
Польша (0,452/0,430), -
 Мексика (0,347/0,270).
Мексика (0,347/0,270).
Смотрим также более полный список стран по производству меди.
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
[править]Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
![]()
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
[править]Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
[править]Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
[править]Интересные факты
-
Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[22].
-
В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
-
Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).
-
В организме взрослого человека содержится до 80 мг меди.
-
Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[23].
Молибден
[править]
Материал из Википедии — свободной энциклопедии
|
42
|
|||||
|
Внешний вид простого вещества |
|||||
|
|
|||||
|
Свойства атома |
|||||
|
Имя, символ, номер |
Молибде́н / Molybdaenum (Mo), 42 |
||||
|
Атомная масса (молярная масса) |
95,94 а. е. м. (г/моль) |
||||
|
Электронная конфигурация |
[Kr] 4d5 5s1 |
||||
|
Радиус атома |
139 пм |
||||
|
Химические свойства |
|||||
|
Ковалентный радиус |
130 пм |
||||
|
Радиус иона |
(+6e) 62 (+4e) 70 пм |
||||
|
Электроотрицательность |
2,16 (шкала Полинга) |
||||
|
Электродный потенциал |
-0,2 |
||||
|
Степени окисления |
6, 5, 4, 3, 2 |
||||
|
Энергия ионизации (первый электрон) |
684,8 (7,10) кДж/моль (эВ) |
||||
|
Термодинамические свойства простого вещества |
|||||
|
Плотность (при н. у.) |
10,22 г/см³ |
||||
|
Температура плавления |
2890 K |
||||
|
Температура кипения |
4885 K |
||||
|
Теплота плавления |
28 кДж/моль |
||||
|
Теплота испарения |
~590 кДж/моль |
||||
|
Молярная теплоёмкость |
23,93[1] Дж/(K·моль) |
||||
|
Молярный объём |
9,4 см³/моль |
||||
|
Кристаллическая решётка простого вещества |
|||||
|
Структура решётки |
кубическая объёмноцентрированая |
||||
|
Параметры решётки |
3,147 Å |
||||
|
Температура Дебая |
450 K |
||||
|
Прочие характеристики |
|||||
|
Теплопроводность |
(300 K) 138 Вт/(м·К) |
||||
|
42 |
Молибден |
|
Mo 95,94 |
|
|
4d55s1 |
|
Молибде́н — элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементовД. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum). Простое вещество молибден (CAS-номер: 7439-98-7) — переходный металл светло-серого цвета. Главное применение находит в металлургии.
|
Содержание [убрать]
|
[править]История и происхождение названия
Открыт в 1778 году шведским химиком Карлом Шееле, который, прокаливая молибденовую кислоту, получил МоО3. Вметаллическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида углём: он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус.
Название происходит от др.-греч. μόλυβδος, означающего «свинец». Оно дано из-за внешнего сходства молибденита (MoS2),минерала из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS). Вплоть до XVIII в.молибденит не отличали от графита и свинцового блеска, эти минералы носили общее название «молибден».
[править]Нахождение в природе
Содержание в земной коре 3·10−4% по массе. В свободном виде молибден не встречается. В земной коре молибден распространён относительно равномерно. Меньше всего содержат молибдена ультраосновные и карбонатные породы (0,4 — 0,5 г/т). Концентрация молибдена в породах повышается по мере увеличения SiO2. Молибден находится также в морской и речной воде, в золе растений, в углях и нефти. Содержание молибдена в морской воде колеблется от 8,9 до 12,2 мкг/л[2] для разных океанов и акваторий. Общим является то, что воды вблизи берега и верхние слои меньше обогащены молибденом, чем воды на глубине и вдали от берега. Наиболее высокие концентрации молибдена в породах связаны с акцессорными минералами (магнетит, ильменит, сфен), однако основная масса его заключена в полевых шпатах и меньше в кварце. Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах). Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит. Для кристаллизации молибденита наиболее благоприятны восстановительная среда и повышенная кислотность. В поверхностных условиях образуются преимущественно кислородные соединения Мо6+. В первичных рудах молибденит встречается в ассоциации с вольфрамитом и висмутином, с минералами меди (медно-порфировые руды), а также с галенитом, сфалеритом и урановой смолкой (в низкотемпературных гидротермальных месторождениях). Хотя молибденит считается устойчивым сульфидом по отношению к кислым и щелочным растворителям, в природных условиях при длительном воздействии воды и кислорода воздуха молибденит окисляется и молибден может интенсивно мигрировать с образованием вторичных минералов. Этим можно объяснить повышенные концентрации молибдена в осадочных отложениях — углистых и кремнисто-углистых сланцах и углях.
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит СаМоО4 (48 % Мо), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
[править]Месторождения
Крупные месторождения молибдена известны в США, Мексике, Чили, Канаде, Австралии, Норвегии, России[3]. Более 7 % от мировых запасов молибдена расположены в Армении[4], причем 90% из них сосредоточены в Каджаранском медно-молибденовом месторождении.
[править]Генетические группы и промышленные типы месторождений
1. Контактово-метасоматические (скарновые)
2. Гидротермальные
А. Высокотемпературные (грейзеновые)
Б. Среднетемпературные
а. кварц-молибденитовые
б. кварц-сфалерит-галенит-молибденитовые

 Блестящий
металл серебристо-белого цвета
Блестящий
металл серебристо-белого цвета