
- •СИМВОЛИКА И ТЕРМИНОЛОГИЯ
- •Глава 1 ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 3 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Раздел II. СТРОЕНИЕ ВЕЩЕСТВА
- •Глава 4 СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 6 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 7. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 8 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 9 ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 10 ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ И СПОСОБЫ ВЫРАЖЕНИЯ ИХ КОНЦЕНТРАЦИИ
- •По теме «Общая характеристика растворов и способы выражения их концентрации» необходимо знать и уметь следующее.
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 11 РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 12 РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 13 РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •Глава 14 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •СПИСОК ЛИТЕРАТУРЫ

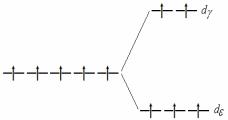
Окраска комплексных соединений хрома (+3) объясняется поглощением света при переходе электронов с dγ-орбиталей на свободные dε- орбитали.
Электронная формула атома кадмия в кратком виде [Kr]4d105s2, следовательно в катионе Cd2+ валентные электроны находятся в состоя-
нии 4d10. В окружении любых лигандов все d-орбитали этого комплексообразователя заселены электронами полностью, все электроны спарены, поэтому комплексные соединения кадмия (+2) диамагнитны; переход электронов с dγ- на dε-орбитали невозможен, поэтому комплексные соединения бесцветны.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Напишите названия соединений, определите заряды комплексов и комплексообразователей, напишите схемы диссоциации и выраже-
ние для константы нестойкости: K2[Sn(OH)4]; [Cr(H2O)5Cl](NO3)2; [CoF3(NH3)3]. H3[AuCl6]; Na[Co(NH3)2(NO2)4]; [PbI2(NH3)2], [Cr(NH3)6](NO3)3; Na2[Sn(ON)6]; [Ru(NO2)4(H2O)2], (NH4)2[RuCl6)]; [Fe(NH3)6](NO3)3; [PtCl4(H2O)2], K2[NiCl4]; [Ag(NH3)2]Cl; [Cu(SCN)2(NH3)2], K2[Ni(CN)4]; [Ti(H2O)6]Cl3; K3[CoF6]; [Co(SO4)(NH3)5]NO3; [PtBr2(NH3)2], Na[Ag(NO2)2]; [Cr(H2O)6]Cl3; K3[Al(OH)6], K4[Fe(CN)6]; [PtF2(NH3)4](NO3)2; [PhI3(NH3)3]; [NiCl(NH3)3]Cl; [Cr(SCN)3(NH3)3]; [Ag(NH3)2]Cl; K2[PtCl(OH)5]; [Pd(NO2)2(H2O)4]; [Pd(NH3)4]Cl2; K2[PtCl(OH)5]; (NH4)2[PtCl6]; [FeF2(NH3)4]2SO4; [PdCl2(H2O)4].
2.В растворе находится соединение состава PtCl4 4NH3. Для осаждения хлора (в виде AgCl) на 1 моль соединения израсходовано
2 моль AgNO3. Является ли данное соединение комплексным? Если да, то напишите его координационную формулу и название.
3.В результате обменной реакции между гексацианоферратом (II) калия и сульфатом меди (II) образуется малорастворимое комплекс-
79
ное соединение.Напишите молекулярное и ионное уравнения реакции.
4.Из сочетания частиц Fe3+, H2O, CN–, Na+ можно составить формулы семи комплексных соединений. Напишите их формулы и названия.
5.Имеются безводный бромид кобальта (II), вода и газообразный аммиак. Как из этих веществ получить бромид гексаамминкобальта (II)? Напишите уравнения реакций.
6.К раствору гексацианоферрата (II) калия добавили серную кислоту и раствор перманганата калия, который тут же обесцветился, – прошла окислительно-восстановительная реакция. Напишите её уравнение.
7.К раствору сульфата меди (II) добавляется небольшими порциями раствор аммиака. При этом вначале образуется зеленоватый осадок, который затем растворяется с переходом окраски в синий цвет – образуется комплексное соединение. Напишите уравнения реакций.
8.Один моль PtCl4·4NH3 взаимодействует в растворе с двумя моль AgNO3, а один моль PtCl4·3NH3 – с одним моль AgNO3 (с образованием нерастворимого хлорида серебра). Напишите формулы данных веществ в виде комплексных соединений и уравнения их реакций с AgNO3
9.При добавлении роданида калия к растворам сложных соединений
состава (NH4)2SO4 FeSO4 и 4KCN Fe(CN)2 в первом случае раствор становится кроваво-красным, а во втором – цвет не изменяется. Объясните это явление.
10.В каком направлении (прямом или обратном) протекает реакция: Mg(OH)2 + 4NH4OH(р) = [Mg(NH3)4](OH)2(р) + 4H2O?
11.Гидроксид цинка в воде практически не растворяется, но хорошо растворяется щелочами и гидроксидом аммония с образованием комплексных соединений. Напишите уравнения соответствующих реакций.
12.Какие условия определяют возможность для данного комплекса за-
мены лигандов другими? Возможна ли такая замена по уравнению
[Zn(CN)4]2– + 4OH– = [Zn(OH)4]2– + 4CN–?
13.Можно ли действием соответствующих лигандов получить комплекс [Ag(CN)2]– из [Ag(NH3)2]+? Если можно, то напишите уравнение реакции. Если нет, объясните причину.
14.Можно ли осадить ионы железа (3+) щелочью в виде Fe(OH)3 из раствора красной кровяной соли K3[Fe(CN)6]? Напишите уравнение реакции и определите направление её протекания.
15.Объясните, возможно ли протекание реакции 2[Cu(NH3)2]Cl(p) + K2S(p) = Cu2S + 2KCl(p) + 4NH3(p)?
80
16.Определите возможность протекания реакции в растворе: [Ag(NO2)]– + 2CN– = [Ag(CN)2]– + 2NO2–.
17.Определите направление протекания реакции: [Cd(CN)4]2– + Zn = [Zn(CN)4]2– + Cd.
18.Является ли обратимой реакция в растворе: K2[CdI4] + 4NH3 = [Cd(NH3)4]I2 + 2KI? Если да, то почему, если нет, то в каком направлении она протекает?
19.Допишите уравнение окислительно-восстановительной реакции с участием комплексного соединения: K4[Fe(CN)6] + Cl2 = ?
20.В ряду данных комплексов радиус лигандов и длина связи ком- плексообразователь–лиганд увеличиваются, а константа нестойко-
сти уменьшается: [HgCl4]2– (1 10–16), [HgBr4]2– (2 10–22), [HgI4]2–
(5 10–31). Объясните это явление.
21.Используя электростатическую теорию, объясните, какой комплекс
прочнее: [Co(NH3)6]2+ или [Co(CN)6]4–; [Zn(NH3)4]2+ или [Zn(OH)4]2–; [Hg(CN)4]2– или [Hg(SCN)4]2–; [BeCl4]2– или [BeF4]2–; [Al(OH)4]– или [Be(OH)4]2–; [Cu(CN)4]2– или [Cu(NH3)4]2+; TiF62– или ZrF62–.
22.На основе электростатической теории объясните, почему у двух
комплексных соединений с одним и тем же комплексообразовате-
лем – [Ag(CN)2]– и [Ag(SCN)2]– – константы нестойкости различаются во много раз (1,3 10–20 и 6,2 10–9).
23.Известно, что ион [Fe(CN)4]2– диамагнитен. На основе теории ВС объясните химическую связь и строение данного комплекса.
24.Ион [NiCl4]2– парамагнитен, так как имеет два неспаренных электрона, а ион [Ni(CN)4]2– – диамагнитен. Каков тип гибридизации комплексообразователя в каждом комплексе и каково их простран- ственно-геометрическое строение?
25.Кобальт (+2) в составе аквакомплекса (внешнеорбитального) стабилен и в растворах не окисляется кислородом. При добавлении раствора аммиака образуется аммиачный комплекс (с магнитным моментом, соответствующим одному неспаренному электрону), который легко окисляется кислородом. Объясните свойства этих комплексов, напишите уравнения реакций.
26.Комплекс [Mn(H2O)6]2+ обладает магнитным моментом, соответствующим одному неспаренному электрону. Используя метод ВС, объясните химическую связь в комплексе и его геометрическую форму.
27.Магнитный момент комплекса [Mn(NH3)6]3+ приблизительно в 2 раза меньше магнитного момента комплекса [MnF6]3–. Используя метод ВС, объясните образование химических связей в этих ком-
плексах.
81
28.Молекулы [Ni(CO)4] имеют тетраэдрическую форму. Используя метод ВС, опишите их электронное строение и магнитные свойства.
29.На основе теории валентных связей объясните образование, электронную структуру и строение комплекса [Ni(H2О)6]2+, парамагнетизм которого соответствует наличию двух неспаренных электронов.
30.Цианидный комплекс кобальта (III) диамагнитен, а аквакомплекс – парамагнитен. На основе метода ВС объясните, какой из них внешнеорбитальный, а какой – внутриорбитальный ? Укажите типы гибридизации орбиталей комплексообразователя в этих комплексах.
31.Изобразите диаграмму расщепления 3d-подуровня комплексообразователя в комплексе [Fe(CN)6]3–, укажите его магнитные свойства и окраску (окрашен или бесцветен).
32.Изобразите диаграмму расщепления 3d-подуровня комплексообразователя в комплексе [V(CN)6]3–, укажите его магнитные свойства и окраску (окрашен или бесцветен).
33.На основе теории кристаллического поля объясните, почему комплексные соединения хрома (+3) окрашены, а цинка (+2) – бесцветны.
34.На основе теории кристаллического поля объясните, почему комплекс [CoF6]3– высокоспиновый, а комплекс [Co(NH3)6]3+ – низкоспиновый.
35.На основе теории кристаллического поля объясните, почему соль K2[Zn(CN)4] бесцветна, а соль K3[Fe(CN)6] – окрашена.
36.На основе теории кристаллического поля определите, для какого случая (сильного или слабого поля лигандов) наблюдается данная схема распределения электронов по орбиталям комплексообразователя. Подберите к данной схеме пример.
82
