
- •Министерство здравоохранения и социального развития российской федерации
- •2006 Удк 616-092 (075)
- •Сведения об авторах
- •Предисловие
- •Первый период (от третьего тысячелетия до н.Э. До нового времени, до 1540 г.)
- •Второй период (новый период, 1540 - 1850 г.Г.)
- •Третий период (1863—1924 гг.)
- •Четвертый период (1924—1950 гг.)
- •Пятый период (с 1950 г. И по настоящее время)
- •Часть I
- •1.2. Основные общепатологические понятия
- •1.3. Объекты предмета патологии и их характеритика
- •Современное представление о болезни
- •1.4. Основные методы общей патологии
- •1.5. Классификация болезней
- •Принципы классификации болезней. Болезни обычно классифицируют, исходя из следующих принципов.
- •1.6. Периоды болезни
- •1.7. Варианты течения болезни
- •Глава 2. Общая этиология
- •2.1. История развития взглядов на этиологию
- •2.2. Современные взгляды на причину болезней
- •2.3. Характеристика причинного фактора и условий
- •2.4. Классификация этиологических факторов
- •Глава 3. Общий патогенез
- •3.1. Роль этиологического фактора в патогенезе заболевания
- •3.2. Роль причинно-следственных связей в патогенезе болезни
- •3.3. Патогенетические факторы
- •3.4. Основные пути и механизмы, реализующие
- •3.5.Значение местных и общих, функциональных и
- •Функциональное и морфологическое в развитии болезни
- •Специфическое и неспецифическое в развитии болезни
- •Приспособительное и патологическое в развитии болезни
- •Глава 4. Общий саногенез
- •4.1. Краткая характеристика механизмов выздоровления
- •4.2. Классификация и характеристика компенсаторно-приспособительных реакций и механизмов
- •Глава 5.Роль реактивности организма в развитии патологии
- •5.1. Классификация реактивности
- •5.2. Характеристика основных видов реактивности
- •5.2.1. Биологическая (видовая) реактивность
- •5.2.2. Групповая реактивность
- •5.2.3. Индивидуальная реактивность
- •5.3. Изменения реактивности в процессе онтогенеза
- •5.4. Характеристика физиологической и патологической реактивности
- •5.5. Характеристика специфической и неспецифической реактивности
- •5.6. Местные и общие проявления реактивности
- •5.7. Интенсивность и характер проявления реактивности
- •5.8. Факторы, определяющие реактивность
- •5.8.1. Роль внешних факторов
- •5.8.2. Роль наследственности
- •5.8.3. Роль конституции
- •5.8.4. Роль других факторов
- •5.9. Резистентность. Понятие.Формы. Взаимосвязь с реактивностью
- •Основные взаимоотношения между реактивностью (Рт) и резистентностью (Рз) организма.
- •5.10. Основные механизмы реактивности и резистентности организма
- •5.10.1. Нервные механизмы
- •5.10.2. Эндокринные механизмы
- •5.10.3. Иммунные механизмы
- •5.10.4. Роль макрофагально - моноцитарной системы
- •5.10.5. Роль изменения обмена веществ
- •Глава 6. Роль возраста в развитии патологии
- •6.1. Особенности патологии пренатального (внутриутробного) периода развития организма
- •6.2. Патология родового (интранатального) периода жизни организма
- •6.3. Особенности патология постнатального
- •6.4. Характеристика основных видов патологии в разные периоды детского возраста
- •6.4.1. Основные формы патологии грудного и раннего детского возраста
- •6.4.2. Основные формы патологии дошкольного и младшего школьного возраста
- •6.4.3. Основные формы патологии старшего школьного возраста
- •6.5. Роль пожилого и старческого возраста в развитии патологии и Особенностей их основных видов
- •6.5.1. Старение. Понятие. Виды. Характеристика.
- •Патология опорно-двигательного аппарата
- •Патология мочевыделительной системы
- •Расстройства зрения
- •Патология иммунной системы
- •Патология эндокринной системы
- •Патология нервной системы
- •Глава 7. Биоритмы и их роль в патологии
- •7.1. Ритмичность и периодичность
- •7.2. История развития биоритмических процессов и их роли в обеспечении жизнедеятельности организма в норме и патологии
- •Понятие о биоритмах и биоритмологии
- •7.4. Классификация биоритмов
- •7.5. Сруктура временной организации биосистемы
- •7.7. Характеристика некоторых биологических процессов в здоровом и больном организме
- •7.8. Десинхронозы и их характеристика
- •7.9. Значение фактора времени в медицине
- •Глава 8. Роль конституции организма в развитии патологии
- •8.1. Введение
- •8.2. Классификация конституциональных типов
- •8.3. Современные взгляды на роль конституции в развитии патологии
- •8.4. Диатезы
- •8.4.1. Краткая характеристика основных видов диатезов
- •Глава 9. Значение наследственности в патологии
- •9.2. Мутации
- •9.3. Наследственные генные болезни
- •9.3.1. Виды и пути передачи наследственной патологии
- •9.4. Хромосомные абберации
- •9.4.1. Гетероплодия по аутосомам
- •Яйцеклетка Нормальное расхождение Ненормальное расхождение Нормальная клетка Нормальная клетка Трисомия Моносомия
- •9.4.2. Гетероплоидия по половым хромосомам
- •9.5. Врожденные болезни (фенокопии)
- •9.6. Методы диагностики наследственных болезней
- •9.7. Принципы профилактики наследственных болезНей
- •9.8. Принципы лечения наследственных болезней
- •Глава 10. Болезнетворное влияние факторов внешней среды на организм человека
- •10.1. Введение
- •10.2. Краткая характеристика действия на организм
- •10.2.1. Повреждающее действие механической энергии
- •10.2.2. Действие термических факторов
- •10.2.2.1. Действие низких температур
- •10.2.2.2. Действие высоких температур
- •10.2.3. Влияние пониженного Барометрического давления
- •10.2.3.1. Горная и высотная болезни
- •10.2.3.2. Взрывная декомпрессия
- •10.2.4. Влияние повышенного барометрического давления
- •10.2.5. Повреждающее действие электрической энергии
- •10.2.6.1. Этиология ионизирующего излучения
- •10.2.6.2. Патогенез нарушений при действии ионизирующих излучений
- •10.2.6.3. Основные нарушения функций организма при общем облучении организма
- •10.2.7 Болезнетворное воздействие на организм химических факторов Введение
- •10.2.7.1. Основные биологические эффекты химических веществ
- •10.2.7.2. Повреждающее действие химических факторов в зависимости от пути их попадания в организм
- •Проникновение агента через кожный барьер
- •Проникновение агента через рот
- •Проникновение агента парентеральным путем
- •10.2.7.3. Особенности токсического действия химических веществ
- •Повреждения (отрицательные побочные эффекта), вызываемые лекарственными средствами
- •Повреждения (основные патологические эффекты), вызываемые некоторыми нелекарственными токсическими агентами
- •10.2.8. Действие на организм факторов космического полета
- •10.2.8.1. Ведущие патогенные и патогенетические факторы космического полета
- •Влияние невесомости на состояние костной и мышечной систем
- •Глава 11. Повреждения клетки
- •11.1. Введение
- •11.2. Этиология повреждения клетки
- •11.3. Классификация и характеристика основных видов повреждения клеток
- •11.4. Морфологические и функциональные проявления
- •11.5. Основные типы клеточных реакций в патологии
- •11.6. Ишемическое повреждение клетки
- •11.7. Реперфузионное повреждение клетки
- •11.8. Общие механизмы повреждения клеток
- •11.9. Общие реакции организма на повреждение клеток
- •11.10. Механизмы защиты, компенсации и адаптации поврежденных клеток
- •11.11. Основные виды повреждения клеток
- •11.11.1. Дисплазии
- •11.11.2. Дистрофии
- •Механизмы развития дистрофий
- •Классификация дистрофий
- •Характеристика зернистой дистрофии
- •Характеристика вакуольной гидропической дистрофии
- •Характеристика гиалиново-капельной дистрофии
- •Исходы дистрофий
- •11.11.3 Виды некроза и их характеристика
- •11.12. Особенности действия лекарственных средств в поврежденных клеточно-тканевых стуртурах
- •11.13. Принципы повышения устойчивости клеток к действию повреждающих факторов и стимуляции
- •Глава 12. Апоптоз и его роль в патологии
- •12.1. История изучения апоптоза
- •12.2. Определение понятия «апоптоз»
- •12.3. Роль апоптоза в жизни здорового организма
- •12.3.1. Основные типы гибели клеток и их отличия
- •Основные типы проявлений апоптоза
- •Основные морфологические и биохимические отличия апоптоза и некроза
- •Генетический контроль физиологической клеточной гибели
- •Пусковые и внутриклеточные механизмы апоптоза
- •Разновидности сигналов, приводящих к индукции апоптоза
- •Роль макрофагов в распознавании и удалении апоптотирующих клеток
- •12.4. Роль апоптоза в патологии
- •12.4.1. Апоптоз как обязательный компонент развития типовых патологических процессов
- •12.4.2. Патология, связанная с изменением выраженности апоптоза
- •12.4.2.1. Патология, обусловленная ослаблением апоптоза
- •Заболевания, связанные с ослаблением апоптоза
- •12.4.2.2. Патология, обусловленная усилением апоптоза
- •Заболевания, связанные с усилением апоптоза
- •12.4.3. Возможности терапевтического регулирования апоптоза
Генетический контроль физиологической клеточной гибели
Роль генов в регуляции апоптоза, как и других физиологических процессов в клетке – пролиферации и дифференцировки, считается общепризнанной.
В реализации (как запуске, так и модуляции) естественной клеточной гибели доказана роль генотипа, определяющего с участием различных генов последовательность биохимических и морфологических событий апоптоза, поглощения фагоцитами апоптотических телец, пикноз ядра, опзделение ядра на фрагменты, повреждение ДНК и др.
Схематично роль генов в регуляции апоптоза представлена на рис. 12-2. Индукция и осуществление различных этапов апоптоза клеток различных тканей и органов контролируется набором генов, которые обуславливают выбор апоптотического пути, реализацию или ингибирование апоптоза, а также расщепление погибших клеток и их фагоцитоз.
Доказано, что в модуляции апоптоза клеток принимают участие изменения активности следующих генов: p53, ras, Fas/APO-1, c-mys, c-jun, c-fos, nur77, bax, bcl-2, bcl-Х, be 12 и др.
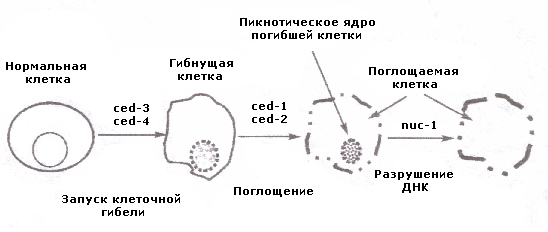
Рис. 12-2. Генетическая иерархия контроля клеточной гибели (Швартц, 1993)
В развитии апоптоза, наряду с внутренней (генетической информацией), немаловажное значение придается влиянию на организм (его клеточные и субклеточные структуры) внешней информации в виде наличия или отсутствия, во-первых, растворимых сигнальных молекул, во-вторых, взаимодействия с другими клетками, в-третьих, взаимодействия с определенными субстратами.
Пусковые и внутриклеточные механизмы апоптоза
В развитии апоптоза выделяют 3 стадии: индукторную, эффекторную и стадию деградации. Две последние стадии едины для всех разновидностей апоптоза. Первая стадия отличается большим разнообразием и существенно зависит от типа клеток и сигналов (индукторных факторов). Показано, что в одних случаях генетическая программа гибели клетки включается внешними факторами, а в других случаях эта программа реализуется при отсутствии соответствующих защитных факторов (табл. 12-2).
Наиболее полно изучены условия экзогенной индукции (внешними воздействиями) апоптоза Т-лимфоцитов, особенно кортикальных тимоцитов. Классическими индукторами апоптоза тимоцитов служат глюкокортикоиды. Последние после проникновения в клетку проявляют свое действие через рецепторы, локализующиеся в ядре. Одни тимоциты гибнут под действием кор
Таблица 12-2
Разновидности сигналов, приводящих к индукции апоптоза
|
Происхождение сигнала |
Природа сигнала |
Примеры |
|
Внеклеточные сигналы
|
Антиген. Гормон. Цитокин (FasL). |
Негативная селекция тимоцитов. Действие глюкокортикоидов. Fas-зависимый апоптоз. Цитолиз, вызванный ФНО. |
|
Внутриклеточные сигналы |
Повреждение хромосом, другие изменения хроматина. |
Радиационная гибель лимфоцитов в интерфазе. Действие топоизомераз. |
|
Дефицит факторов |
Дефицит ростовых факторов.
Дефицит антигенов.
Дефицит корецептора. |
Гибель кроветворных клеток. Гибель активированных Т-клеток в отсутствие ИЛ-2. Гибель В-клеток в зародышевых центрах. Апоптоз при активации Т-клеток в отсутствие сигнала с рецептора CD28. |
тикостероидов, а другие – нет (являются гормонрезистентными). Сигнал, поступающий в Т-лимфоциты через рецептор для антигена, в норме может либо приводить к активизации пролиферации клеток, либо вызывать их апоптоз (обозначаемый как активационный).
В качестве сигналов апоптоза могут служить: 1) отсутствие костимуляции через мембранные молекулы CD28, CD40 и др.; 2) отсутствие ростовых факторов, прежде всего ИЛ-2; 3) предварительное перекрестное сшивание молекул CD4; 4) мембранные молекулы лимфоцитов CD2; 5) молекулы главного комплекса гистосовместимости класса I; 6) 1- и2-интегрины; 7) ФНОи т.д.
Сигнал к развитию апоптоза подается, главным образом, через рецептор цитокина TNF-, который имеет цитоплазматический домен гибели, передающий летальный сигнал внутрь клетки. Некоторые цитокины, например ИЛ-2 и интерферон-, в зависимости от ситуации могут либо индуцировать, либо предотвращать развитие апоптоза. Такая амбивалентность эффектов свойственна и ряду других факторов: ингибиторам синтеза белка, активаторам и ингибиторам активности протеинкиназ и т.д.
Существуют также рецепторы, для которых передача сигнала к развитию апоптоза является основной их функцией. Это Fas-рецептор (АРО-1, CD95) и белки группы DR (Death receptors — «рецепторы смерти»): DR3(АРО-3), DR4 (TRAIL-R1), DR5 (TRAIL-R2).
В процессе передачи внутриклеточного сигнала, приводящего к развитию апоптоза, существуют две фазы. Первая, более ранняя фаза весьма вариабельна, ее характер зависит от вида пусковых механизмов (FasL → Fas, TNF → TNFR1 и т.д.). Следующая, вторая фаза универсальна для всех разновидностей апоптоза (рис. 12-3).
Как уже указывалось выше, первая фаза передачи апоптогенного сигнала может быть различной в зависимости от вида сигнала, что иллюстрируют следующие примеры.
Как видно на рис. 12-3, в случае Fas-зависимого апоптоза связывание Fas-лиганда (FasL) с тримерным Fas-рецептором приводит к конформационным изменениям в цитоплазматическом домене смерти рецептора Fas. Это создает возможность его связывания с аналогичным доменом адапторной молекулы FADD (Fas-associated death domain), a затем – с таким же доменом белка RIP (receptor interacting protein).
Образующийся DISC-комплекс (death-inducing signaling complex) активирует фермент – каспазу 8, последняя - эффекторные каспазы, вызывающие расщепление молекул-мишеней и развитие апоптоза. Исходя из рис. 12-3, можно заключить, что аналогичные события происходят при действии TNF (ФНО) через рецептор TNFR1.
Только в этом случае с рецептором взаимодействует адапторный белок TRADD (TNFR-associated death domain), который передает сигнал апоптоза через другие белки (FADDиRIP).
Выделяют и многие другие сигналы, ответственные за развитие апоптоза (протеинкиназы, протеинфосфатазы, онкосупрессоры р53 и р21, транскрипционные факторы c-mys, c-jun, c-fos, nur77 и т.д.).

Рис. 12-3.Молекулярные взаимодействия при индукции апоптоза через Fas и TNF-рецепторы. Обозначения: FasL и TNF — индукторы апоптоза; TNFR1 и Fas — рецепторы сигналов апоптоза; TRADD, FADD, RIP – белки, передающие сигнал апоптоза.
Схематично сигнализация и последовательность внутриклеточных событий при развитии апоптоза, индуцированного внеклеточными и внутриклеточными сигналами, представлены на рис. 12-4.
Данная схема иллюстрирует множественность пусковых воздействий и механизмов и единство конечных механизмов реализации апоптоза. В частности, доказано, что апоптоз может быть индуцирован многими внутриклеточными регуляторными факторами (LCK, ZAP-70, Ca2+, кальциневрин, NFAT, TRADD, FADD, RIP и др.), изменяющими активность каспаз цитоплазмы. Последние через влияние на свои ядерные мишени активируют эндонуклеазы, приводящие к деградации ДНК, и, таким образом, ответственны за универсальный этап индукции апоптоза.

Рис. 12-4. Сигнализация и последовательность внутриклеточных событий при развитии апоптоза, индуцированного различными воздействиями
