
- •Москва 2004
- •Введение
- •1. Энергетика процессов
- •1.1. Внутренняя энергия, энтальпия
- •1.2. Термохимия, закон Гесса
- •1.3 Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •Задачи и упражнения
- •1.2. Термохимия, закон г.И. Гесса
- •1.3. Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого электролита
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •4. Комплексные соединения
- •4.1. Общие сведения о комплексных соединениях
- •4.2 Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
- •Задачи и упражнения
- •4.2. Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
- •5. Окислительно-восстановительные реакции
- •6. Эквивалент, закон эквивалентов
- •Задачи и упражнения
- •6. Эквивалент. Закон эквивалентов
- •Приложение
- •Заключение
- •Рекомендуемая литература
- •Учебное издание
4.2 Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
Комплексные соединения образуются и существуют в растворах при сравнительно большом избытке лиганда. Обычно его берут в несколько раз больше того количества, которое необходимо в соответствии со стехиометрическим соотношением. В результате подавляется диссоциация комплексного соединения и оно стабилизируется.
 Разная
прочность связи во внутренней и внешней
сферах комплексного соединения ведет
к различию в характере диссоциации этих
частей молекулы. По внешней сфере в
водных растворах все комплексные
соединения являются сильными электролитами,
тогда как диссоциация по внутренней
сфере происходит в незначительной
степени. Например, для приведенного
выше соединения:
Разная
прочность связи во внутренней и внешней
сферах комплексного соединения ведет
к различию в характере диссоциации этих
частей молекулы. По внешней сфере в
водных растворах все комплексные
соединения являются сильными электролитами,
тогда как диссоциация по внутренней
сфере происходит в незначительной
степени. Например, для приведенного
выше соединения:
Константа равновесия для последнего процесса (диссоциация комплексного иона) называется константой нестойкости:
Кравн
=
Кнест
=
![]() .
.
 Константа
равновесия обратного процесса
Константа
равновесия обратного процесса
называется константой устойчивости:
Кравн
=
Куст
=
![]() .
.
Чем больше Куст (меньше Кнест), тем прочнее комплексное соединение, тем слабее оно диссоциирует. Ясно, что произведение Кнест и Куст равно единице. Разрушить комплексные соединения можно следующим образом:
1) нагрев приводит к удалению летучего лиганда, например:
t
[Cr(H2O)6]Cl3 = CrCl3 + 6H2O ;
t
[Cu(NH3)4]SO4 = CuSO4 + 4NH3 ;
2) связывание основного лиганда кислотой, например:
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4 NH4Cl + 2H2O,
движущей силой процесса в этом случае является то, что ион аммония значительно прочнее аммиачного комплекса;
3) образование малорастворимого соединения с ионом комплексообразователем, например:
[Cu(NH3)4]SO4 + K2S = CuS↓ + 4 K2SO4 + 4NH3 ,
в данном случае равновесие смещается вправо в силу того, что ПР CuS << Кнест [Cu(NH3)4]2+;
4) связывание иона-комплексообразователя в более прочный комплекс, то есть разрушение первоначального комплекса за счет образования более прочного нового комплекса, например:
[Cu(NH3)4]SO4 + 4KCNизб = K2[Cu(CN)4] + K2SO4 + 4NH3 ;
5) окисление иона-комплексообразователя, например:
5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O
6) в случае сравнительно непрочных комплексных соединений для их разрушения достаточным оказывается разбавление растворов, например:
H2O
K[BiI4] = KI + BiI3 .
Задачи и упражнения
Задачи и упражнения
4.2. Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
Пример 1. Константа нестойкости комплексного иона [Zn(CN)4]2– равна 2,510–20. Определить концентрацию иона Zn2+ в 0,1 М растворе K2[Zn(CN)4], содержащем избыток KCN в количестве 1 моль/л.
Решение. Диссоциация фигурирующих в задаче электролитов описывается следующим образом:
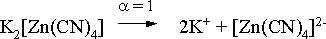


Константа равновесия диссоциации комплексного иона – константа нестойкости. Пусть равновесная концентрация иона Zn2+ составляет Х моль/л, концентрации остальных ионов составят: [CN–] = 4X+1; [Zn(CN)4]2– = 0,1 – Х.
Подставляем эти значения в выражение для константы нестойкости и находим искомую величину:

X = [Zn2+] = 2,510–21.
Пример 2. При какой концентрации ионов S2– начнет выпадать осадок CdS из 0,1 М раствора K2[Cd(CN)4], содержащего избыток KCN в количестве 1 моль/л? Kнест. [Cd(CN)4]2– = 1,410–19; ПРZnS = 1,210–28.
Решение. Условием выпадения осадка является превышение значения ПК над величиной ПР. Повторяя выкладки предыдущей задачи, находим равновесную концентрацию иона Cd2+:

y = 1,410–20.
Наконец, определяем концентрацию иона S2– :
ПК > ПР; [Cd2+][S2–] > ПР;
 .
.
Пример З. На основе справочных данных вычислить при 298,15 К константу устойчивости комплексного иона [Zn(OH)4]2–.
Решение. Константа устойчивости иона [Zn(OH)4]2– – это константа равновесия процесса

и она, естественно, может быть найдена через значение G0 для написанного процесса:
G0 = G0 обр [Zn(OH)4]2– (р-р, ст.с.,гип.недис) – G0 обр Zn2+ (р-р, ст.с) – – 4 G0 обр OH– (р-р, ст.с) .
Выписываем из справочника необходимые величины и находим значение G0 процесса, а затем – и константу устойчивости:
G0 = – 860,8 – (–147,2) – 4(–157,3) = – 84,4 кДж ;
G0 = – RT ln Kуст ;

Пример 4. Определить, какова должна быть концентрация избыточного аммиака в 0,5 М растворе [Ag(NH3)2]Cl, чтобы введение 0,0001 моль KBr в 1 л такого раствора не приводило к образованию осадка AgBr. При решении считать, что введение 0,0001 моль KBr в 1 л раствора комплексного соединения не изменит объем раствора.
Kнест [Ag(NH3)2]+ = 5,610–8; ПР AgBr = 4,910–13.
Решение. Для того чтобы осадок не выпадал, необходимо выполнение условия:
ПК = [Ag+][Br–] ПР = 4,910–13 .
Концентрация бромидных ионов в окончательном растворе известна:
[Br–] = [KBr] = 10–4 моль/л.
Находим критическую концентрацию ионов серебра в растворе:
[Ag+] 10–4 4,910–13; [Ag+] 4,910–9 .
Таким образом, задача сводится к определению концентрации избыточного аммиака, позволяющей поддерживать равновесную концентрацию ионов серебра меньше, чем 4,910–9 моль/л. Пусть искомая величина составляет Y моль/л. В соответствии с уравнением диссоциации комплексного соединения

равновесные концентрации ионов составят:
[Ag+] = 4,910–9; [NH3] = 24,910–9 +Y; [Ag(NH3)2]+ = 0,5 – 4,910–9 .
Подставляем эти величины в выражение для константы нестойкости комплексного иона и находим нужное значение:

Y = 5,7.
Следовательно, при концентрации аммиака, большей 5,7 моль/л, введение в 1 л 0,5 М раствора [Ag(NH3)2]Cl 0,0001 моль КBr не будет приводить к выпадению осадка бромида серебра.
