
- •Москва 2004
- •Введение
- •1. Энергетика процессов
- •1.1. Внутренняя энергия, энтальпия
- •1.2. Термохимия, закон Гесса
- •1.3 Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •Задачи и упражнения
- •1.2. Термохимия, закон г.И. Гесса
- •1.3. Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого электролита
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •4. Комплексные соединения
- •4.1. Общие сведения о комплексных соединениях
- •4.2 Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
- •Задачи и упражнения
- •4.2. Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
- •5. Окислительно-восстановительные реакции
- •6. Эквивалент, закон эквивалентов
- •Задачи и упражнения
- •6. Эквивалент. Закон эквивалентов
- •Приложение
- •Заключение
- •Рекомендуемая литература
- •Учебное издание
3.2. Равновесие диссоциации электролитов
Пример 1. Константа диссоциации муравьиной кислоты 1,7010–4. Найти концентрацию ионов водорода и степень диссоциации кислоты в ее 1 М растворе.
Решение. В соответствии с уравнением диссоциации кислоты:

записываем выражение для константы диссоциации:
Кдис
=
 .
.
Концентрация ионов водорода существенно меньше единицы и ею можно пренебречь. Находим концентрацию ионов водорода:
![]() .
.
Наконец, определяем степень диссоциации кислоты:
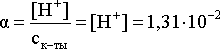 или
1,31 %.
или
1,31 %.
Пример 2. Степень диссоциации слабой одноосновной кислоты в 0,1 М растворе составляет 0,1 %. Найти концентрацию ионов водорода в ее 1 М растворе.
Решение. Для нахождения константы диссоциации кислоты воспользуемся соотношением
Кдис
=
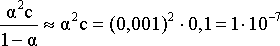 .
.
В соответствии с уравнением диссоциации кислоты

константа диссоциации связана с концентрацией ионов водорода следующим образом:
Кдис
=
Определяем концентрацию ионов водорода в 1 М растворе:
![]() моль/л
.
моль/л
.
Пример 3. В 1 л 0,1 М раствора уксусной кислоты растворили 4,48 л (н.у.) хлороводорода. Как изменилась при этом степень диссоциации уксусной кислоты? Принять объем окончательного раствора равным 1 л, константа диссоциации уксусной кислоты составляет 1,7510–5.
Решение. Определим степень диссоциации уксусной кислоты в исходном растворе:

Кдис
=

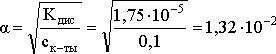 .
.
В соответствии с уравнением диссоциации появление в растворе сильной хлороводородной кислоты приведет к резкому смещению равновесия диссоциации уксусной кислоты влево. Пусть концентрация ионов водорода, образующихся за счет собственной диссоциации уксусной кислоты равна Х моль/л, такова же концентрация и ацетат-анионов; общая концентрация ионов водорода в растворе составит (X + 0,2) моль/л (4,48 л хлороводорода составляют 0,2 моль). Подставляем эти величины в выражение для константы диссоциации и находим X:
Кдис
= .
.
Определяем степень диссоциации уксусной кислоты в окончательном растворе:
 .
.
Таким образом, введение в раствор 0,2 моль хлороводорода привело к уменьшению степени диссоциации уксусной кислоты в:
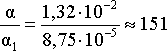 раз.
раз.
Пример 4. Константы ступенчатой диссоциации сероводородной кислоты составляют 9,7410–8, 1,3610–13. Найти концентрации ионов Н+, HS– и S2– в 0,01 М растворе этой кислоты.
Решение. В соответствии с уравнением диссоциации H2S по первой ступени
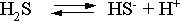
определяем концентрацию ионов Н+ и HS– :
Кдис(1)
=
 ;
;
![]()
Диссоциация по второй ступени

протекает в значительно меньшей степени за счет подавления ее продуктами диссоциации по первой ступени и большей трудности отрыва протона от аниона по сравнению с нейтральной молекулой. Пусть концентрация анионов серы в растворе равна Х моль/л, концентрация ионов водорода составит (X + 3,1210–5) моль/л, а концентрация ионов HS– – (3,1210–5 – X) моль/л. Подставляем эти величины в выражение для второй константы диссоциации:
Кдис(2)
= .
.
Таким образом, концентрация аниона серы практически равна значению второй константы диссоциации кислоты.
3.3. Шкала термодинамических функций образования ионов в водных растворах
Пример 1. На основе справочных данных определить вторую константу диссоциации ортофосфорной кислоты при 298,15 К.
Решение. Второй ступени диссоциации ортофосфорной кислоты соответствует процесс:

Находим стандартную энергию Гиббса этого процесса:
G0=G0обр H+(р-р, ст.с) + G0обр HPO42-(р-р, ст.с, гип.недис) –
– G0обр H2PO4- (р-р, ст.с, гип.недис) = 0 + (–1083,2) – (–1124,3) = 41,1 кДж .
Затем определяем константу диссоциации:
G0 = –RTlnKравн = –RTlnKдис(2)
Кдис(2)
=![]() .
.
Пример 2. Стандартная энтальпия образования NaCl (к) равна –411,1 кДж/моль, энтальпия растворения этого соединения в воде с образованием бесконечно разбавленного раствора равна 3,6 кДж/моль, а стандартная энтальпия образования аниона хлора в водном растворе составляет –167,1 кДж/моль. Определить стандартную энтальпию образования иона Na+ .
Решение. Ключом к нахождению искомой величины является положение, что стандартная энтальпия образования NaCl в растворе равна сумме стандартных энтальпий образования ионов Na+ и Сl– в растворе. Первая же величина, в свою очередь, равна сумме стандартных энтальпий образования NaCl (к) и энтальпии его растворения с образованием бесконечно разбавленного раствора. Таким образом:
H0обр NaCl (р-р, ст.с) = H0обр Na+ (р-р, ст.с) + H0обр Cl- (р-р, ст.с) = = H0обр NaCl (к) + H0раств;
H0обр Na+ (р-р, ст.с) = H0обр NaCl (к) + H0раств – H0обр Cl- (р-р, ст.с) =
= –411,1 + 3,6 – (–167,1) = –240,4 кДж/моль .
Пример 3. По следующим данным:
H0обр NaCl (р-р, ст.с) = –407,5 кДж/моль = H01;
H0обр KCl (р-р, ст.с) = –419,4 кДж/моль = H02;
H0обр NaBr (р-р, ст.с) = –361,8 кДж/моль = H03;
H0обр NaI (р-р, ст.с) = –295,6 кДж/моль = H04 .
определить H0обрKBr (р-р, ст.с); H0обрKI (р-р, ст.с) .
Решение. Поскольку стандартные энтальпии образования электролитов в растворе тождественно равны сумме стандартных энтальпий образования составляющих их ионов, можно записать:
H0обрKCl (р-р, ст.с) – H0обрNaCl (р-р, ст.с) = H0обрK+ (р-р, ст.с) +
+ H0обрCl– (р-р, ст.с) – H0обрNa+ (р-р, ст.с) – H0обрCl– (р-р, ст.с) =
= H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с)
Складываем эту величину c H0обрNaBr (p-p, ст.с) и получаем:
H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) + H0обрNaBr (р-р, ст.с) =
= H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) + H0обрNa+ (р-р, ст.с) +
+ H0обрBr– (р-р, ст.с) = H0обрKBr (р-р, ст.с)
Находим одну из искомых величин:
H0обрKBr (р-р, ст.с) = H02 – H01 + H03 = –419,4 – (–407,5) + (–361,8) =
= – 373,7 кДж/моль.
Аналогично определяем H0обрKI (р-р, ст.с):
H0обрKCl (р-р, ст.с) – H0обрNaCl (р-р, ст.с) + H0обрNaI (р-р, ст.с) =
= H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) + H0обрNa+ (р-р, ст.с) +
+ H0обрI–(р-р, ст.с) = H0обрKI (р-р, ст.с) = H02 – H01 + H04 =
= –419,4 – (–407,5) + (–295,6) = – 307,5 кДж/моль.
