
- •Москва 2004
- •Введение
- •1. Энергетика процессов
- •1.1. Внутренняя энергия, энтальпия
- •1.2. Термохимия, закон Гесса
- •1.3 Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •Задачи и упражнения
- •1.2. Термохимия, закон г.И. Гесса
- •1.3. Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого электролита
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •4. Комплексные соединения
- •4.1. Общие сведения о комплексных соединениях
- •4.2 Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
- •Задачи и упражнения
- •4.2. Образование и разрушение комплексных соединений. Диссоциация комплексных соединений
- •5. Окислительно-восстановительные реакции
- •6. Эквивалент, закон эквивалентов
- •Задачи и упражнения
- •6. Эквивалент. Закон эквивалентов
- •Приложение
- •Заключение
- •Рекомендуемая литература
- •Учебное издание
3.6. Гидролиз солей
Пример 1. Определить рН 0,3 М раствора NH4Br, если константа диссоциации гидроксида аммония в водном растворе составляет 1,7110–5.
Решение. Бромид аммония гидролизован по катиону в растворе:

Согласно соотношению (3.23):

С другой стороны (соотношение 3.24):

Из этих двух выражений и вычисляем рН 0,3 М раствора NH4Br:
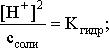
![]()
pH = – lg 1,3210–5 = 4,88 .
Пример 2. Определить рН раствора и степень гидролиза соли в 0,1 М растворе Na2S, если константы ступенчатой диссоциации H2S составляют: К1=9,7410–8; К2= 1,3610–13.
Решение. Сульфид натрия – соль, гидролизованная по аниону. Поскольку сероводородная кислота двухосновна, гидролиз идет по двум ступеням. Выше было показано, что для практических расчетов достаточно принимать во внимание лишь первую ступень гидролиза. В нашем случае это следующий процесс:

Определяем константу гидролиза:

С другой стороны:

Решая полученное квадратное уравнение, находим рН раствора и степень гидролиза:
[ОН–] = 0,0565 (второй корень уравнения отрицателен!)
рОН = – lg 0,0565 = 1,25; рН = 14 – 1,25 = 12,75;

Пример 3. рН 0,5 М раствора ацетата калия равен 9,23. Определить константу диссоциации уксусной кислоты.
Решение. Ацетат калия – соль, гидролизованная по аниону:

Согласно соотношению (3.27) для этой системы:

Находим величину константы гидролиза:
pH = 9,23; pOH = 14 – 9,23 = 4,77; [OH–] = 1,7010–5;
 .
.
С другой стороны, согласно (3.26) в случае гидролиза по аниону:
 .
.
Отсюда определяем константу диссоциации уксусной кислоты:

Пример 4. По справочным данным определить константу гидролиза НСООК при 298,15 К.
Решение. Формиат калия – соль, подвергающаяся гидролизу по аниону:
![]()
Константа равновесия этого процесса и есть константа гидролиза, она соответственно может быть найдена на основе стандартного значения энергии Гиббса:
G0 = G0обрOH–(р-р, ст.с) + G0обрHCOOH(р-р, ст.с., гип.недис) – G0обрH2O(ж) –
–G0обрHCOO–(р-р, ст.с) = –157,3 + (–373,0) – (–237,3) – (–351,5) = 58,5 кДж.
Далее находим константу гидролиза:
G0 = – RT ln Kгидр;
 .
.
Пример 5. На сколько единиц изменится рН раствора соли, гидролизованной по аниону, при его разбавлении в 100 раз?
Решение. В случае гидролиза по аниону согласно (3.27):

Запишем равенство величин констант гидролиза в растворах соли двух концентраций:

![]() .
.
Логарифмируем полученное соотношение и меняем знаки в уравнении:
2 lg [OH–]1 = 2 + 2 lg [OH–]2
– lg [OH–]1 = –1 – lg [OH–]2
pOH1 = pOH2 – 1
14 – pH1 = 14 – pH2 – 1
pH1 = pH2 + 1.
Таким образом, при разбавлении раствора соли, гидролизованной по аниону, в 100 раз, величина рН уменьшается на единицу.
4. Комплексные соединения
4.1. Общие сведения о комплексных соединениях
Соединения, образованные из двух или более простых соединений, каждое из которых может существовать независимо, называют комплексными соединениями. Иногда, чтобы подчеркнуть особенность образования химической связи в этих соединениях, их определяют как соединения высшего порядка, образованные из более простых, устойчивых соединений без возникновения новых электронных пар.
 Центральный
ион (атом) в комплексном соединении
называется комплексообразователем.
Это обычно ион d-
или f-элемента,
реже – р- или s-элемента.
Непосредственно окружающие
комплексообразователь ионы или молекулы,
называемые лигандами,
образуют вместе с комплексообразователем
так называемую внутреннюю
(координационную) сферу
комплексного
соединения. Ее обычно выделяют квадратными
скобками. Ионы (молекулы) за пределами
внутренней сферы образуют внешнюю
сферу
комплексного соединения. Например, в
соединении
Центральный
ион (атом) в комплексном соединении
называется комплексообразователем.
Это обычно ион d-
или f-элемента,
реже – р- или s-элемента.
Непосредственно окружающие
комплексообразователь ионы или молекулы,
называемые лигандами,
образуют вместе с комплексообразователем
так называемую внутреннюю
(координационную) сферу
комплексного
соединения. Ее обычно выделяют квадратными
скобками. Ионы (молекулы) за пределами
внутренней сферы образуют внешнюю
сферу
комплексного соединения. Например, в
соединении
Общее число лигандов во внутренней сфере называется координационным числом (к.ч.). Простейшее объяснение механизма образования химической связи в комплексных соединениях – донорно-акцепторное взаимодействие между лигандами и комплексообразователем: лиганды поставляют свободные электронные пары на пустые d-ор6итали комплексообразователя (подробнее – во второй части этого пособия). Лиганд в общем случае может занимать во внутренней сфере не одно, а два (или более) координационных мест в соответствии с числом свободных электронных пар, поставляемых лигандом на свободные орбитали комплексообразователя. Число таких координационных мест, занимаемых лигандом, называется дентатностью. Соответственно различают: монодентатные лиганды – F─, Cl─, CN─, ОН─, NH3, H2O и т.д.; бидентатные лиганды – С2О42─, этилендиамин и т.п. Возможны лиганды и большей дентатности, так, в аналитической химии широко применяется этилендиаминтетрауксусная кислота и ее динатриевая соль (ЭДТА), эти лиганды имеют дентатность, равную шести. Координационные числа обычно четные, наиболее распространены к.ч. 6 и 4. Как правило, координационное число равно удвоенной степени окисления иона-комплексообразователя, то есть комплексным соединениям Ме2+ наиболее характерно к.ч.=4, а для комплексов Ме3+ к.ч.=6. Однако следует иметь в виду, что координационные числа часто бывают и больше, чем удвоенная степень окисления иона-комплексообразователя, и, гораздо реже, меньше. Так, в водных растворах большинство ионов двухвалентных металлов представляют собой гексаакваионы [Me(H2O)6]2+.
По характеру лигандов можно выделить следующие основные типы комплексных соединений. В аквакомплексах лигандом является молекула воды, например, кристаллогидраты. В гидроксокомплексах лиганд – ОН─,
например: K2[Sn(OH)4], Na3[Cr(OH)6]. Аммиачные комплексы (лиганд – NH3), например: [Ag(NH3)2]Cl, [Cu(NH3)4](OH)2. Наиболее обширную группу составляют ацидокомплексы, в которых лигандами выступают анионы кислотных остатков, например: K[Au(CN)2], K2[HgI4].
Все приведенные выше комплексные соединения являются однородными, то есть содержат единственный лиганд; возможны и комплексные соединения с различными лигандами, например: [Cr(H2O)5Cl]Cl2.
Могут быть комплексные соединения и без внешней сферы, то есть внутрисферные комплексные соединения, например: [Pt(NH3)2Cl2].
Названия комплексных соединений строятся по принципу названий солей с указанием лигандов и степени окисления комплексообразователя. При построении названия комплексного катиона или аниона первоначально называют ионные лиганды в порядке возрастания степени их сложности. Далее называют лиганды-молекулы также в порядке возрастания степени их сложности. При этом молекулы H2O и NH3 обозначаются "аква" и "аммин". При необходимости используются соответствующие соединительные гласные. В конце названия комплексного катиона или аниона называется ион-комплексообразователь с указанием его степени окисления римскими цифрами в скобках. В случае аниона берется корень латинского названия элемента, к нему прибавляется окончание "ат", например: станнат, аурат, плюмбат. Примеры:
[Cr(NH3)4Cl2]Cl хлорид дихлоротетрамминхрома (III);
K3[Al(OH)6] гексагидроксоалюминат (III) калия;
[Co(NH3)6][Cr(CN)6] гексацианохромат (III) гексаамминкобальта (III);
[Pt(NH3)2Cl2] дихлородиамминплатина (II).
Для комплексных соединений характерно явление изомерии, рассмотрим кратко основные его типы. Ионизационная изомерия обусловлена различным распределением ионов между внутренней и внешней сферами комплексного соединения, например:
[Cr(NH3)4Cl2]Br и [Cr(NH3)4ClBr]Cl .
В случае если катион и анион являются комплексными, возможна координационная изомерия, она связана с различным распределением лигандов между комплексообразователями, например:
[Cr(NH3)6][Co(CN)6] и [Co(NH3)6][Cr(CN)6] .
Если молекулы или ионы, являющиеся лигандами, могут существовать в различных изомерных формах, возможна изомерия лигандов. Такой вид изомерии чаще характерен для комплексных соединений с органическими лигандами, например:

Различное пространственное расположение лигандов ведет к цис-транс-изомерии и зеркальной изомерии. Так для комплексов с к.ч.=4, имеющих квадратное строение, существуют цис- и транс-изомеры, например:

цис-изомер транс-изомер
Зеркальные изомеры комплексных соединений имеют идентичные химические и физические свойства, они различаются лишь асимметрией кристаллов и разным направлением вращения плоскости поляризации света.
