
- •Список теоретических вопросов к экзамену
- •Вопрос 2) Св-ва волновой функ. Понятие об уравнении Шредингера. Что такое узловые поверхности? Охарактеризуйте квантовыми числами следующее состояние электронов (в основном состоянии): ….
- •Вопрос 4) Принцип Паули и правило Хунда. Сколько максимально электронов может быть в электронном слое, электронной оболочке, на орбитали ? Какую форму имеют s-, p-, d- орбитали ?
- •Вопрос 5) Энергия электрона в многоэлектронном атоме. Энергический ряд атомных орбиталей. Напишите электронные формулы атомов …, и иона …. Какие степени окисления может иметь … в соединениях?
- •Вопрос 6) Современная формулировка периодического закона. Энергия ионизации и сродство к электрону, закономерности в их изменении по периодам и группам периодической системы.
- •Вопрос 7) Атомные и ионные радиусы, как их определяют? Как изменяются радиусы в радах: …
- •Вопрос 8) Атомные и ионные радиусы, как их определяют? Основные закономерности их изменения по периодам и группам периодической системы.
- •Вопрос 9) Относительная сила кислот и оснований (схема Косселя) на примерах … .
- •Вопрос 10) Основные положения метода валентных связей при описании химической связи. Валентные возможности атомов ….
- •Вопрос 11) Донорно – акцепторный механизм образования ковалентной связи на примерах молекул … , и ионов ….
- •Вопрос 12) Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s-, p- и d- орбиталей. Какие из приведенных молекул линейные: … ?
- •Вопрос 13) Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s-, p- и d- орбиталей. Какие из преведенных молекул плоские: … ?
- •Вопрос 14) Гибридизация атомных орбиталей при описании химической связи. Изобратите схемы перекрывания атомных орбиталей при образования связей в молекулах: …
- •Вопрос 15) Образование кратных связей. Δ- и π- связи, их особенности. Изобратите схемы перекрывания атомных орбиталей при образования связей в молекулах: …
- •Вопрос 16) Процедура наложения валентных схем в методе валентных связей для объяснения дробной кратности связи на примерах молекул … и иона …
- •Вопрос 17) Модель отталкивания локализованных электронных пар (метод Гиллеспи). Основные положения на примере молекул ….
- •Вопрос 19) Основные положения метода молекулярных орбиталей (мо лкао). Объясните парамагнитные св-ва … и найдите кратность связи в … и …
- •Вопрос 20) Основные положения метода валентных связей при описании химической связи в комплексных соединениях. Рассмотрите на примерах … и …
- •Вопрос 21) Основные положения теории кристаллического поля при описании химической связи в комплексных соединениях. Рассмотрите на примерах … и …
- •Вопрос 24) Классификация окислительно – восстановительных реакций. Преведите по 2 примера реакций каждого типа (не используйте уравнения из задания №5).
- •Вопрос 25) Типичные восстановители в овр. Каковы продукты их окисления? Приведите примеры. Классификация овр.
- •Вопрос 26) Типичные окислители в овр. Каковы продукты их восстановления? Классификация овр. Приведите примеры.
- •Вопрос 27) Общие сведения о комплексных соединениях: комплексообразователь, лиганды, координационное число, внутренняя и внешняя сферы. Классификация комплексных соединений. Приведите примеры.
- •Вопрос 28) Классификация комплексных соединений: по виду координируемых лигандов, по заряду комплексного иона, по классам соединений. Номенклатура комплексных соединений. Приведите примеры.
- •Вопрос 29) Закон Гесса, условия его выполнения. Энтальпии образовании, сгорания, атомизации (определение).
- •Вопрос 30) Закон Гесса. Следствия из закона Гесса. При каких условиях выполняется этот закон?
- •Вопрос 31) Стандартные термодинамические характеристики. Понятие о стандартном состоянии индивидуальных жидких и кристаллических в-в, газов и растворов. Закон Гесса.
- •Вопрос 32) Энтальпия и энергия Гиббса, их физический смысл, связь между ними.
- •Вопрос 34) Критерий самопроизвольного протекания реакций, энтальпийный и энтропийный факторы процесса. Какие реакции протекают самопроизвольно в водных растворах?
- •Вопрос 35) Химическое равновесие. Истинное (устойчивое) и кажущееся (кинетическое) равновесие, их признаки. Приведите примеры.
- •Вопрос 36) Химическое равновесие. Принцип Ле-Шателье – Брауна и смещение равновесия. Рассмотрите на примере реакции ……
- •Вопрос 37) Константа химического равновесия. Соотношение величин Кр и Кс для газовых равновесий. Связь и константы равновесия.
- •Вопрос 38) Равновесие диссоциации ассоциированных (слабых) электролитов на примере .... Степень диссоциации, константа диссоциации. Закон разбавления Оствалда.
- •Вопрос 39) Принципы построения шкалы стандартных термодинамических функций образования ионов в водных растворах. Как определить стандартную энтальпию образования …. В водном растворе.
- •Вопрос 40) Шкалы величин рН и рОн. Вычисление рН растворов неассоциированных электролитов на примерах ….
- •Вопрос 41) Равновесие диссоциации воды. Ионное произведение воды. Шкалы величин рН и рОн.
- •Вопрос 43) Буферные растворы и их св-ва. Расчет рН буферного раствора состава ….
- •Вопрос 44) Равновесие растворения и диссоциации малорастворимого электролита. Произведение растворимости. Связь пр и растворимости (на примере …..).
- •Вопрос 45) Условия выпадения осадка и растворения малорастворимых электролитов. Связь пр с растворимостью на примере ….
- •Вопрос 46) Произведение растворимости как константа равновесия растворения и диссоциации малорастворимого соединения. Связь пр с растворимостью на примере ….
- •Вопрос 47) Польный (необратимый) гидролиз. Взаимное усиление гидролиза (совместный гидролиз). Приведите примеры.
- •Вопрос 49) Гидролиз солей одновременно по катиону и аниону (обратимый гидролиз). Расчет константы гидролиза, степени гидролиза и рН растворов таких солей на примере …
- •Вопрос 50) Гидролиз солей по катиону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по катиону на примере ….
- •Вопрос 51) Гидролиз солей по аниону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по аниону на примере ….
Вопрос 51) Гидролиз солей по аниону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по аниону на примере ….
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулями воды ведет к реакции, наз. гидролизом солей.
Молекулярная причина гидролиза – поляризационное взаимодействие ионов с сильно полярной молекулой воды. В результате катионы «вырывают» из молекулы воды ОН-, а анион – Н+. Другими словами, катионы и анионы вторгаются в равновесие диссоциации воды, нарушают его, в результате в случае катиона р-р становится кислым (гидролиз по катиону), в случае аниона – щелочным (гидролиз по аниону). Сила поляризационного вз-ия увеличивается с ростом заряда иона и уменьшением радиуса его иона. Как раз многозарядные катионы (+2,+3) являются катионами слабых оснований, аналогично компактные анионы с зарядом (-2,-3) явл. анионами слабых кислот.
Продукты
гидролиза подавляют вторую ступень,
поэтому гидролиз реально протекает
лишь по первой ступени: Am-
+ H2O
![]() HA(m-1)-
+ OH-
.
HA(m-1)-
+ OH-
.
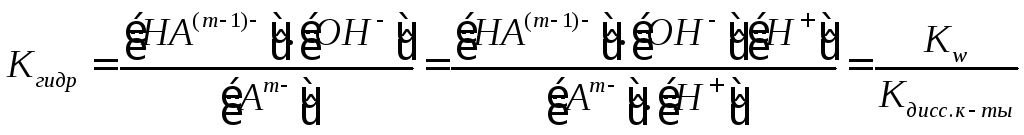
Константа
гидролиза − константа равновесия
процесса гидролиза. Пусть с
– общая концентрация катиона (общ.
концентрация соли в случае симметричного
электролита); h
– степень гидролиза аниона Аn.
Равновесные концентрации составляют:
![]()
![]() Тогда, получаем:
Тогда, получаем:
![]() .
.
Способы усиления гидролиза солей:
1) разбавление раствора соли;
2) нагрев раствора, поскольку энтальпии гидролиза положительны;
3) добавление щелочи в раствор для усиления гидролиза по катиону, добавление кислоты в раствор для усиления гидролиза по аниону.
