
- •Список теоретических вопросов к экзамену
- •Вопрос 2) Св-ва волновой функ. Понятие об уравнении Шредингера. Что такое узловые поверхности? Охарактеризуйте квантовыми числами следующее состояние электронов (в основном состоянии): ….
- •Вопрос 4) Принцип Паули и правило Хунда. Сколько максимально электронов может быть в электронном слое, электронной оболочке, на орбитали ? Какую форму имеют s-, p-, d- орбитали ?
- •Вопрос 5) Энергия электрона в многоэлектронном атоме. Энергический ряд атомных орбиталей. Напишите электронные формулы атомов …, и иона …. Какие степени окисления может иметь … в соединениях?
- •Вопрос 6) Современная формулировка периодического закона. Энергия ионизации и сродство к электрону, закономерности в их изменении по периодам и группам периодической системы.
- •Вопрос 7) Атомные и ионные радиусы, как их определяют? Как изменяются радиусы в радах: …
- •Вопрос 8) Атомные и ионные радиусы, как их определяют? Основные закономерности их изменения по периодам и группам периодической системы.
- •Вопрос 9) Относительная сила кислот и оснований (схема Косселя) на примерах … .
- •Вопрос 10) Основные положения метода валентных связей при описании химической связи. Валентные возможности атомов ….
- •Вопрос 11) Донорно – акцепторный механизм образования ковалентной связи на примерах молекул … , и ионов ….
- •Вопрос 12) Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s-, p- и d- орбиталей. Какие из приведенных молекул линейные: … ?
- •Вопрос 13) Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s-, p- и d- орбиталей. Какие из преведенных молекул плоские: … ?
- •Вопрос 14) Гибридизация атомных орбиталей при описании химической связи. Изобратите схемы перекрывания атомных орбиталей при образования связей в молекулах: …
- •Вопрос 15) Образование кратных связей. Δ- и π- связи, их особенности. Изобратите схемы перекрывания атомных орбиталей при образования связей в молекулах: …
- •Вопрос 16) Процедура наложения валентных схем в методе валентных связей для объяснения дробной кратности связи на примерах молекул … и иона …
- •Вопрос 17) Модель отталкивания локализованных электронных пар (метод Гиллеспи). Основные положения на примере молекул ….
- •Вопрос 19) Основные положения метода молекулярных орбиталей (мо лкао). Объясните парамагнитные св-ва … и найдите кратность связи в … и …
- •Вопрос 20) Основные положения метода валентных связей при описании химической связи в комплексных соединениях. Рассмотрите на примерах … и …
- •Вопрос 21) Основные положения теории кристаллического поля при описании химической связи в комплексных соединениях. Рассмотрите на примерах … и …
- •Вопрос 24) Классификация окислительно – восстановительных реакций. Преведите по 2 примера реакций каждого типа (не используйте уравнения из задания №5).
- •Вопрос 25) Типичные восстановители в овр. Каковы продукты их окисления? Приведите примеры. Классификация овр.
- •Вопрос 26) Типичные окислители в овр. Каковы продукты их восстановления? Классификация овр. Приведите примеры.
- •Вопрос 27) Общие сведения о комплексных соединениях: комплексообразователь, лиганды, координационное число, внутренняя и внешняя сферы. Классификация комплексных соединений. Приведите примеры.
- •Вопрос 28) Классификация комплексных соединений: по виду координируемых лигандов, по заряду комплексного иона, по классам соединений. Номенклатура комплексных соединений. Приведите примеры.
- •Вопрос 29) Закон Гесса, условия его выполнения. Энтальпии образовании, сгорания, атомизации (определение).
- •Вопрос 30) Закон Гесса. Следствия из закона Гесса. При каких условиях выполняется этот закон?
- •Вопрос 31) Стандартные термодинамические характеристики. Понятие о стандартном состоянии индивидуальных жидких и кристаллических в-в, газов и растворов. Закон Гесса.
- •Вопрос 32) Энтальпия и энергия Гиббса, их физический смысл, связь между ними.
- •Вопрос 34) Критерий самопроизвольного протекания реакций, энтальпийный и энтропийный факторы процесса. Какие реакции протекают самопроизвольно в водных растворах?
- •Вопрос 35) Химическое равновесие. Истинное (устойчивое) и кажущееся (кинетическое) равновесие, их признаки. Приведите примеры.
- •Вопрос 36) Химическое равновесие. Принцип Ле-Шателье – Брауна и смещение равновесия. Рассмотрите на примере реакции ……
- •Вопрос 37) Константа химического равновесия. Соотношение величин Кр и Кс для газовых равновесий. Связь и константы равновесия.
- •Вопрос 38) Равновесие диссоциации ассоциированных (слабых) электролитов на примере .... Степень диссоциации, константа диссоциации. Закон разбавления Оствалда.
- •Вопрос 39) Принципы построения шкалы стандартных термодинамических функций образования ионов в водных растворах. Как определить стандартную энтальпию образования …. В водном растворе.
- •Вопрос 40) Шкалы величин рН и рОн. Вычисление рН растворов неассоциированных электролитов на примерах ….
- •Вопрос 41) Равновесие диссоциации воды. Ионное произведение воды. Шкалы величин рН и рОн.
- •Вопрос 43) Буферные растворы и их св-ва. Расчет рН буферного раствора состава ….
- •Вопрос 44) Равновесие растворения и диссоциации малорастворимого электролита. Произведение растворимости. Связь пр и растворимости (на примере …..).
- •Вопрос 45) Условия выпадения осадка и растворения малорастворимых электролитов. Связь пр с растворимостью на примере ….
- •Вопрос 46) Произведение растворимости как константа равновесия растворения и диссоциации малорастворимого соединения. Связь пр с растворимостью на примере ….
- •Вопрос 47) Польный (необратимый) гидролиз. Взаимное усиление гидролиза (совместный гидролиз). Приведите примеры.
- •Вопрос 49) Гидролиз солей одновременно по катиону и аниону (обратимый гидролиз). Расчет константы гидролиза, степени гидролиза и рН растворов таких солей на примере …
- •Вопрос 50) Гидролиз солей по катиону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по катиону на примере ….
- •Вопрос 51) Гидролиз солей по аниону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по аниону на примере ….
Вопрос 38) Равновесие диссоциации ассоциированных (слабых) электролитов на примере .... Степень диссоциации, константа диссоциации. Закон разбавления Оствалда.
Количественной характеристикой диссоциации является степень диссоциации α, равная отношению числа распавшихся на ионы молекул к общему их числу. Ее обычно выражают либо в долевом исчислении, либо в процентах. К слабым электролитам в водных растворах относят кислоты: угольную, сернистую, сероводородную, серную (по второй ступени), ортофосфорную, все карбоновые к-ты; основания: гидроксиды магния, бериллия, алюминия, аммония, все гидроксиды d-элементов.
Константа
равновесия диссоциации электролита:
KtnAm(k)
![]() nKtm+
+ mAn-
называется константой диссоциации:
Кравн
= Кдисс
=
nKtm+
+ mAn-
называется константой диссоциации:
Кравн
= Кдисс
=
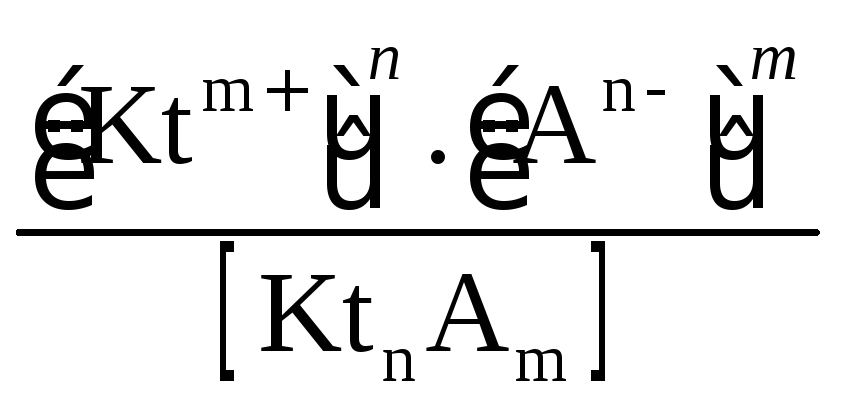 .
.
Отрыв
протона от анионов происходит в меньшей
степени, чем отрыв от нейтральной
молекулы. Кроме того, ионы водорода,
образовавшиеся в первой ступени
диссоциации, подавляют вторую степень
диссоциации, ионы водорода, образовавшиеся
при первой и второй ступенях, подавляют
третью ступень диссоциации. В результате
реально диссоциация протекает лишь по
первой ступени.
Как вывод, диссоциацию
любого слабого электролита, независимо
от того, диссоциирует он ступенчато или
нет, можно смоделировать равновесием
диссоциации симметричного электролита:
KtA
![]() Ktn+
+ An-
.
Ktn+
+ An-
.
Пусть
общая концентрация электролита KtA
составляет с моль/л; степень диссоциации
при этой концентрации равна α.
Тогда равновесные концентрации катиона,
аниона и недиссоциированного электролита
составят: [Ktn+]
= [An-]
= αс;
[KtA]
= с – αс.
Подставляем эти соотношения в выражение
для константы диссоциации:
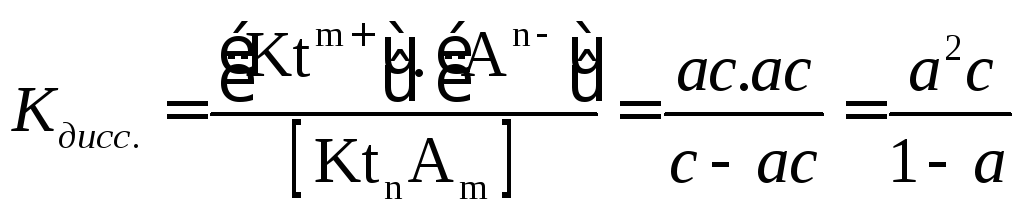 .
.
Соотношение, связывающее константу диссоциации с концентрацией электролита и степенью его диссоциации носит название закона разбваления Оствальда. Зачастую степень диссоциации элетролита мала, тогда выражение упрощается Кравн ≈ а2с . (а≪1)
Вопрос 39) Принципы построения шкалы стандартных термодинамических функций образования ионов в водных растворах. Как определить стандартную энтальпию образования …. В водном растворе.
Бесконечно разбавленный раствор – это такой раствор, в котором 1 моль р-ного в-ва приходится на бесконечно большое число молей р-ля. Его характеристики:
1) все электролиты в нём полностью диссоциированы.
2) взаимодействие между ионами полностью отсутствуют.
Любое св-во индивидуального иона, например термодинамическое, не может быть объективно определено. В таких ситуациях прибегают к построению шкалы относительных величин, в которой значение рассматриваемого св-ва для одной из систем постулируется, а значение св-ва других систем отсчитываются от принятого значения. В частности для водных растворов электролитов шкала термодинамических функ. обр. ионов строится на основе следующих допущений:
![]() ;
;
![]() ;
;
![]()
Аналогичным путем были найдены стандартные энергии Гиббса образования ионов и стандартные энтропии ионов. Хотя энтропий в-в могут быть толко положительными, энтропии ионов могут быть и отрицательными, поскольку они – относительные величины.
Константа дисс. любого электролита можеть быть найдена по формуле:
![]()
где Кравн. = Кдисс., ∆Gпроцесса как разность стандартных энергий Гиббса обр. ионов и недиссоциированного электролита. Электролит находится в растворе со св-вами бесконечно разбавленного, но при этом не диссоциирует на ионы (раствор, стандартное состояние, гипотетически недиссоциированный).
Энтальпия обр. раствора данного соединения определенной концентрации равна стандартной энтальпии обр. этого соединения плюс энтальпия его растворения с обр. раствора нужного состава. Если происходит растворение с образованием бесконечно разбавленного раствора, то получаем стандарную энтальпию обр. соед. в состоянии раствора. Если растворяемое соед. явл. электролитом, то его стандарная энтальпия обр. равна сумме стандартных энтальпий обр. ионов.
