
ЦБП
.pdf
nCH2  CH
CH 
 CH2 CH
CH2 CH
Cl |
Cl |
n |
винилхлорид |
поливинилхлорид |
3.8 ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
Диеновые углеводороды содержат две двойные связи. Известно, что одна связь обозначается суффиксом -ен, а две двойные связи – суффиксом -диен. Сравним состав алкенов и алкадиенов:
C3H6; |
C3H4; |
C4H8; |
C4H6; |
C5H10; |
C5H8. |
пропен |
пропадиен |
бутен |
бутадиен |
пентен |
пентадиен |
Две двойные связи в молекулах алкадиенов могут быть расположены по-разному: они могут находиться у одного атома углерода, например СН2=С=СН2, тогда их называют кумулированными; двойные связи могут чередоваться с одинарной связью, например СН2=СН– СН=СН2, тогда их называют сопряженными: наконец, двойные связи могут быть изолированными, например СН2=СН–СН2–СН=СН2. Для бутадиена возможны два изомера:
У пентадиена еще больше изомеров как с нормальной, так и с разветвленной цепью. Наибольшее значение имеют алкадиены с сопряженными связями: бутадиен-1,3 и 2-
метилбутадиен-1,3, или изопрен,
Их можно получить дегидрированием алканов в присутствии катализатора (Ni):
Дивинил – газ, изопрен – легко кипящая жидкость. Алкадиены характеризуются особыми свойствами, обусловленными их электронным строением. Рассмотрим строение алкадиенов на примере бутадиена-1,3.
С помощью физических методов установлено, что все атомы углерода в молекуле бутадиена-1,3 расположены в одной плоскости, а также определены межатомные расстояния (в нм): 
Как объяснить, что крайние связи (C1–C2 и С3–С4) имеют несколько большую длину, чем двойная связь в этилене (0.134 нм), а центральная связь (С2–С3) короче простой связи С–С (0.154 нм)?
У каждого атома углерода – три гибридные sp2-орбитали, которые перекрываются с другими орбиталями атомов углерода и водорода с образованием σ-связей. Оставшиеся четыре негибридизованные р-электронные орбитали взаимно перекрываются. У центральных атомов углерода их перекрывание несколько меньше, чем у крайних атомов, что и вызывает уменьшение длины связи (рис. 3.11). Масштабная модель молекулы бутадиена-1,3 дана на рисунке 3.12.
51

Рис. 3.11. Электронное строение молекулы бутадиена: а, б – различное изображение перекрывания р- орбиталей; в – проекция схем а и б
При перекрывании р-орбиталей получаются не отдельные π-связи, а единое, общее π-электронное облако или π-электронная система. В данном случае произошло сопряжение двойных связей, некоторое выравнивание связей. Часто сопряжение связей изображают так:
Сопряженная система дает выигрыш в энергии. Рис. 3.12. Масштабная модель мо- Так, при каталитическом гидрировании бутена-1 выде- лекулы бутадиена-1,3
ляется 126 кДж/моль, а при гидрировании бутадиена-1,3 – 236,9 кДж/моль, а не 252 кДж/моль. Сопряжение понизило энергию двух двойных связей на 16.1 кДж/моль. Эта величина называется энергией сопряжения соединения. π-Электронная система открыта для электрофильных реагентов, она обладает большой реакционной способностью. Ее основная особенность заключается в том, что она реагирует как единое целое. Рассмотрим реакцию электрофильного присоединения хлороводорода к бутадиену-1,3. Реакция начинается с присоединения протона, поставляемого хлороводородом, к концевому атому углерода:
В образовавшемся карбокатионе положительный заряд не закреплен полностью на втором атоме углерода, поскольку он находится под действием подвижной π-электронной пары соседней двойной связи. В, результате положительный заряд частично переносится на концевой атом углерода:
Однако и в этом катионе положительный заряд полностью не сосредоточен на концевом атоме углерода, т.к. возможно и обратное перемещение π-электронов с переходом положительного заряда на второй атом углерода. Наиболее устойчивое состояние – промежуточное (мезомерное) между двумя рассмотренными. Это состояние изображают в формулах двуглавой стрелкой:
Поэтому катион (сопряженный или мезомерный) можно записать так:
Присоединение аниона хлора проходит у первого и третьего атома углерода:
52

Получается смесь продуктов присоединения. Процентный выход того или иного продукта зависит от условий (температуры, растворителя и пр.). При действии второй молекулы хлороводорода присоединение к оставшейся двойной связи идет по правилу Марковникова с образованием дихлорида.
Подобно реакции с хлороводородом проходят реакции с бромом, хлором и др.
Любые реакции присоединения к алкадиенам протекают в два этапа: сначала образуются соединения с одной двойной связью, а затем – предельные. Так, бром присоединяется преимущественно по концам молекулы по схеме:
В случае избытка брома он присоединяется по месту двойной связи 1,4-дибромбутена-2. Для алкадиенов с сопряженными связями важная реакция – реакция полимеризации. В
присутствии катализатора легко протекают реакции полимеризации дивинила, изопрена. При этом образуются преимущественно продукт 1,4-присоединения и частично 1,2-присоединения. Приведем схему полимеризации бутадиена-1,3:
В общем виде реакцию полимеризации бутадиена-1,3 можно представить так:
Дивинил и изопрен – мономеры для получения синтетических каучуков.
3.9 Натуральный каучук
Натуральный каучук получают из млечного сока тропических деревьев, преимущественно из гевеи. Поскольку млечный сок, или латекс, представляет собой коллоидный раствор, то для выделения каучука раствор подвергают коагуляции
(нагреванию, действию кислоты).
Каучук – твердое вещество, состоящее, как показал анализ, из двух элементов: углерода и водорода. Молекулярная масса его составляет несколько сотен тысяч (150000–500000). Для установления строения каучука проведем его разложение при нагревании (рис. 3.13). Парообразные продукты собираются в приемнике, состоящем из двух пробирок. При этом можно заметить обесцвечивание бромной воды, что показывает образование непредельных продуктов. Было доказано, что основной продукт разложения – ве-
Рис. 3.13. Прибор для разложения щество состава C5H8, т. е. изопрен, каучука
53
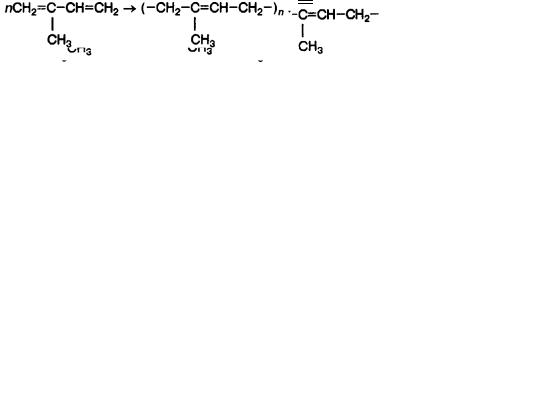
CH2 C CH CH2 CH3
Отсюда можно сделать вывод: натуральный каучук – природный полимер, макромолекулы которого состоят из звеньев –C5H8–.
Образование макромолекул в результате полимеризации можно схематично представить следующим образом:
Или в виде сокращенной схемы:
Макромолекулы каучука имеют линейную структуру, они не вытянуты в одну линию, а как бы свернуты в клубок. Наличие в составе макромолекул двойных связей характеризует каучук как непредельный полимер. Структура каучука, его непредельный характер обусловливают физико-механические и химические свойства.
Наиболее ценное свойство каучука – высокая эластичность: под действием силы можно растягивать каучук, а после снятия нагрузки он сжимается, принимает прежнюю форму, т. е. каучуку свойственна упругая деформация. Высокая эластичность каучука находит свое объяснение: при растяжении каучука клубкообразные макромолекулы распрямляются и образец становится в несколько раз длиннее; при снятии нагрузки макромолекулы возвращаются в прежнее состояние (в результате внутреннего теплового движения звеньев). Разумеется, если приложить очень большую силу к тонкому образцу каучука, то макромолекулы будут не только распрямляться, но и смещаться относительно друг друга, и образец разорвется.
Каучук термопластичен – при нагревании он теряет эластичность и приобретает свойство пластичности: образец каучука размягчается, его можно сильно вытянуть, т.к. происходит смещение одних молекул относительно других, но в свое прежнее состояние он не возвращается. При дальнейшем нагревании каучук плавится.
Линейная структура каучука обусловливает образование вязких растворов. Молекулы растворителя (например, бензина) постепенно ослабляют межмолекулярные силы в каучуке, в результате получается вязкий раствор, в котором хаотично расположены крупные молекулы.
Раствор каучука обесцвечивает бромную воду и раствор перманганата калия, поскольку в его макромолекулах – большое число двойных связей. За счет этих связей возможны реакции присоединения (водорода, галогена, серы и др.).
Большое практическое значение имеет реакция каучука с серой. Чтобы понять ее значение, скажем, что изделия из натурального каучука в жару размягчаются, растягиваются, становятся липкими, а в морозную погоду становятся жесткими и хрупкими. Оказывается, эти недостатки каучука исчезают, если он вступит в реакцию с серой и превратится в резину. Данный процесс протекает при нагревании и называется вулканизацией.
Для вулканизации готовят смесь каучука, серы, наполнителей (особенно сажи) и других добавок. Смесь нагревают, при этом сера вступает во взаимодействие с макромолекулами каучука, как бы сшивает' их химическими связями в сетку:
54

Сшивание макромолекул каучука происходит только в отдельных местах (для вулканизации берется немного серы: 2-3% от общей массы), что показано на рисунке 3.15. В результате полученный материал (резина) приобретает пространственную (сетчатую) структуру. В нем кроме межмолекулярных сил появились еще химические связи – соединительные мостики. Этим объясняются более высокие физико-механические свойства резины по сравнению с каучуком: повышенная механическая прочность, устойчивость к растворителям (резина только набухает при продолжительном действии растворителя, но не дает раствора). У резины отсутствует термопластичность (она не размягчается при нагревании), для нее характерна исключительно высокая эластичность (нет остаточной деформации). Отсутствие у резины остаточной деформации легко объяснимо: при приложении силы сетка только растягивается, ее растяжение ограничивается поперечными мостиками серы, при снятии нагрузки сетка возвращается в прежнее состояние.
Рис. 3.15. Схема строения вулканизированного каучука (кружками обозначены звенья макромолекул каучука)
Резина более устойчива к кислороду воздуха, чем каучук (он легко окисляется, стареет).
3.10 Алкины (ацетиленовые углеводороды)
Алкины – углеводороды, в молекулах которых содержится тройная связь С≡С.
Простейший представитель гомологического ряда –ацетилен. В названии ацетиленовых углеводородов суффикс –ан алканов меняется на суффикс -ин:
Из ацетиленовых углеводородов наибольшее значение имеет ацетилен. Это – бесцветный газ, который немного легче воздуха, незначительно растворим в воде. Чистый ацетилен не имеет запаха (неприятный запах технического ацетилена объясняется присутствием различных
55

примесей).
Строение алкинов. Строение алкинов рассмотрим .на. примере ацетилена. Его структур-
ная формула Н–С≡С–Н, а электронная формула, H : C : : C : H где атомы углерода связаны тремя парами электронов.
С помощью физических методов установлено линейное строение молекулы ацетилена, определено расстояние между ядрами атомов углерода – 0.12 нм. Как объяснить такое строение молекулы ацетилена? Теоретически это объясняют sp-гибридизацией (третьим валентным состоянием атома углерода).
При образовании тройной связи в гибридизации участвуют один s-электрон и один р- электрон:
У каждого атома углерода – две гибридные орбитали, которые максимально удалены друг от друга (угол 180°С). По одной орбитали они затрачивают на образование в связи С–С, другие орбитали идут на образование связей С–Н (рис. 3.16).
Рис. 3.16. Схема образования σ-связей в молекуле ацетилена
Рис. 3.17. Схема образования π-связей в молекуле ацетилена
Оставшиеся у каждого атома углерода две р-орбитали (негибридизованные) взаимно перекрываются и образуют две π-связи, расположенные взаимно перпендикулярно (рис. 3.17). Их образование приводит к тому, что ядра атомов углеродов сближаются, длина связи уменьшается. Уменьшается также длина связи С–Н в молекуле ацетилена по сравнению со связью С–Н в этилене: соответственно 0.106 нм и 0.1086 нм, т. к. доля s-орбитали в sp-орбитали больше, чем в sp2-орбитали. Сближение атомов передает масштабная модель (рис. 3.18 а). Шаростержневая модель ацетилена представлена на рисунке 3.18 б.
Рис 3.18. Модели молекулы ацетилена: а – масштабная, б – шаростержневая
Тройная связь суммарно прочнее двойной связи: энергия связи C≡C – 810 кДж/моль, энергия связи С=С – 620 кДж/моль. Однако наличие в молекулах непрочных π-связей обусловливает высокую реакционную активность ацетилена.
56
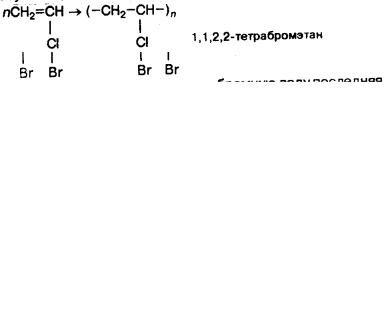
Химические свойства. Для ацетилена и его гомологов характерна реакция присоединения. Реакция протекает в две стадии: вначале разрывается одна π-связь, а затем другая:
При пропускании ацетилена в бромную воду последняя обесцвечивается. Это качественная реакция на алкены и алкины.
Большое значение имеет реакция ацетилена с хлороводородом:
СН≡СН + НСl –→ СН2=СН–Сl.
Винилхлорид – мономер, при полимеризации которого образуется ценный полимер – поливинилхлорид:
присоединяет синильную кислоту в присутствии катализатора (Cu2Cl2 + NН3) с образованием акрилонитрила:
СН≡СН + HCN –→ СН2=СН–СN.
Акрилонитрил – мономер, его полимер – полиакрилонитрил, из которого получают волокно нитрон.
Алкины легко окисляются. Так, если в раствор перманганата калия пропускать ацетилен, фиолетовый раствор обесцвечивается. Реакция окисления перманганатом калия – качественная реакция на кратные связи (двойную и тройную).
На воздухе ацетилен горит коптящим пламенем. Если в пламя ацетилена вдувать воздух или кислород, он будет сгорать полностью, без копоти. При этом температура достигает
3000°С:
2C2H2 + 5O2 –→ 4CO2 + 2H2O, ∆Н<0.
Горение ацетилена в кислороде используется для автогенной резки и сварки металлов. Смесь ацетилена с воздухом или кислородом взрывчатая.
Ацетилен может вступать в реакцию замещения, при этом атомы водорода в его молекулах замечтаются некоторыми металлами (Аg, Сu, Na). Объяснить это можно тем, что sp- гибридизация приводит к некоторой поляризации связей С–Н, к увеличению подвижности водородных атомов. В результате ацетилен проявляет как бы слабые кислотные свойства. При взаимодействии ацетилена с аммиачными растворами оксида серебра или хлорида меди (I) образуются ацетилениды:
Н–С≡С–Н + 2[2Аg(NН3)2]+ОН– –→ Аg–С≡С–Аg + 4NН3 + 2Н2O,
ацетиленид серебра
Н–С≡С–Н + 2[Сu(NН3)2]+Сl– –→ Сu–С≡С–Сu + 4NН3 + 2НСl.
ацетиленид меди
Ацетилениды серебра и меди в сухом виде взрывоопасны. Гомологи ацетилена (R–
С≡CH) также образуют ацетилениды.
Повышенной подвижностью атомов водорода объясняется способность ацетилена к реак-
ции окислительной поликонденсации:
Сu2Сl2
H–C≡C–H + Н–С≡С–Н + Н–С≡С–Н + ... + nO2 ––→ (–C≡C–)n + nН2O.
Полученный полимер назван карбином, в его состав входят макромолекулы с тройными и
57
с кумулированными двойными связями =С=С=. В карбине атомы углерода находятся в состоянии sp-гибридизации, т. е. макромолекулы его имеют строго линейную структуру. Карбин – черный порошок, выдерживающий температуру 2300°С (выше ее переходит в графит). Его считают третьим аллотропным видоизменением углерода, углерод здесь находится в третьем валентном состоянии (в алмазе углерод находится в первом валентном состоянии; а в графите – во втором валентном состоянии).
Отметим еще одно химическое свойство ацетилена – способность вступать в реакцию полимеризации. В зависимости от условий реакция может протекать с образованием соединений линейного или циклического строения. Под действием хлорида одновалентной меди можно получить димер ацетилена – винилацетилен:
Н–С≡С–Н + Н–С≡С–Н –→ Н–С≡С–СН=СН2.
Присоединяя хлороводород, винилацетилен образует хлоропрен – мономер для получения хлоропренового каучука:
Н–С≡С–СН=СН2 + НСl –→ СН2=ССl–СН=СН2.
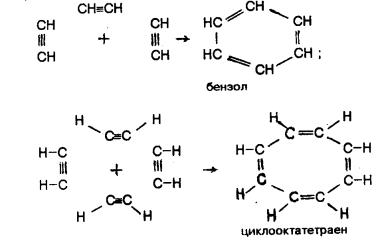
В других условиях молекулы ацетилена соединяются с образованием цикла:
Ацетилен широко применяется как химическое сырье для получения хлорпроизводных (например, 1,1,2-трихлорэтена ClHC=CCl2), применяемых в качестве растворителей, уксусной кислоты, некоторых пластмасс, волокон и каучуков.
Получение алкинов. Ацетилен в промышленности получают двумя способами.
1. Карбидный способ. Карбид кальция бурно реагирует с водой с выделением ацетилена:
СаС2 + 2Н2О –→ С2Н2 + Са(ОН)2 .
Карбид кальция получают в электропечах при нагревании кокса с негашеной известью:
СаО + 3С –→ СаС2 + СО.
2. Из природного газа. При нагревании (до 1500°С) природного газа происходит крекинг (расщепление) метана и его гомологов:
2СН4 –→ С2Н2 + ЗН2; ∆Н>0.
Гомологи ацетилена получают из дигалогенопроизводных алканов при нагревании со спиртовым раствором гидроксида калия:
СН3–СН2–СНСl2 + 2КОН –→ СН3–C≡СН + 2КСl + 2H2O, СН3–СНСl–СНСl–СН3 + 2КОН –→ СН3–С≡С–СН3 + 2КСl + 2Н2О.
58
